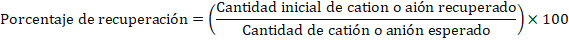INTRODUCCIÓN
El depósito atmosférico, que consiste en la transferencia de contaminantes desde la atmósfera, ocurre a través de tres mecanismos: deposición seca (material particulado), deposición húmeda (lluvia y nieve) y los intercambios en fase gaseosa (Fonseca Duarte et al., 2014; Forsius, 2021; Martín y Santamaría, 2000). Estudiar este depósito permite identificar las concentraciones de cationes y aniones que se introducen en los ecosistemas forestales, lo que facilita el análisis de sus posibles efectos en el medio ambiente.
El Material Particulado Atmosférico (MPA) se refiere a un conjunto de partículas sólidas o líquidas que permanecen en suspensión en la atmósfera, excluyendo el agua pura. Estas partículas pueden tener un origen natural, como el polvo mineral resuspendido, el aerosol marino, las emisiones volcánicas y biogénicas, o un origen antropogénico, derivado de actividades humanas como la quema de combustibles fósiles y la industrialización (Inza et al., 2006; Meszaros, 1993). El término MPA abarca tanto las partículas en suspensión, que son más pequeñas y pueden permanecer en la atmósfera durante periodos prolongados, como las partículas sedimentables, que tienen un diámetro aerodinámico mayor a 20 µm y se caracterizan por sedimentar rápidamente debido a su mayor tamaño y peso (Aldabe, 2011; Chávez, 2018; MITECO, 2022). A nivel global, las emisiones de partículas de origen natural suelen ser más abundantes que las de origen antropogénico, aunque estas últimas son de gran preocupación debido a su impacto en la salud humana y en el medio ambiente (Forsius, 2021; Viana Rodríguez, 2003).
Los efectos adversos del Material Particulado Atmosférico (MPA) son diversos y dependen de las propiedades físico-químicas de las partículas. Estas partículas pueden tener impactos inmediatos y significativos en los ecosistemas, especialmente cuando se encuentran en altas concentraciones. Por ejemplo, las partículas de mayor diámetro, como el polvo mineral, pueden depositarse sobre las hojas de las plantas, reduciendo su capacidad de intercambio gaseoso y afectando la fotosíntesis, lo que limita el crecimiento vegetal (Grantz et al., 2003). Además, la presencia de metales en el MPA puede alterar la química del suelo, inhibiendo la absorción de nutrientes por las plantas, lo que perjudica su desarrollo y productividad (Aldabe, 2011).
El MPA también puede contribuir a problemas ambientales más amplios, como la acidificación y eutrofización de suelos y cuerpos de agua superficiales. Estos procesos pueden desequilibrar la composición química de las aguas subterráneas, afectando tanto la calidad del agua como la biodiversidad de los ecosistemas acuáticos y terrestres. La interacción de las partículas con otros contaminantes en el ambiente agrava estos efectos, subrayando la necesidad de una gestión efectiva de la calidad del aire para proteger los ecosistemas y la salud humana.
En el marco del programa ICP-IM, el Parque Natural del Señorío de Bértiz en Navarra (43,8° N, 1,36° O) alberga el único punto de seguimiento para los contaminantes depositados en los ecosistemas españoles. Este programa lleva a cabo diversas actividades de monitorización, que incluyen la medición del depósito total (bulk deposition), el agua de trascolación (throughfall) y el agua de escorrentía cortical (stem flow). En estas muestras se determinan diversos aniones como cloruro (Cl−), nitrato (NO3-), sulfato (SO4 2-) y nitrito (NO2−), así como cationes como sodio (Na+), magnesio (Mg), calcio (Ca), potasio (K), aluminio (Al), cromo (Cr), manganeso (Mn), hierro (Fe), cobalto (Co), níquel (Ni), cobre (Cu), zinc (Zn), arsénico (As), cadmio (Cd) y plomo (Pb).
Las Resinas de Intercambio Iónico (RII), Son materiales sintéticos, sólidos e insolubles en agua, que se presentan generalmente en forma de esferas o perlas de 0,3 a 1,2 mm de tamaño efectivo, aunque también pueden encontrarse en forma de polvo, facilitan la separación de iones mediante la transferencia de materia en la interfaz fluido-sólido. Su funcionamiento se basa en la transferencia de uno o más iones de la fase fluida al sólido, intercambiando o desplazando iones de igual carga que están unidos a grupos funcionales superficiales por fuerzas electrostáticas (Mounia, 2013). Estas resinas, que pueden reaccionar como ácidos, bases o sales, tienen la capacidad de retener exclusivamente cationes o aniones, dependiendo de su composición (Nevárez, 2010). Compuestas por una alta concentración de grupos polares, ácidos o básicos, incorporados a una matriz de polímero sintético, las resinas actúan absorbiendo iones de las soluciones (generalmente agua) y liberando cantidades equivalentes de otros iones (Herrera-Calderón y Palomino-Downham, 2012). Una de las principales ventajas de las RII es que, mediante un tratamiento con una solución regenerante, pueden recuperar su capacidad de intercambio original.
MATERIALES Y MÉTODOS
Ubicación
El Parque Natural del Señorío de Bértiz, con una extensión de 2.040 hectáreas, se encuentra al noroeste de la Comunidad Foral de Navarra, España, dentro del municipio de Bértiz-Arana. Esta área natural protegida está situada en las estribaciones de los Pirineos occidentales, ofreciendo un entorno de gran diversidad ecológica y paisajística, caracterizado por frondosos bosques, ríos y una rica biodiversidad (Figura 1).
Técnicas
Las muestras se recolectaron una vez por semana durante un periodo de tres meses, comprendiendo los meses de febrero, marzo y abril de 2015 que coinciden con la transición del invierno a la primavera en la región. Este lapso temporal permitió capturar variaciones estacionales en las condiciones climáticas y en la composición del agua de lluvia. Este parque, ubicado en las estribaciones de los Pirineos occidentales, se caracteriza por un entorno natural diverso, con densos bosques de robles (Quercus robur) y hayas (Fagus sylvatica), pero también de Quercus ilex, Quercus faginea, Quercus pubescens, Tilia platiphyllos, Acer opalus, entre otros; así como un sistema de ríos y arroyos que atraviesan el paisaje montañoso. La elección de este escenario fue clave para estudiar la deposición atmosférica en un ecosistema forestal representativo, donde la interacción entre el material particulado atmosférico y la vegetación es un factor relevante para la investigación.
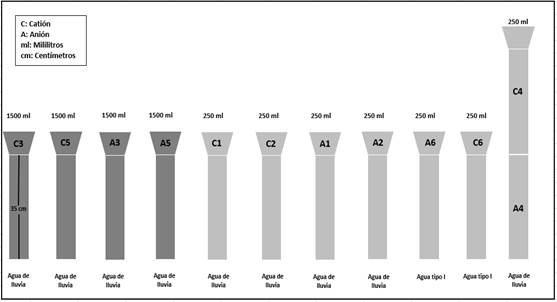
Se fabricaron 12 prototipos utilizando tubos de PVC, seis de ellos destinados a la recolección de aniones y los otros seis a la recolección de cationes (ver Figura 2).
Cada prototipo fue rellenado con una resina específica: para el análisis de cationes se utilizó Lewatit S1567 y para aniones, Lewatit M600. Lewatit S1567 es una resina fuertemente ácida compuesta por pequeñas esferas de distribución uniforme, elaboradas a partir de un copolímero de estireno divinilbenceno, fabricado sin el uso de disolventes. Por otro lado, Lewatit M600 es una resina fuertemente básica de granulado uniforme, también basada en un copolímero de estireno-divinilbenceno, diseñada específicamente para la desmineralización.
Las cantidades de lluvia simulada, tanto para aniones como para cationes, se calcularon tomando como referencia la precipitación media mensual registrada por la estación Irurtzun. Estas mediciones se realizaron durante los meses de marzo, abril y mayo en la localidad de Etxeberri, Navarra, España. Durante un período de tres meses, se vertió agua de lluvia, extraída de los ecosistemas forestales, en cada colector en cantidades variables que se observa en la Figura 2.
Para la preparación de la resina para aniones, se utilizaron 6 litros de hidróxido sódico (NaOH) al 3,2%, combinándolo con 1800 ml de agua tipo I y 200 mL de NaOH al 32%. Se emplearon tubos de PVC de 35 cm de largo y 1,50 cm de diámetro, cuyos extremos se envolvieron con cinta de teflón. En la parte superior del tubo, se insertó un embudo de 7,5 cm de diámetro con una capacidad de 500 mL. Para evitar el derrame de las resinas al verter el agua de lluvia o el agua tipo I, se colocó algodón Symec en la parte inferior de los tubos. Además, se insertó un grifo de ¼ de pulgada en el extremo del tubo. En cada tubo, se vertieron 100 mL de Lewatit M600. Este proceso se repitió para los 6 colectores.
En cuanto a la preparación de las resinas para cationes, se utilizaron 6 litros de ácido clorhídrico (HCl) al 9,6%, combinándolo con 1400 mL de agua tipo I y 600 mL de HCl al 32%. Siguiendo el mismo procedimiento que para los aniones, se vertieron 100 mL de Lewatit S1567.
La Figura 3 muestra los prototipos utilizados. Dos de las resinas (A6 y C6) se utilizaron como control, para estimar la posible contaminación asociada a los iones liberados por las resinas.
En cuatro de las columnas, se simuló la cantidad promedio de precipitación que cae en la localidad de Etxeberri durante un período de tres meses. Según los cálculos realizados, se añadieron aproximadamente 250 mL de agua a cada columna dos o tres veces por semana (C1, C2, A1 y A2). En otras cuatro columnas, se simuló una cantidad de lluvia seis veces superior a la media, con el objetivo de estimar la capacidad de retención de las resinas bajo condiciones de mayor contaminación (C3, C5, A3 y A5). Para ello, se vertieron 1500 mL de agua de lluvia en cada colector dos o tres veces por semana. En dos de los prototipos, se colocaron ambos tipos de resinas (aniónica y catiónica) en el mismo tubo (C4 sobre A4).
Se distribuyó el agua de lluvia recolectada desde Etxeberri en 9 recipientes, cada uno con una capacidad de 5 L. Antes de su distribución, se pesaron los recipientes para calcular la cantidad de iones suministrada a cada resina y, posteriormente, recalcular el porcentaje recuperado.
En las resinas C3, C5, A3 y A5, se vertió agua de lluvia en siete ocasiones, mientras que en los prototipos C1, C2, A1 y A2, se añadió el volumen total en dos veces. Durante este proceso, se recogieron muestras de los recipientes LL1, LL2, LL6, LL7 y LL4 cada 15 días. En el caso de los recipientes LL3, LL5, LL8 y LL9, las muestras se recogían en cada llenado, ya que se vertían 1.500 mL, un volumen seis veces superior a la media. Para verificar la ausencia de contaminación durante el proceso de llenado, los prototipos C6 y A6 se trataron con agua Milli-Q o tipo I.
Las muestras recolectadas cada 15 días de los recipientes LL1, LL2, LL6, LL7 y LL4 fueron filtradas y divididas en dos recipientes distintos: uno destinado al análisis de aniones y otro para el análisis de cationes, este último acidificado con HNO3. Este mismo procedimiento se aplicó a las muestras de los recipientes LL3, LL5, LL8 y LL9. La Tabla 1 presenta la periodicidad y la cantidad de agua de lluvia que se añadió a cada resina.
Tabla 1 Total de agua vertido a cada prototipo durante 3 meses
| Envases | Prototipos | Cantidad de agua /mL (2 a 3 x semana) | Agua total (L) (3 meses) |
|---|---|---|---|
| LL1 | C1 | 250 | 4,91 |
| LL2 | C2 | 250 | 4,95 |
| LL8 | C3 | 1500 | 31,29 |
| LL5 | C5 | 1500 | 31,42 |
| Agua tipo I | C6 | 250 | 4,20 |
| LL6 | A1 | 250 | 4,92 |
| LL7 | A2 | 250 | 4,95 |
| LL9 | A3 | 1500 | 31,10 |
| LL3 | A5 | 1500 | 31,36 |
| Agua tipo I | A6 | 250 | 4,20 |
| LL4 | C4-A4 | 250 | 5,02 |
Antes de la extracción, se realizó un lavado con agua de Tipo I para asegurar que no hubiera fugas. Con el grifo cerrado, se vertieron 100 ml de H2O MQ y se dejó reposar durante un período de 20 minutos. Pasado este tiempo, se abrió el grifo, permitiendo que la solución saliera lentamente (aproximadamente 2 gotas por segundo) durante 10 minutos, antes de abrir completamente el grifo para permitir la salida de toda el agua vertida.
Para la extracción de los elementos retenidos en las resinas, se añadieron 200 mL de HCl a los prototipos de cationes y 200 mL de NaOH a los de aniones. Este procedimiento se repitió dos veces (100 mL y 100 mL), recogiendo el volumen total añadido (200 mL) en el mismo recipiente. Para las extracciones 2, 3 y 4, se cambió de recipiente y se realizaron dos lavados adicionales con 100 mL de solución extractante, siguiendo el procedimiento anteriormente mencionado. Las concentraciones de los aniones se determinaron mediante Cromatografía Iónica y las de los cationes mediante Espectrometría de Masas con Plasma Acoplado Inductivamente (ICP-MS) (ver Figura 4).
El modelo estadístico aplicado fueron cálculos de recuperación porcentual para cada catión y anión en función del volumen inicial de agua añadido y el catión y anión final recuperado. Este porcentaje de recuperación se calcula como se indica en la ecuación 1:
En los resultados obtenidos, algunos porcentajes de recuperación superan el 100 %, lo que indica como un fenómeno de sobreconcentración en ciertos cationes o aniones. Para comparar los prototipos de forma más clara, los datos se presentan en una escala logarítmica, lo que ayuda a visualizar las diferencias y variabilidad en las recuperaciones de cationes y aniones entre prototipos.
RESULTADOS Y DISCUSIÓN
El análisis de aniones no ha logrado proporcionar valores cuantitativos de los diferentes compuestos analizados. Esto se debe a la interferencia generada por los iones OH presentes en la solución extractante, cuya señal es tan intensa que oculta los picos de los demás aniones. Según Bisht et al. (2022), en el análisis de aniones como Cl− (cloruro), SO42−(sulfato) y NO3−(nitrato), estos contribuyen con un 15%, 11% y 7%, respectivamente, resultando en una relación SO42−/NO3− de 1,49. Esto indica una contribución del 60% y 40% de los iones SO42− y NO3−, respectivamente, dentro del límite previsto de RW (H2SO4, 60-70% y HNO3, 30-40%). Actualmente, se están considerando técnicas analíticas alternativas para determinar los aniones extraídos de las resinas. Mientras tanto, las muestras se han congelado para evitar cualquier variación en su composición química.
En cuanto a los cationes, las concentraciones de los elementos analizados y su porcentaje de recuperación con respecto al agua añadida muestran variaciones entre las resinas. Esto indica que estas no presentan un comportamiento homogéneo. Además, las eficiencias de recuperación varían en función del volumen de agua añadido, dando lugar a resultados dispares dependiendo de los elementos (ver Tabla 2).
Tabla 2 Resumen de los porcentajes de recuperación de los cationes retenidos en cada columna
| 1500 mL | 250 mL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| C3 | C5 | ẋ | σ | C1 | C2 | C4 | ẋ | σ | |
| Ca | 60,63 | 15,81 | 38,22 | 31,69 | 50,78 | 92,06 | 76,41 | 73,08 | 20,84 |
| Na | 49,20 | 38,62 | 43,91 | 7,48 | 71,33 | 98,54 | 62,11 | 77,33 | 18,94 |
| K | 87,21 | 53,21 | 70,21 | 24,04 | 65,45 | 118,56 | 106,27 | 96,76 | 27,80 |
| Mg | 64,07 | 30,12 | 47,10 | 24,01 | 49,37 | 87,29 | 71,06 | 69,24 | 19,03 |
| Fe | 45,04 | 30,46 | 37,75 | 10,31 | 105,61 | 134,93 | 234,93 | 158,49 | 67,80 |
| Al | 90,51 | 61,20 | 75,86 | 20,73 | 142,51 | 178,81 | 352,19 | 224,50 | 112,06 |
| Mn | 135,16 | 72,96 | 104,06 | 43,98 | 190,23 | 377,74 | 493,36 | 353,78 | 152,98 |
| Zn | 47,79 | 29,43 | 38,61 | 12,98 | 63,56 | 57,95 | 122,04 | 81,18 | 35,49 |
| Cu | 53,50 | 34,64 | 44,07 | 13,34 | 97,45 | 102,71 | 126,25 | 108,80 | 15,34 |
| Cr | 24,53 | 23,54 | 24,04 | 0,70 | 143,74 | 209,08 | 369,31 | 240,71 | 116,06 |
| Co | 65,67 | 43,48 | 54,58 | 15,69 | 108,29 | 138,93 | 301,84 | 183,02 | 104,04 |
| Ni | 276,00 | 182,56 | 229,28 | 66,07 | 317,74 | 344,26 | 376,84 | 346,28 | 29,60 |
| As | 100,93 | 191,42 | 146,18 | 63,99 | 645,61 | 1568,86 | 4364,15 | 2192,87 | 1936,22 |
| Cd | 123,66 | 121,45 | 122,56 | 1,56 | 215,02 | 292,64 | 5343,85 | 1950,50 | 2938,98 |
| Pb | 85,21 | 82,92 | 84,07 | 1,62 | 369,38 | 441,52 | 1099,96 | 636,95 | 402,59 |
Con datos de los resultados de laboratorio (σ: desviación estándar; ẋ: media)
En el prototipo C3, al que se añadieron 1500 mL de agua de lluvia, los porcentajes de recuperación fluctuaron entre un 24,53% (Cr) y un 276% (Ni). Sin embargo, en el prototipo C5, los porcentajes de recuperación variaron desde un 15,8% (Ca) hasta un 191,4% (As). Estas diferencias en la recuperación de cationes se produjeron a pesar de haber suministrado la misma cantidad de agua durante tres meses con una periodicidad uniforme. Según Kumar et al., (2022), los cationes predominantes en el análisis de aguas de lluvia fueron Ca2+ (43,10%) y Na+ (31,97%). No obstante, estos porcentajes fueron inferiores a los obtenidos en este estudio.
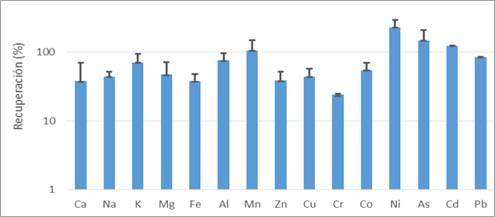
Para los prototipos C1, C2 y C4, a los que se añadieron 250 mL de agua de lluvia, las diferencias en el porcentaje de recuperación fueron bastante significativas, para ello se utilizaron medidas de tendencia central y dispersión, específicamente la media y la desviación estándar, para cada catión analizado. Estos parámetros permitieron identificar el comportamiento promedio y la variabilidad en la recuperación de cationes oscilando entre el 5350% para el Cd y el 60% para el Na. A pesar de estas grandes diferencias, estas columnas mostraron un comportamiento promedio en términos de los cationes Ca, K, Mg, Zn y Cu. Esto revela que, con una cantidad de 250 mL, se pueden obtener las concentraciones de los cationes Ca, K, Mg, Zn y Cu, tal como indica Gregson et al., (2022), donde los cationes Ca2+, Mg2+ y K+ fueron los que mostraron mejores resultados en los iones detectados en el agua de lluvia. La Figura 5 presenta la media y la desviación estándar de la recuperación de cationes de C3 y C5 con 1500 mL de agua de lluvia, representadas en una escala logarítmica.
En el prototipo C3, la recuperación fue superior al 90% para los cationes K (87,2%), Al (90,5%), As (100,9%), Cd (123,7%) y Pb (85,2%). El prototipo C5 mostró un comportamiento similar, con una buena recuperación para los cationes Mn (73,0%), Cd (121,5%) y Pb (82,9%). Es importante destacar que en ambos prototipos (C3 y C5), el Pb, un elemento de gran interés debido a su toxicidad, se recuperó con gran eficacia (85,2% y 82,9%, respectivamente). Según el modelo de factorización de matriz positiva (PMF) de Yang et al. (2020), a partir de la precipitación se identificó una media ponderada de las concentraciones de cationes como Ca2+ > K+ > Na+ > Mg2+, siendo mayor en invierno y primavera en comparación con verano y otoño. Por lo tanto, el período de muestreo podría extenderse durante un año para cada estación. Además, según Han et al., (2019), en una muestra de aguas de lluvia, el catión más abundante fue Ca2+, lo cual puede explicarse por la neutralización de la acidez del agua de lluvia mediante la disolución de los aerosoles atmosféricos. En la Figura 6 se presenta la media y desviación estándar de la recuperación de cationes de C1, C2 y C4 con 250 mL de agua de lluvia en escala logarítmica.
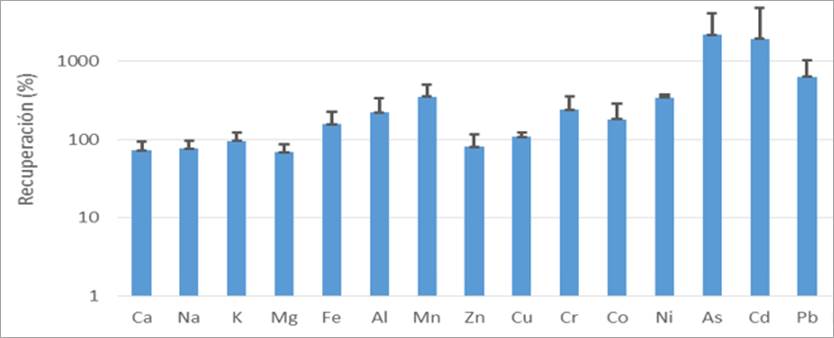
Figura 6 Media y desviación estándar de la recuperación de cationes (C1, C2 y C4) en escala logarítmica
En el prototipo C1, la recuperación fue superior al 90% para los cationes As (645,61%), Pb (369,38%) y Ni (317,74%), entre otros. En el prototipo C2, los cationes que mostraron mayores porcentajes de recuperación fueron As (1568,86%), Pb (441,52%) y Ni (344,26%). En el prototipo C4, los cationes As (2192,28%), Cd (1950,50%) y Pb (636,95%) presentaron los mayores porcentajes de recuperación. Estos resultados evidencian que las lluvias contienen en gran medida arsénico, cadmio y plomo. Según un estudio realizado por Chubaka et al. (2018), se encontraron metales como arsénico (As), cadmio (Cd) y plomo (Pb) en las aguas de lluvia, aunque sus niveles estaban por debajo del límite de salud establecido, excepto en áreas altamente industriales.
En los tubos que han sido lavados con una mayor cantidad de agua, y que por lo tanto han recibido una carga iónica superior (seis veces superior a la media), se ha logrado recuperar la mayoría de los cationes. Por otro lado, Fenn et al. (2003) han empleado metodologías para determinar el depósito de nutrientes en los ecosistemas forestales, logrando así reducir la recolección de muestras a una o dos veces al año. Esto facilita el seguimiento de un mayor número de sitios, incluyendo lugares remotos, y resulta en una reducción significativa de los costes.
CONCLUSIONES
La interferencia de los iones hidroxilo en las columnas destinadas al análisis de aniones sugiere la necesidad de utilizar técnicas analíticas diferentes a la cromatografía iónica para obtener resultados precisos. Sin embargo, la falta de técnicas alternativas impidió confirmar la eficacia de la resina utilizada. En cuanto al análisis de cationes, aunque el porcentaje de recuperación de los elementos fue aceptable (70%-130%), la recuperación no fue uniforme en todas las columnas. Esto indica la necesidad de minimizar fuentes de error, como impurezas y variaciones en el proceso de llenado y extracción de las columnas. A pesar de que las resinas lograron retener el 100% de los elementos, su recuperación no fue homogénea. Elementos como el níquel, arsénico, cadmio y plomo mostraron mayor presencia en las aguas de lluvia de los ecosistemas forestales, lo que subraya la importancia de optimizar el proceso de extracción utilizando soluciones de diferentes concentraciones para mejorar la recuperación de todos los elementos.