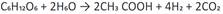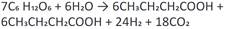INTRODUCCIÓN
Con el crecimiento poblacional, cada vez se requiere más energía para suplir todas las actividades diarias de la sociedad como transporte, industria, actividad doméstica, entre otros. Por tal razón, se han venido realizando muchas investigaciones sobre cómo hacer una transición energética segura y eficaz, ya que el uso de combustibles fósiles genera gases de efecto invernadero (GEI) que contribuyen a exacerbar los efectos del cambio climático. Una de las soluciones más atractivas es la producción de bio-hidrógeno como combustible a partir de biomasa en reemplazo de los derivados del petróleo y principalmente del gas natural, ya que su composición está libre de carbono 1,2.
Con relación a lo anterior, el mundo se ha fijado la meta de ser carbono neutral a más tardar en el 2050 3, y gracias a esto se ve una oportunidad muy grande en la producción de hidrógeno para hacer la tan anhelada transición energética y ponerle un alto al avance del cambio climático 4. En el aspecto económico, se sabe que el costo del hidrógeno como portador de energía no contaminante será más estable y rentable que cualquier otra fuente 5.
Hoy en día el gas de hidrógeno se obtiene en promedio un 40% a partir de gas natural, 30% del petróleo, 18% del carbón, 4% por electrolisis y 1% a partir de biomasa 6).
El hidrógeno se puede obtener a partir de múltiples vías, como el reformado de hidrocarburos, que es un proceso termoquímico y actualmente es el método más utilizado para la producción de hidrógeno. También se tiene la electrolisis de agua, que es un proceso electroquímico que disocia la molécula del agua en sus dos componentes, hidrógeno y oxígeno; la gasificación del carbón, un proceso donde se realiza una oxidación parcial que genera una mezcla de gases, mayoritariamente monóxido de carbono e hidrógeno; la termólisis del agua, que consta de la descomposición de agua por medios térmicos mediante un proceso por ciclos a una temperatura aproximada de 1000 K; procesos fotoquímicos, donde la producción de hidrógeno se efectúa por la disociación del agua por medio de radiación solar usando foto catalizadores químicos; la biofotólisis del agua, que consiste en aprovechar la luz para disociar la molécula del agua; reformado de etanol y azúcares, y también por medio de fermentación oscura a partir de biomasa 7,8.
La obtención de hidrógeno por medio de fermentación oscura a partir de diversas fuentes de biomasa se da principalmente por bacterias aerobias y anaerobias facultativas del género Clostridium formadoras de esporas, facultativas de los géneros Enterobacter y Bacillus 9, algunas bacterias termofílicas 10 y acidogénicas anaerobias provenientes de lodos (11). Aquí los monosacáridos son la principal fuente de carbono, donde se destaca particularmente la glucosa, seguido de la xilosa, el almidón, la celulosa y otras fuentes que pueden ser generadas a partir de hidrólisis de polisacáridos, proteínas y lípidos, y por esta vía se da la reacción de biotransformación 12.
Por otro lado, con el creciente consumo mundial de energía, se estima que, en el año 2050, para abastecer los vehículos de energía, se necesitarán 110 millones de toneladas de hidrógeno 13; ya que, las aplicaciones más comunes del hidrógeno se encuentran en la industria del transporte terrestre, como combustible de autos y camiones; también, en la industria aeroespacial, la producción de electricidad, la síntesis de amoniaco y fertilizantes, la refinación de metales y el calentamiento 14.
II. METODOLOGÍA
En esta revisión, se pretende presentar una visión completa sobre el biohidrógeno desde la perspectiva general del hidrógeno como materia prima y como vector energético, considerando las diferentes tecnologías de producción y profundizando en la fermentación oscura como una forma viable de producirlo. Varios estudios han presentado la biomasa como una materia prima para obtener hidrógeno; sin embargo, a lo largo de este estudio de revisión, se presenta de manera descriptiva la fermentación oscura, sus características y las variables de proceso más relevantes; por lo tanto, se hace necesario conocer los diferentes tipos de biomasa que pueden utilizarse, así como los microorganismos más adecuados para realizar un proceso sostenible debido a la alta capacidad de producción de H2, combinada con la obtención de otros subproductos de alto interés y valor comercial. Por último, se revisa brevemente el impacto ambiental asociado con el uso de las diferentes tecnologías relacionadas con la producción de hidrógeno, en contraste con la fermentación oscura, y el papel de la ingeniería química y su contribución al establecimiento de la economía del hidrógeno.
Para la realización de este trabajo se recurrió a una búsqueda exhaustiva en Internet, por medio de diversas bases de datos como Scopus, Google Scholar y Researchgate, haciendo una clasificación según el número de citas. La mayoría de las fuentes corresponden a artículos científicos publicados en los últimos diez años, sin dejar de tener en cuenta documentos de años anteriores de gran importancia que fueron referencia para investigaciones posteriores. A continuación, se organizó la información relacionada con la obtención de hidrógeno a partir de biomasa por medio de fermentación oscura, cuyas palabras claves conformaron la ecuación de búsqueda para la realización del análisis bibliométrico.
III. RESULTADOS Y DISCUSIÓN
Métodos de obtención de hidrógeno
• Reformado de metano
El reformado de metano con vapor es un proceso utilizado a lo largo de varias décadas y es una de las tecnologías más económicas que se utiliza en la actualidad en la producción industrial de H215. La reacción se efectúa a 870 °C sobre un catalizador de níquel empacado en los tubos de un horno de reformación produciendo CO y H2, después el CO producido reacciona con vapor de agua para formar hidrógeno adicional en la reacción de desplazamiento con agua. Este método tiene otras variantes como el reformado en seco, el reformado autotérmico, entre otros 7.
• Electrólisis de agua
Cuando los volúmenes de hidrógeno no son elevados, el hidrógeno se obtiene por electrólisis. La reacción electrolítica se suele realizar en medio alcalino, debido a que en estas condiciones se incrementa la conductividad eléctrica. El hidrógeno producido en el cátodo se debe purificar, ya que contiene impurezas de oxígeno y un cierto nivel de humedad. La purificación se realiza por medio de secado con un adsorbente, y las impurezas de oxígeno se eliminan con un convertidor DeOxo 16).
En la electrólisis, una corriente eléctrica divide el agua en hidrógeno y oxígeno, se utiliza 4,9 - 5,6 kWh por cada m3 de hidrógeno producido, lo que resulta al menos dos veces más costoso que el hidrógeno obtenido por reformado de gas natural 17. También se tiene la electrólisis de membrana polimérica protónica (PEM, por sus siglas en inglés), que consiste en utilizar una membrana de intercambio de protones y un electrolito polimérico sólido 18.
• Reformado de líquidos renovables
Los combustibles líquidos renovables, como el etanol, pueden reaccionar con vapor a altas temperaturas 2. Entre los líquidos de carácter renovable más utilizados actualmente destacan, el bioetanol principalmente, el biodiesel y el glicerol. El bioetanol se presenta como la principal alternativa al CH4 como fuente de hidrógeno debido a las grandes cantidades que se producen y a la existencia de excedentes disponibles en algunos países, en comparación con el resto de biocombustibles 19.
• Pirólisis
Proceso termoquímico que ocurre en ausencia de oxígeno. Consiste en la dosificación y alimentación de materia prima a un reactor (combustibles, madera, carbón vegetal, carbón, biomasa, etc.), la transformación de la materia orgánica; y finalmente, la obtención y separación de los productos obtenidos como hidrógeno, metano y otros. Algunas variantes del proceso son la pirolisis acuosa, anhidra y al vacío 20,21.
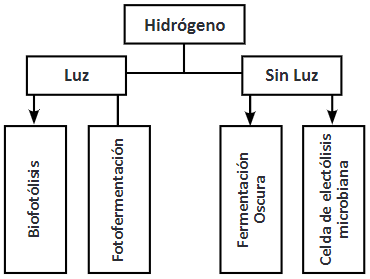
• Fotofermentación
La fotofermentación es un proceso de transformación de materia orgánica en hidrógeno, empleando la luz solar como catalizador del metabolismo 22. Los microorganismos responsables son principalmente bacterias púrpuras de los géneros Rhodopseudomonas y Rhodobacter, organismos heterótrofos que precisan de una fuente de carbono como fuente de electrones 23.
• Biofotólisis del agua
Proceso biológico de producción de hidrógeno a partir de la hidrólisis del agua por fotosíntesis, empleando luz solar como catalizador de la reacción. Consiste en la ruptura del agua en oxígeno y protones, llevada a cabo por microorganismos fotosintéticos como cianobacterias 24,25.
• Celda de electrólisis microbiana
La celda de electrólisis microbiana es un sistema que utiliza la actividad de microorganismos electroactivos para convertir materia orgánica en electricidad o productos químicos como H2. Es una tecnología en desarrollo con potencial para contribuir a la producción de energía renovable y el tratamiento sostenible de aguas residuales 26,27.
La fermentación oscura es otro método que puede emplearse para la producción de hidrógeno del cual se hablará a continuación. Los procesos de obtención de hidrógeno biológico exclusivamente se resumen en la Figura 1.
La fermentación oscura como método de producción de biohidrógeno
Mediante diversas investigaciones se ha llegado a producir hidrógeno por un método denominado fermentación oscura, que también suele llamarse fermentación de hidrógeno oscuro 29. Este método se lleva a cabo principalmente a partir de la degradación de carbohidratos (azúcares); usualmente, los monosacáridos son la principal fuente de carbono, donde se destaca la glucosa, el almidón, la celulosa, la xilosa y otras fuentes, lo que lo hace un método ventajoso respecto a otros, porque esta fuente es relativamente barata y tiene bajas demandas de energía 30. La fermentación oscura se caracteriza por ser un fenómeno omnipresente en condiciones anóxicas o anaeróbicas. Las bacterias utilizan la reducción de protones a hidrógeno a través de hidrogenasa como medio para oxidar los transportadores reducidos durante la fermentación, lo cual permite que los transportadores se reciclen y mantengan la neutralidad eléctrica para que el sustrato pueda generar un suministro continuo de adenosín trifosfato (ATP) 31.
La producción de hidrógeno por este método es dada por bacterias anaeróbicas que crecen en oscuridad y usan sustratos ricos en carbohidratos. Los subproductos de la fermentación lo constituyen: ácido acético, con rendimiento de un máximo teórico de 4 mol H2/mol glucosa 32; y ácido butírico, con un rendimiento de un máximo teórico de 3,4 mol H2/mol glucosa. Con lo que los rendimientos prácticos de hidrógeno en la fermentación oscura están alrededor de 2 mol H2/mol glucosa 33.
Diversos estudios han demostrado que el hidrógeno fermentativo se puede producir a través de cultivos microbianos acidogénicos mixtos o a través de cultivos definidos y puros de microorganismos productores 34.
Las principales reacciones son 35:
Respecto a las temperaturas más óptimas para producir hidrógeno por medio de la fermentación se tiene: desde mesófilas 25 - 40 ºC; hasta termófilas 40 - 65 ºC 10,36; extremófilas 65 - 80 ºC, e hipermófilas >80 ºC 34; produciéndose biogás con algunos elementos como H2, CO2, CO, H2S y, en algunos casos muy raros, CH437.
Algunos resultados de investigaciones han llegado a conclusiones de que los microorganismos termófilos y, en particular los termófilos extremos y los hipertermófilos, son los más opcionados para producir hidrógeno a partir de biomasa, ya que el aumento de la temperatura mejora la cinética de reacción y por consiguiente mejora el rendimiento final del proceso 38,39.
Los principales microorganismos termófilos que se han estudiado incluyen Caldicellulosiruptor saccharolyticus 40, Thermoanaerobacterium thermosaccharolyticum, Thermotoganapolitana y Thermotoga marítima 41.
Las especies bacterianas más conocidas que producen hidrógeno por este sistema son los géneros Enterobacter, Bacillus y Clostridium, que generan buenos rendimientos 42,43.
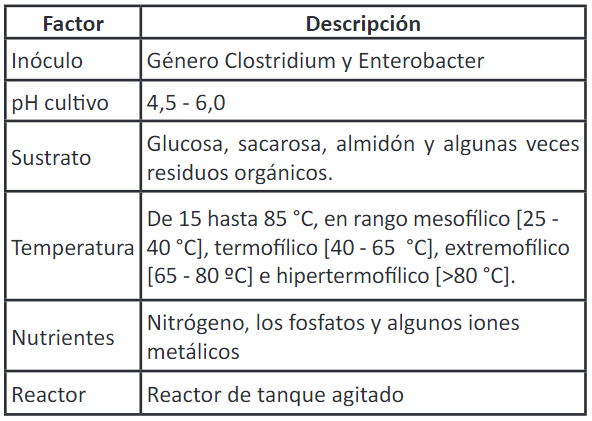
La producción de hidrógeno depende también de otros factores que afectan el rendimiento durante el proceso, como lo es el pH, que de acuerdo a diversos estudios su valor óptimo es de 5,5 44; la presión parcial del gas, que no debe ser alta, ya que inhibe la producción de hidrógeno 45; inóculo, sustrato, tipo de reactor 46; nutrientes, como nitrógeno, fosfato, iones metálicos, y la temperatura 47. Estos factores se resumen en la Tabla 1.
Para maximizar la cantidad producida de hidrógeno, el metabolismo de la bacteria debe enfocarse hacia la producción de ácidos grasos volátiles (AGV) 48.
C. Tipos de biomasa utilizada
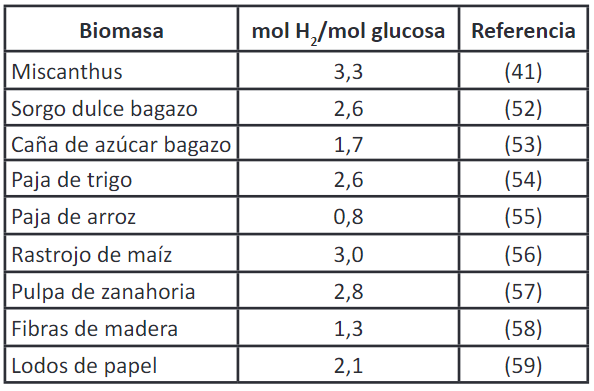
Para la producción de hidrógeno se utilizan diferentes tipos de biomasa que contengan materiales ricos en carbohidratos o azúcares fermentables, y se requiere de condiciones específicas para maximizar la producción de hidrógeno. Diferentes cepas de microorganismos y diferentes fuentes de biomasa pueden requerir ajustes en las condiciones de fermentación para obtener un rendimiento óptimo de hidrógeno 49. Algunos ejemplos de biomasa utilizada para la fermentación biológica del hidrógeno incluyen: residuos de cultivos ricos en almidón, como maíz, patatas, yuca, arroz, entre otros; residuos de procesamiento de alimentos, como residuos de la industria azucarera, residuos de panadería y almidones de residuos de la industria alimentaria; residuos de la industria papelera, como lignocelulosa, que puede ser tratada para liberar azúcares fermentables; y residuos orgánicos municipales, como residuos de alimentos y otros materiales orgánicos que contengan carbohidratos 50. A lo largo de varias investigaciones realizadas se han obtenido diferentes resultados respecto al uso de biomasa lignocelulósica 51. Lo anterior se presentan en la Tabla 2.
Pretratamiento de la biomasa
El pretratamiento se realiza para romper la capa de lignina que protege la celulosa y la hemicelulosa, para que la biomasa sea más accesible a la digestión, también ayuda a disminuir la cristalinidad de la celulosa y aumentar la porosidad 60. El pretratamiento se puede clasificar en estos grupos principales:
• Mecánicos (fresado y molienda): En este pretratamiento físico, el tamaño de las partículas se reduce, lo que conduce a un aumento en el área superficial y el tamaño de poro, y a una disminución en la cristalinidad y grado de polimerización de la celulosa 60,61.
• Biológicos: Se realiza por acción de microorganismos (bacterias y hongos) o de enzimas, obteniéndose mejoras en el rendimiento respecto a la biomasa sin pre tratar, desde 10% a más del 100% 60.
• Químicos: Incluye ácidos, álcalis, líquidos iónicos y compuestos oxidantes 62. Se tiene como función primaria remover la hemicelulosa y las ligninas presentes en la biomasa 60.
• Fisicoquímicos: Se rompen los enlaces de hidrógeno y se incrementa el área superficial a temperaturas entre 50 - 250 °C como resultado de una explosión de vapor o agua caliente 60,63.
• Hidrólisis enzimática: Es un proceso catalítico donde participan diferentes enzimas, esto genera la ruptura de polímeros de celulosa y hemicelulosa para obtener monómeros como glucosa y xilosa 64,65. Además, se producen azúcares que son directamente utilizados por todos los microorganismos vivos. Las enzimas más comunes son alfa y beta amilasa 66.
Reactor
El tipo de reactor más utilizado es el tipo Bath y son pocos los experimentos efectuados en régimen continuo, esto se debe probablemente a la simple operación y control en el primero 11. Algunos reactores utilizados 67,68:
• Reactor Anaeróbico de Flujo Ascendente (UASB, por sus siglas en inglés) para tratamiento de aguas residuales, con un rendimiento de 2,45 mol H2/mol glucosa.
• Reactor de Lecho Fluidizado Anaeróbico (FABR, por sus siglas en inglés) con un rendimiento de 1,01 mol H2/g DQO.
• Reactor de Placa Plana (FPPBR, por sus siglas en inglés) con un rendimiento de 4,44 mol H2/ mol glucosa.
• Reactor de Tanque Agitado Continuo (CSTR, por sus siglas en inglés) con un rendimiento de 1,32 ± 0,16 mol H2/mol hexosa.
• Reactor de Lecho Fluidizado (FBR, por sus siglas en inglés), con un rendimiento de 1 mol H2/mol xilosa.
La cinética de la reacción de fermentación oscura para producir hidrógeno es un proceso gradual y altamente dependiente de la actividad microbiana y está influenciada por varios factores, como la concentración de sustrato, la temperatura, el pH, la concentración de biomasa microbiana y la disponibilidad de nutrientes 69.
Microorganismos utilizados
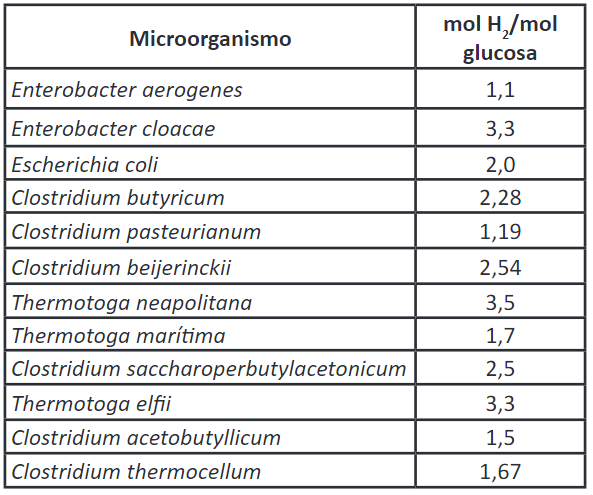
Como resultado de muchas investigaciones, se han obtenido resultados importantes acerca del uso de microorganismos capaces de producir hidrógeno molecular como producto metabólico durante su crecimiento. Estos microorganismos son conocidos como bacterias fototróficas o bacterias fermentativas 42,43. En la Tabla 3 se presentan resultados respecto al rendimiento en la producción de hidrógeno.
La obtención de hidrógeno por medio de procesos fermentativos tiene ventajas en comparación con los procesos térmicos, como la gasificación y la termólisis del agua, ya que convierte la biomasa con alto contenido de humedad en hidrógeno; y además, no requieren grandes instalaciones, por lo que puede darse a pequeña escala, y con ello se puede producir hidrógeno todo el día, sin la necesidad de luz y con un consumo bajo de energía, lo que resulta muy rentable 29. Algunos géneros y especies de bacterias han sido muy estudiados y se ha referenciado, especialmente utilizando cultivos con cepas puras de microorganismos, con diferentes sustratos y a condiciones específicas. Por otro lado, también se ha podido aislar microflora de cultivos mixtos de diversas fuentes de desecho, que son menos sensibles a la contaminación de bacterias consumidoras de hidrógeno en comparación con los cultivos puros. Lo anterior se presenta en las Tabla 4 y Tabla 5.
Tabla 4 Procesos por lotes para fermentación oscura usando cultivos puros
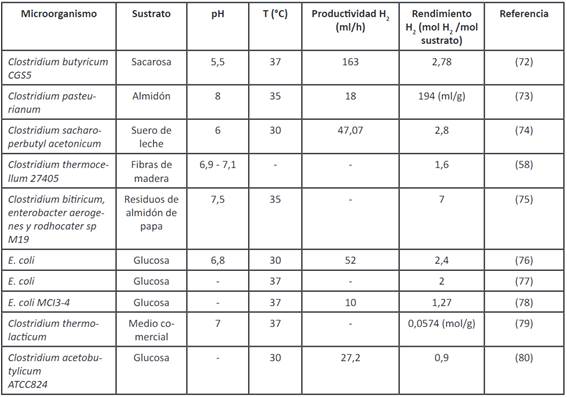
Elaboración propia basada en 81
Tabla 5 Procesos por lotes para fermentación oscura usando algunos cultivos mixtos
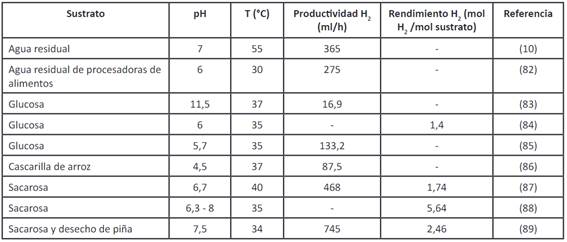
Elaboración propia basada en 81
Otra investigación presenta los efectos del tiempo de retención de sólidos en la producción de hidrógeno, la degradación de la glucosa como sustrato y las bacterias anaerobias en los procesos de tratamiento anaeróbico 90. En este estudio se evidenció que, al aumentar el tiempo de retención, los recuentos de bacterias anaerobias generales y bacterias formadoras de ácidos grasos volátiles en cada reactor aumentan, mientras que los recuentos del género Clostridium y bacterias reductoras de sulfato disminuyen. El contenido de hidrógeno gaseoso también disminuye con el aumento del tiempo de retención de sólidos.
Impacto ambiental
El impacto ambiental en los procesos industriales siempre existirá, ya que se utilizan recursos energéticos, o materias primas que se traducen en bienes y servicios 33. Por lo tanto, los procesos de obtención de hidrógeno no son la excepción, y la generación de GEI constituye uno de los principales impactos ambientales asociados con ello.
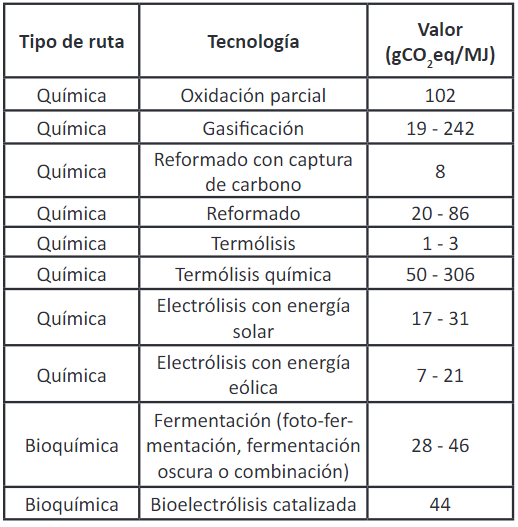
En la Tabla 6 se presentan los resultados obtenidos del cálculo de los GEI para diferentes tecnologías relacionadas con la producción de hidrógeno, utilizando la metodología Análisis de Ciclo de Vida (LCA, por sus siglas en inglés) 91. Allí se puede contrastar la fermentación oscura con otras tecnologías, donde se consideraron las siguientes etapas: extracción y adquisición de materias primas, fabricación, transporte y distribución, uso, mantenimiento y reparación, y fin de vida útil 92,93.
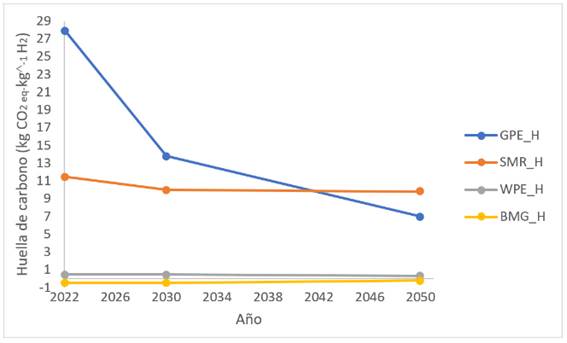
El impacto ambiental se puede traducir a la denominada huella de carbono, que, para el caso de la producción de hidrógeno como vector energético, se ha venido estudiando a lo largo del tiempo 43. Hay diversas tecnologías que se han usado, como el Reformado de Metano con Vapor (SMR_H, por sus siglas en inglés), la Gasificación de Biomasa (BMG_H, por sus siglas en inglés), la Electrólisis de Agua Alcalina (GPE_H, por sus siglas en inglés) con energía de la red eléctrica y la Electrólisis de Agua Alcalina con energía eólica (WPE_H, por sus siglas en inglés) 43,94. Para el año 2030 y 2050 las rutas más contaminantes son las de origen fósil y las menos contaminantes son las opciones renovables (WPE_H y BMG_H), con huellas de carbono estables alrededor de cero 95. La Figura 2 muestra el avance de las tecnologías hasta el año 2050 y su impacto traducido a huella de carbono.
La producción de hidrógeno por fermentación oscura es una vía potencialmente más sostenible en comparación con la producción de hidrógeno a partir de combustibles fósiles, ya que utiliza microorganismos que consumen CO2 durante el proceso, lo que puede reducir la huella de carbono en comparación con las tecnologías convencionales. Sin embargo, se hace necesario tener en cuenta algunos factores para evaluar adecuadamente la huella de carbono tales como consumo de carbono, emisiones de gases de efecto invernadero, eficiencia del proceso y energía utilizada.
Papel de la Ingeniería Química
A lo largo de los últimos años, con el aumento del uso del petróleo y el gas natural, el ingeniero químico encaminó la evolución de estas materias primas con el fin de producir bienes y servicios que son esenciales para la vida de los seres humanos hoy en día, tal como la urea, la gasolina, el diésel y una larga lista de plásticos y polímeros 35. Sin embargo, queda la pregunta de cómo abordará los desafíos impuestos por los recursos renovables, la obtención de los productos químicos y el suministro de energía.
Los ingenieros químicos encontraron un gran atractivo en el uso de la herramienta LCA. Los aspectos del ejercicio LCA, como la construcción de diagramas de flujo de proceso, el establecimiento de límites del sistema, la definición de una unidad funcional y el equilibrio de masa y energía, son todos muy familiares para el ingeniero químico. Con esto, se ha trabajado en el desarrollo de nuevos combustibles como el hidrógeno, por medio de diferentes métodos, como la fermentación oscura, por ejemplo, aportando en aspectos tan importantes como el diseño de reactores o de plantas químicas, el control de parámetros de proceso, la optimización del medio de cultivo, la evaluación de la cinética de reacción, y la recuperación y purificación del hidrógeno 93,96.
Desde la Ingeniería Química se ha venido trabajando para dar solución a los graves problemas ambientales que existen hoy en día. Por ejemplo, el ingeniero James A. Trainham y sus colegas plantean el uso de combustibles solares para generar hidrógeno, comparando cuatro rutas prometedoras, fotoelectroquímica, termoquímica, electrólisis/térmica y gasificación de biomasa, todas impulsadas por energía solar 97. También se ha estudiado el diseño de biorreactores para la producción de hidrógeno, específicamente por medio de la fermentación oscura, a partir de residuos agroindustrial 98,99.
Por otra parte, se tienen importantes desafíos y oportunidades en el campo de la biología sintética en rápido crecimiento, donde es imprescindible el rol que los ingenieros químicos pueden desempeñar en su avance. La biología sintética brinda numerosas y excelentes oportunidades para los ingenieros químicos, en el desarrollo de nuevos procesos para la producción a gran escala de biocombustibles, productos químicos de valor agregado y terapias de proteínas. Sin embargo, abundan los desafíos en todas las escalas. En particular, la modularización y estandarización de los componentes de un sistema biológico, siguen siendo el mayor obstáculo de la biología sintética 100.
En general, la industria química ha progresado en el tratamiento de las preocupaciones ambientales. El desarrollo de la química verde y su implementación tanto en la academia como en la industria ha promovido una mentalidad más sostenible en los ingenieros químicos 96. La aplicación de los principios de la química verde en la producción de hidrógeno es fundamental para avanzar hacia una economía sostenible y con menor impacto ambiental, con menores emisiones de GEI, valorización de subproductos, y generación y almacenamiento de energía renovable.
En conjunto, los aportes de la Ingeniería Química en la fermentación oscura ayudan a mejorar la eficiencia y la sostenibilidad de este proceso de producción de hidrógeno, lo que favorece su aplicación como un vector energético limpio y renovable en el futuro.
IV. CONCLUSIONES
• Las investigaciones relacionadas con la producción de hidrógeno por diferentes medios, como la fermentación oscura, proponen al hidrógeno como una alternativa de biocombustible para mitigar los efectos del cambio climático.
• La revisión revela que el uso de biomasa lignocelulósica, como bagazo de caña de azúcar, paja de trigo, paja de arroz, rastrojo de maíz, pulpa de zanahoria, etc., es una excelente fuente de carbono fermentable para producir biohidrógeno con altos rendimientos.
• Mediante el método de fermentación oscura, los géneros bacterianos Enterobacter, Bacillus y Clostridium, dadas sus características fisicoquímicas, generan unos rendimientos aproximadamente de 2 mol H2/mol glucosa.
• Las condiciones de operación más sensibles de controlar en el proceso de producción de hidrógeno fermentativo son pH, inóculo, sustrato, tipo de reactor, nutrientes y temperatura. Si alguno de estos parámetros se altera repentinamente, se puede disminuir drásticamente el rendimiento (mol H2/mol glucosa), ya que pueden verse alteradas las rutas metabólicas utilizadas.
• Una de las limitantes para el uso de la fermentación oscura en la obtención de hidrógeno es su velocidad y volumen de producción, que suelen ser muy reducidos en comparación con la producción de hidrógeno a partir de otras tecnologías renovables.
• El proceso de fermentación oscura puede generar hidrógeno de manera eficiente y con una menor huella de carbono en comparación con los métodos tradicionales basados en combustibles fósiles, con 28 - 46 g CO2eq/MJ, y se convierte en una alternativa prometedora en la búsqueda de fuentes de energía más limpias y sostenibles.
• En América Latina se debe promover el desarrollo de más investigaciones respecto a la obtención de hidrógeno a partir de biomasa, una materia prima abundante en el entorno, para así propiciar una mayor diversidad de fuentes energéticas.