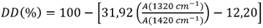I. INTRODUCCIÓN
La contaminación por metales pesados es uno de los problemas más significativos tanto para el ser humano como para el ecosistema, especialmente la contaminación causada por cromo hexavalente (VI) en aguas residuales generadas por la industria curtiembre. En el Ecuador las curtiembres son responsables de muchos problemas ambientales debido a la dosificación exagerada de productos químicas en los procesos de curtido, malas prácticas de manufactura, falta de capacitación, etc., lo cual genera aguas residuales con alta carga contaminante 1. El cromo hexavalente es un metal altamente tóxico que según La Agencia Internacional para la Investigación del Cáncer (IARC), es un compuesto carcinogénico para los seres humanos 2, constituyendo un grave problema ambiental teniendo en cuenta que, en el Ecuador, varios estudios de efluentes revelan dosis de cromo hexavalente muy por encima de los límites permitidos, que según la norma vigente no debe superar los 0.05 mg/L en aguas de uso doméstico, agrícola y ganadero 3. En los últimos años, se han empleado diversos métodos para eliminar cromo hexavalente de aguas residuales, entre los cuales se pueden mencionar: la separación por ósmosis inversa 4-6, reducción de cromo (VI) a cromo (III) usando carbón activado 7) y el uso de agentes adsorbentes como las matrices de quitosano 8, o nanopartículas magnéticas 9
Las nanopartículas son entidades físicas que se encuentran en la escala nanométrica, presentan particulares propiedades superparamagnéticas y mayor área de contacto 10. Gracias a estas propiedades se han utilizado ampliamente para la eliminación de contaminantes, debido a que son considerablemente rápidos, simples, sensibles y altamente eficientes para el aislamiento y remoción de metales pesados. Actualmente existen muchas investigaciones que comprueban la adsorción de varios metales pesados como el cadmio, arsénico, cromo (VI), etc. 11, con un porcentaje de remoción de hasta el 98%. Sin embargo, las nanopartículas cuando se encuentran desnudas son químicamente muy activas y se oxidan fácilmente debido a cambios de pH, temperatura, luz, entre otros; lo cual resulta en pérdida de propiedades magnéticas y propiedades adsorbentes después de largos periodos de tiempo 12. Una solución a este problema es utilizar agentes de recubrimiento como surfactantes (ácido oleico) o matrices poliméricas como el quitosano.
Las matrices de quitosano presentan importantes características tanto adsorbentes como quelantes, por esta razón son muy usadas en el tratamiento de efluentes contaminados para remover metales pesados 13,8. Este polímero biodegradable es sintetizado a partir de la quitina 14, residuo desaprovechado por la industria pesquera; la cual genera impresionantes cantidades de residuos sólidos, en su mayoría el caparazón de algunos crustáceos, y de ello aproximadamente el 5 % son aprovechados, y el resto es desechado al mar, convirtiéndose en un grave problema ambiental 15. Por lo tanto, las matrices de quitosano pueden utilizarse como agentes de recubrimiento de nanopartículas; formando nanomateriales compuestos llamados compositos con características multifuncionales y excelentes propiedades para la adsorción de metales pesados como cobalto, cadmio y arsénico 16,17,18,19. Si bien se han investigado con los metales pesados ya mencionados, no existen estudios que demuestren la adsorción de cromo hexavalente utilizando estos nanocompuestos.
La presente investigación tiene como finalidad verificar si las nanopartículas de magnetita recubiertas de quitosano (CS/NPsFe3O4), tienen la capacidad de adsorción de cromo hexavalente en soluciones acuosas, y a diferentes parámetros termodinámicos.
II. MATERIALES Y MÉTODOS
Materiales
Para la obtención del quitosano se utilizó hidróxido de sodio (NaOH), ácido clorhídrico (HCl) al 37%, etanol (C2H5OH), solución buffer pH 4, agua destilada. Para la síntesis de nanopartículas fue necesario cloruro ferroso tetrahidratado (FeCl2.4H2O), cloruro férrico hexahidratado (FeCl3.6H2O), amoniaco (NH3) al 25%, ácido acético (C2H4O2), agua destilada ultrapura. Los experimentos de adsorción se realizaron usando dicromato de potasio (K2Cr2O7), ácido sulfúrico al 96% (H2SO4), 1,5-difenilcarbazida, acetona.
Métodos
Obtención del quitosano:
El quitosano fue obtenido a partir del exoesqueleto del camarón siguiendo la metodología propuesta por Escobar et al. 14. En primer lugar, los caparazones del camarón (materia prima) fueron lavados con abundante agua y secados en una estufa a 40 °C por 2 horas, luego triturados y tamizados hasta un tamaño de partícula de entre 0.8 y 1.5 mm, luego, la materia prima fue sometida a un proceso de desproteinización, utilizando NaOH al 3,5% en una relación 1:10 y bajo agitación constante a 80 °C durante 2 horas. Se procedió a remover el carbonato de calcio presente en la muestra mediante un proceso de desmineralización utilizando una inmersión de HCl 2N en una relación 1:5, bajo agitación constante por 90 minutos a temperatura ambiente. Seguidamente, la muestra fue purificada con NaOH al 3,5% y una relación 1:5 a temperatura de 100 °C bajo agitación constante por 1 hora. En cada una de las etapas la muestra fue filtrada y lavada varias veces con agua destilada hasta pH neutro y secada en una estufa a 80 °C por 30 minutos, obteniendo así la quitina luego de la etapa de purificación. La quitina obtenida fue desacetilada utilizando una solución de NaOH al 50 % en una relación 1:10, bajo agitación constante por 1 hora, la muestra fue filtrada y lavada varias veces hasta pH neutro y secada en una estufa, obteniendo de esta manera el quitosano.
Determinación del porcentaje de desacetilación:
El grado de desacetilación del quitosano se determinó siguiendo el método propuesto por Brugnerotto et al. 19, quien relaciona dos bandas de absorbancia características a 1320 cm-1 y 1420 cm-1 mediante una correlación lineal expresada en la ecuación (1); Donde: DD (%), es el porcentaje de desacetilación, A (1320 cm-1) y A (1420 cm-1), son las absorbancias representativas del espectro IR del quitosano.
Síntesis y recubrimiento de nanopartículas de magnetita:
La síntesis de nanopartículas de magnetita fue mediante coprecipitación química y el recubrimiento de quitosano se lo realizó de manera In-situ, siguiendo la metodología propuesta por Kavaz et al. 20 tomando en cuenta algunos cambios realizados por Ranjbar y Hadjmohammadi 21. En primer lugar, se preparó una solución con 0.16 g de quitosano en ácido acético al 1 % (el pH de la solución fue ajustado a 4.8 con NaOH 5M). Luego se adicionó 1.34 g de FeCl2.4H2O y 3.40 g de FeCl3.6H2O en 100 ml de la solución de quitosano y se agitó por 30 minutos a 650 rpm. Una vez disuelto completamente se adicionó lentamente tanto la solución de NH3 1M como 10 ml de la solución de TPP al 2,5 % (p/v) bajo agitación constante y temperatura ambiente, hasta que la solución se tornó negra. Posteriormente las NPs fueron lavadas varias veces con agua destilada ultrapura hasta pH neutro y separadas mediante decantación magnética. Finalmente, la muestra fue secada en una estufa a 70 °C por 4 horas.
Caracterización mediante espectroscopía Infrarroja (IR):
La caracterización del quitosano y las nanopartículas sintetizadas se lo realizó mediante espectroscopía IR con transformada de Fourier (Jasco FT/IR-4100) a un rango de longitud de onda entre 400 y 4.000 cm-1, con la finalidad de verifiquen la síntesis, y determinar el grado de desacetilación en el caso del quitosano (DD%). Para el análisis se preparó una pequeña cantidad de muestra seca y se ubicó en la celda del espectrómetro FT-IR los resultados se visualizaron mediante el software Spectrum 10.
Caracterización de las nanopartículas mediante Microscopía Electrónica de Barrido (MEB):
El tamaño y morfología de las CS/NPsFe3O4 se realizó mediante MEB. Para lo cual, la muestra fue recubierta con una capa de oro antes del examen, con la finalidad de proporcionar una capa protectora a las muestras sometidas a alto voltaje. Para el análisis se usó el MEB de marca MEMMERT y el software ProSuite para la recolección de los datos.
Experimentos de adsorción de Cr (VI):
Para determinar la capacidad de adsorción de cromo (VI) se realizaron experimentos de adsorción por lotes (BATCH), tomando en cuenta parámetros termodinámicos como el pH (2, 3, 5, 7), concentración del adsorbente (0.4, 0.8, 0.1, 0.2 g), concentración inicial del contaminante (5, 15, 25 50 y 75 mg/L), tiempo de contacto (10, 30, 60 y 120 min) y temperatura (25, 40 y 60 °C). El proceso de adsorción se realizó en matraces Erlenmeyer de 100 ml con soluciones de Cr (VI) aforadas a 50 ml a partir de una solución madre de dicromato de potasio (K2Cr2O7), con ayuda de un agitador Excell Incubador Shaker Series a agitación constante de 250 rpm y 120 minutos en cada experimento. La cuantificación de la concentración remanente de Cr (VI) se realizó mediante espectroscopía UV-Visible por el método colorimétrico de la 1,5-difenilcarbazida 22, y a una longitud de onda de 540 nm.
Diseño experimental:
La capacidad de adsorción se determinó con la ayuda de un diseño experimental de tipo factorial a*b*c, donde los factores a, b y c corresponden a la concentración inicial de cromo (VI), tiempo de contacto y temperatura, además, se consideraron tres réplicas en cada experimento, resultando así 180 tratamientos. La variable de respuesta fue el % de adsorción de Cr (VI).
III. RESULTADOS
Obtención del quitosano
El quitosano fue obtenido a partir del exoesqueleto del camarón con un rendimiento de síntesis del 61 % y un peso molecular viscosimétrico de 6,29x105 g/mol.
Caracterización de quitosano mediante espectroscopía Infrarroja
Las principales bandas de absorbancia obtenidas tanto para la quitina como para el quitosano se observan en las Figuras 2, con valores similares a los reportados por Sierra 14, Cárdenas 23 y Parada et al. 24. En el espectro de la quitina (a) se observa una banda ubicada a 3430 cm-1 correspondiente a vO-H y vN-H, la cual es menos pronunciada en el espectro del quitosano (b) que se encuentra a 3289 cm-1. En el espectro del quitosano las bandas ubicadas a 1581 cm-1 correspondiente a la tensión vC-N, la banda a 1376 cm-1 de la amida III y los enlaces vC=O de la amida I a 1646 cm-1, son bandas menos pronunciadas en comparación con el espectro IR de la quitina, luego del proceso de desacetilación.
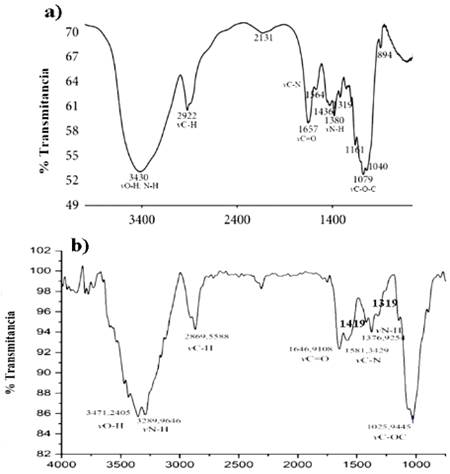
Figura 2 Espectro FT-IR de a) quitina b) quitosano, extraídos a partir del exoesqueleto del camarón a un rango de longitud de onda de 4000 cm-1 a 400 cm-1.
Por lo tanto, las bandas más representativas del quitosano son las que corresponden al estiramiento vN-H para la amida I que está a 3289 cm-1 y la banda ancha de vibración de tensión que indica vO-H a 3471 cm-1. Se observa una banda cercana a 1646 cm-1 que representa el estiramiento vC=O de la amida I y la banda que se observa a 1581 cm-1 indica la vibración de estiramiento vC-N de los grupos unidos a la unión vC=O. Se destacan también las bandas de absorbancia del grupo -CH2- que prevalece a los 2922 cm-1 en el espectro de la quitina en comparación al espectro del quitosano cuya banda es menos prominente a los 2869 cm-1, causado por la pérdida del grupo acetilo durante la desacetilación en medio básico.
Determinación del porcentaje de desacetilación (%DD)
En la Figura 2b se destacan las bandas de absorbancia a 1319 cm-1 y 1419 cm-1 cuyas longitudes corresponden a la amina I y al grupo hidroxilo, respectivamente; bandas usadas para determinar el % DD a partir de los valores de transmitancia (T1319cm-1 = 0.0197266, T1419cm-1= 0.0224853), dando como resultado 84.20 % de desacetilación en el quitosano obtenido a partir del exoesqueleto del camarón, mediante la ecuación 1.
Síntesis y caracterización de nanopartículas
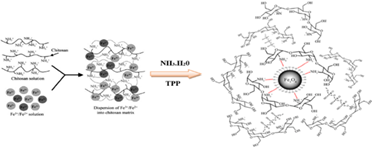
Las nanopartículas de magnetita recubiertas de quitosano fueron sintetizadas de manera In situ por el método de coprecipitación química, mediante las sales de FeCl2 y FeCl3 en una relación 1:2, a temperatura ambiente utilizando como reductor NH3 (25%), quitosano al 0.16% y como agente entrecruzante se utilizó el TPP (2,5%). La figura 3, muestra un esquema de la síntesis y la formación de puentes de hidrógeno entre los oxígenos de la magnetita y los grupos amino del quitosano.
Luego, las nanopartículas fueron caracterizadas mediante espectroscopía FT-IR; la Figura 4 describe los espectros tanto de las nanopartículas de magnetita sin recubrir (NPsFe3O4) como las nanopartículas recubiertas de quitosano (CS/NPsFe3O4) y el quitosano (CS) solo, a un rango de longitud de onda de 4000 cm-1 a 400 cm-1. La banda que se encuentra ubicada a los 543 cm-1 en el espectro (a) NPsFe3O4 y la banda a los 532 cm-1 en el espectro (b) CS/NPsFe3O4, representan la vibración vFe-O de tensión, y verifican la formación de la magnetita, 25.
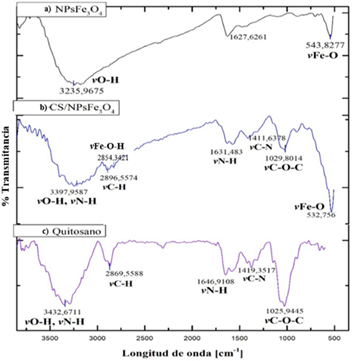
Figura 4 Espectros FT-IR de las NPs sintetizadas: a) NPsFe3O4 sin recubrir, b) CS/NPsFe3O4 y c) quitosano (CS); a un rango de 4000 cm-1 a 400 cm-1
En el espectro (b) CS/NPsFe3O4, se observan bandas características del quitosano ubicadas a 3397 cm-1 que representa el estiramiento del grupo vN-H y la vO-H correspondiente a los enlaces entre hidrógenos del quitosano, Además se presentan dos bandas a 1631 cm-1 y 1411 cm-1 que se les atribuye a la vN-H y vC-N, las cuales son bandas características del quitosano, y la banda de absorbancia a 2854 cm-1 que representa la formación de los puentes de hidrógeno de los grupos vFe-O-H con el grupo NH2 del quitosano corroborando el recubrimiento de las nanopartículas.
El tamaño y morfología de las nanopartículas se determinaron mediante MEB. Los resultados se observan en la Figura 5, donde se muestran las micrografías a una resolución de x60.000 aumentos. En el inciso a) se observan NPs a 100 nm y en el inciso b) a 50 nm. A partir de las cuales se puede observar agregaciones de NPs de forma esféricas y de morfología irregular característica. Además, se distinguen dos contrastes; las áreas oscuras corresponden a la Fe3O4, mientras que las áreas claras representan el recubrimiento con quitosano, evidenciando la formación del nanocompuesto CS/NpsFe3O4, con un diámetro promedio de 31,85 nm de diámetro, y excelentes propiedades superparamagnéticas.
Experimentos de adsorción
a) Influencia del pH:
El mayor % de adsorción se obtuvo a valores de pH 3 con 81,17 % de adsorción de Cr (VI). Lo cual coincide con los resultados obtenidos por Omidinasab et al. 25, quien plantea que las NPs magnéticas de quitosano tienen mayor capacidad de adsorción a pH ácido de 2 a 4, característica que se relaciona con la especie adsorbida.
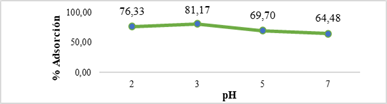
Figura 6 Resultados del porcentaje de adsorción de Cr (VI) utilizando CS/NPsFe3O4 a un rango de pH de 2 a 7 en 20 mg/L de Cr (VI) inicial.
b) Influencia de la concentración del adsorbente:
Los resultados se observan en la Figura 7, donde se demuestra la influencia que tiene la concentración del adsorbente sobre el porcentaje de adsorción de Cr (VI). El mismo que destaca un mayor porcentaje de adsorción a concentraciones de entre 0.08 g a 0.1 g, con porcentajes de adsorción de 89,90 % y 90,52 %, respectivamente.
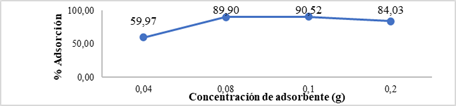
Figura 7 Resultados de la influencia de la concentración del adsorbente vs % Adsorción de Cr (VI) con CS/NPsFe3O4.
c) Influencia del tiempo de contacto y temperatura:
En la Figura 8 se observan las interacciones entre el tiempo de contacto y temperatura con relación al % de adsorción de Cr (VI); dicho porcentaje aumenta a la vez que aumenta tanto el tiempo de contacto como la temperatura, De manera que el porcentaje máximo de adsorción es del 99,70 %, a temperatura de 60 °C y 60 minutos de tiempo de contacto. Sin embargo, al aumentar el tiempo de contacto a 120 minutos y temperatura de 60 °C, existe disminución en el % de adsorción, por lo tanto, el proceso de adsorción en este caso alcanzó el equilibrio a los 60 minutos. Mientras que a temperaturas de 25 y 40 °C alcanzó el equilibrio a los 120 minutos, con porcentajes de adsorción de 85,07 % y 90,80 %, respectivamente.
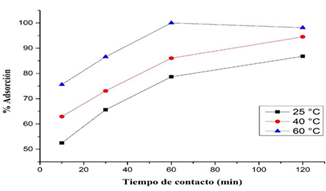
Figura 8 Relación de la temperatura y tiempo de contacto vs % de Adsorción de Cr (VI) con CS/NPsFe3O4.
d) Efecto de la concentración inicial del adsorbente:
Existe mayor capacidad de adsorción de Cr VI) cuando el adsorbato se encuentra a concentraciones bajas (Figura 9). Para cada temperatura se obtuvo mayor porcentaje de adsorción a concentración de 5 mg/L, destacando que existe un porcentaje de adsorción del 99,70 % y 99,53 % a 60 °C y concentraciones de 5 mg/L y 15 mg/L de Cr (VI), respectivamente.
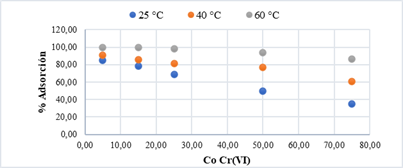
Figura 9 Efecto de la concentración inicial del Cr (VI) con relación al % de adsorción utilizando CS/NPsFe3O4 como agente adsorbente y 60 min de tiempo de contacto.
e) Estudio cinético:
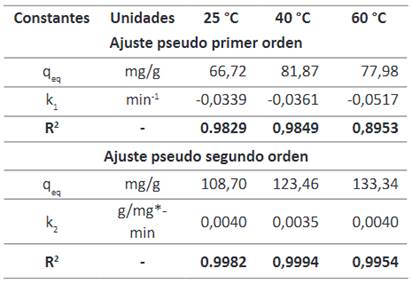
Los datos obtenidos a partir del diseño experimental se ajustaron al modelo cinético de pseudo primer orden y pseudo segundo orden, y a partir de los cuales se obtuvieron las constantes de velocidad según el modelo cinético descrito en la Tabla 1.
El modelo cinético de pseudo segundo orden es el que mejor se ajusta a los datos experimentales, lo cual se confirma con el coeficiente de regresión (R2) de 0.9982 para 25 °C, 0,9994 para 40 °C y 0,9954 para 60 °C, valores mayores a los obtenidos con el modelo de pseudo primer orden y el valor de qe para el modelo de pseudo segundo orden es aproximado al obtenido experimentalmente.
Tabla 1 Ajuste para los modelos cinéticos de pseudo primer orden y pseudo segundo orden para la adsorción de Cr (VI) mediante CS/NPsFe3O4
f) Isoterma de adsorción:
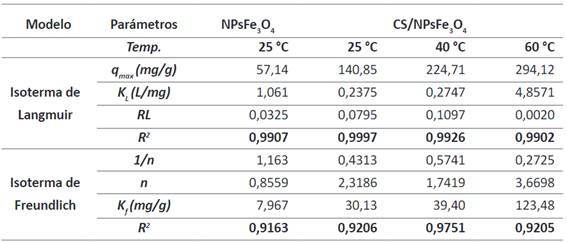
La isoterma de Langmuir es la que mejor se ajusta al proceso de adsorción de Cr (VI) como se muestra en la Figura 10, tanto para las NPs desnudas como funcionalizadas; dado que los valores R2, obtenidos de la linealidad de Langmuir son mayores a los obtenidos de la linealidad de Freundlich. A partir de la constante de Langmuir (KL) descrita en la Tabla 2 se deduce que existe mayor interacción entre el adsorbato y el absorbente a 60 °C con una KL de 4.86 L/mg, y los coeficientes RL son menores a 1 en cada caso, verificando que el proceso es favorable para dicha isoterma. Adicionalmente, a partir de la inversa de la pendiente en la ecuación de Langmuir se obtuvieron los valores de qmax. Para las NPsFe3O4 desnudas a 25°C fue de 57,14 mg/g, sin embargo, para las CS/NPsFe3O4 a la misma temperatura la qmax fue mayor, obteniéndose un valor de 140,85 mg/g, gracias al recubrimiento de quitosano sobre las NPs, que aumenta la capacidad de adsorción.
Así mismo, la capacidad de adsorción también varía con la temperatura, es decir, al aumentar la temperatura también aumenta la capacidad máxima de adsorción. A partir del modelo de Langmuir se obtuvieron valores de qmax para 40 °C de 224,71 mg/g, y para 60 °C de 275,48 mg/g. Por otro lado, a partir de la linealidad de Freundlich se destacan los valores de la constante n, la adsorción es favorable cuando los valores de n están entre 1 y 10. Según los datos obtenidos en la Tabla 2 se observa que el experimento de adsorción con CS/NPsFe3O4 también es favorable para la linealidad de Freundlich, verificando que la interacción entre el adsorbente y el Cr (VI) es muy fuerte, cosa que no sucede con NPsFe3O4 sin recubrir, que presentan una constante n < 1.
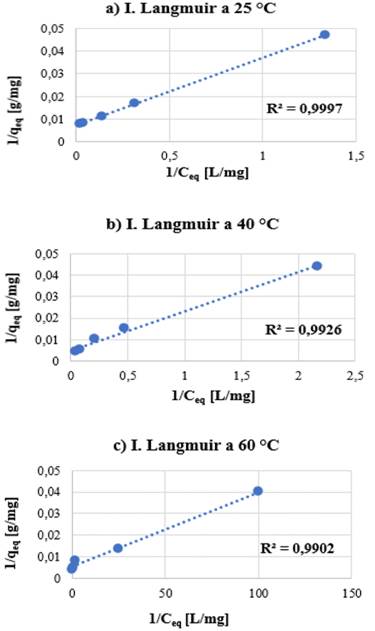
Figura 10 Isotermas de Langmuir para los experimentos de adsorción de cromo (VI) con CS/NPsFe3O4 a 25 °C, 40 °C y 60 °C.
Diseño experimental
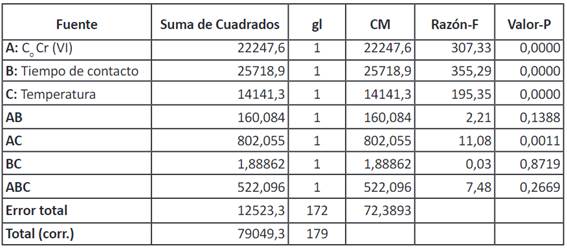
A partir del diseño experimental de tipo factorial a*b*c se verificaron los datos obtenidos experimentalmente; donde la variable dependiente % de adsorción de Cr (VI) si depende de los factores en estudio: concentración inicial de Cr (VI), tiempo de contacto y temperatura, luego de un análisis de varianza ANOVA con un valor-P menor a 0,05 rechazando la Ho a favor de la H1. Lo cual indica que los factores a, b, c y sus interacciones son estadísticamente significativos frente a la variable de respuestas.
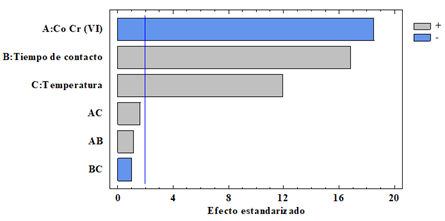
Figura 11 Diagrama de Pareto de los efecto positivos y negativos sobre la variable % adsorción Cr (VI).
A partir del diagrama de Pareto (Figura 11) se observa que el efecto A que corresponde a la concentración inicial de Cr (VI) tiene un efecto negativo con relación al % de adsorción, verificando lo antes mencionado en la figura 9, a menor concentración de contaminante (5 mg/L) se obtiene mayor porcentaje de adsorción; mientras que los factores B y C que corresponden al tiempo de contacto y temperatura, y sus interacciones con la concentración inicial (AB, AC), tienen un efecto positivo es decir, el mayor % de adsorción de Cr (VI) se dio al aumentar tanto el tiempo como la temperatura verificando los resultados descritos en la Figura 9.
IV. DISCUSIÓN
Las nanopartículas de magnetita fueron sintetizadas por coprecipitación química y recubiertas con quitosano obtenido a partir del exoesqueleto del camarón con un %DD = 84.20%, mayor al 75% siendo adecuado como agente de recubrimiento. En medio ácido, los grupos amino del quitosano son capaces de interactuar con las cargas negativas del grupo hidroxilo de la superficie de las NPsFe3O4 y el TPP es un anión polivalente con tres grupos de carga negativa, que pueden interactuar con las moléculas de quitosano y servir como agente entrecruzante (Figura 3) 26.
Gracias al recubrimiento de quitosano, las CS/NPsFe3O4 presentan mayor capacidad de adsorción de Cr (VI) utilizando pequeñas concentraciones de adsorbente (0,08 g a 0,1 g), en comparación con un estudio realizado por Rivera et al. (27), quien menciona que el mayor % de adsorción de Cr (VI) (70 %) con NPsFe3O4 sin recubrir se dio a concentración de 2 a 3 g de Nps; sin embargo, Noguera U., et al 28 sintetizó NPsFe3O4 soportadas en cascarillas de café obteniendo mayor capacidad de adsorción de Cr (VI) a concentraciones menores a 1 g de adsorbente; corroborando que la modificación de la superficie de las NPs proporciona más sitios activos para una eficiente interacción con el analito y mayor relación superficie/volumen del adsorbente.
Muchos estudios demuestran que el mayor % adsorción de Cr (VI) se obtiene a pH de 2 a 4, tal como menciona Omidinasab et al. 25; información que se ha verificado en esta investigación, donde se obtuvo un mayor % adsorción a pH 3 (Figura 6). El agente adsorbente a pH ácido puede interactuar electrostáticamente con las cargas negativas del contaminante, de manera que se pueden encontrar varias formas estables de especies de Cr (VI) en soluciones acuosas (CrO42-, HCr2O4-, HCrO4- y Cr2O7-2). El cromato ácido (HCrO4-) es la especie dominante a valores de pH menores a 6, al aumentar el pH la especie cambia a CrO4-2 limitando la adsorción debido a la competencia de los iones hidróxido existentes con relación al menor potencial zeta del adsorbente 29. También, a valores de pH inferiores a 1, el Cr (VI) se reduce a Cr (III) por el consumo de H⁺. Por lo tanto, el efecto del pH sobre las interacciones electrostáticas entre CS/NPsFe3O4 y el Cr (VI) para el ion HCrO4- se evaluó a un rango de pH de 2 a 7 y el porcentaje de adsorción incrementó cuando el valor del pH fue de 2 a 3.
El fenómeno de superficie que involucra el proceso de adsorción de Cr (VI) con CS/NPsFe3O4 es favorable para la linealidad de Langmuir (Figura 10), de manera que únicamente se forma una sola capa en la superficie de las NPs en cada tiempo y temperatura estudiada. A partir de la isoterma de Langmuir se determinó la qmax de Cr (VI) la cual fue mayor para las CS/NPsFe3O4, como se observa en la Tabla 2, en comparación a las NPsFe3O4 sin recubrimiento. También, la qmax para CS/NPsFe3O4 fue mayor, a la vez que aumentó la temperatura a 60 °C (qmax =275,48 mg/g). Temperatura en la cual existe mayor interacción entre el adsorbato y el adsorbente, tal como demuestra la constante de separación KL de 4.86 L/mg (Tabla 2).
Por otro lado, el proceso de adsorción de Cr (VI) con CS@NPsFe3O4, sigue un modelo de pseudo segundo orden, de manera que el paso que limita o determina la velocidad es la adsorción superficial y la remoción de Cr (VI) se debe a las interacciones fisicoquímicas con el adsorbente 27. Estos resultados concuerdan con los descritos por Castro et al. 30 y Dima 31, quienes señalan que el proceso de adsorción de Cr (VI) sigue el mecanismo de pseudo segundo orden.
V. CONCLUSIONES
Se sintetizaron nanopartículas de magnetita por coprecipitación química y recubiertas con quitosano obtenido del exoesqueleto del camarón de manera In-situ. Las CS/NPsFe3O4 fueron de apariencia esférica y morfología irregular característica, con un diámetro promedio igual a 31.85 nm con excelentes propiedades superparamagnéticas. El mayor porcentaje de adsorción fue del 99.70 % a valores de pH 3, 0.1 g de concentración del adsorbente, 5 mg/L de contaminante, 60 minutos de tiempo de contacto y 60 °C de temperatura. El proceso de adsorción siguió un modelo cinético de pseudo segundo orden y la isoterma que mejor se ajustó a los datos experimentales fue de Langmuir, a partir de la misma se obtuvo una qmax de Cr (VI) con NPs de 294,12 mg/g a 60 °C.
Por lo tanto, el recubrimiento de quitosano, además de proteger a las NPs y brindar estabilidad, también mejoró las propiedades adsorbentes de las mismas, y el porcentaje de adsorción fue mayor utilizando pequeñas cantidades de adsorbente