INTRODUCCIÓN
El almidón, un carbohidrato complejo presente en vegetales, es importante porque proporciona energía para los procesos vitales y es de fácil absorción. Su digestión inicia en el tubo digestivo y finaliza en la pared del intestino delgado, donde enzimas específicas rompen los disacáridos para separarlos en unidades elementales, que pueden entrar en las células y pasar a la sangre 1. Una de estas enzimas es la α-amilasa, encargada de “romper” el almidón en glucosa 2. Algunos alimentos ricos en almidón no presentan un índice glucémico tan elevado como cabría esperar, y ello es debido a que aquél no es digerido por las enzimas intestinales, por lo que recibe el nombre de almidón resistente 3,4. Posteriormente, es convertido en ácidos grasos de cadena media por parte de la flora intestinal 5.
El consumo excesivo de alimentos almidonados provoca enfermedades de tipo cardiovascular, denominadas enfermedades crónicas no transmisibles, que según la Organización Mundial de la Salud “OMS” 6, son consideradas una epidemia por ocasionar varias muertes en todo el mundo. Se reporta que cada año mueren 2,8 millones de personas a causa de obesidad 7, según un estudio realizado en 2015, fallecieron 1,6 millones de personas como consecuencia directa de la diabetes 8. En Ecuador, el INEC 9, revela que 6 de cada 10 ecuatorianos tienen sobrepeso y según la Organización Panamericana de Salud “OPS” 10, 1 de cada 10 ecuatorianos tienen diabetes, esto es debido al excesivo consumo de alimentos altos en grasa, sal y carbohidratos.
Según Castro 11, los inhibidores enzimáticos son moléculas proteicas que reducen la velocidad de la catálisis, muchos alimentos contienen sustancias inhibidoras de enzimas. Luengo, et al 12, manifiestan que en las legumbres se identifican inhibidores de las α-amilasas, que evitan la digestión del almidón normal, que se comporta como si fuera resistente. Desde 1945, los inhibidores de amilasa comenzaron a mencionarse en la literatura científica, un estudio de revisión informa que la Faseolamina, una proteína presente en los frijoles blancos es un potente inhibidor de la amilasa salival, siendo comercializado en forma de suplemento, para el tratamiento adyuvante de la diabetes 13. Nanok y Sansenya 14, sostienen que la enzima α-glucosidasa hace que la glucosa esté disponible en el cuerpo al descomponerla en oligo y disacáridos, convirtiéndolos en monosacáridos absorbibles, por lo tanto, para poder reducir los niveles de glucosa sérica y controlar las enfermedades relacionadas, se ha propuesto la inhibición de la α-glucosidasa como un enfoque adecuado. En este contexto, la Faseolamina es una proteína proveniente de la planta Phaseolus vulgaris (fréjol) (Figura 1), la función principal es provocar la mal absorción del almidón consumido, exenta de efectos secundarios 15.
Creemos que la Faseolamina se une a la α-amilasa y la neutraliza, cuando la Faseolamina bloquea la absorción de carbohidratos hace que las células no encuentren el sustrato (glucosa) para generar ATP, de modo que, son obligadas a recurrir al almacén de grasas para fabricar dicho combustible, de esta manera al acceder al almacén de grasas supone una reducción del tejido adiposo y, como consecuencia, una disminución del volumen y del peso corporal de la persona 16,17. Pereira 18 y Lamby 19 en sus publicaciones mencionan que la α-amilasa es una endoamilasa que hidroliza el almidón en las regiones internas hasta formar azúcares simples como maltosa, malotriosa y glucosa, dicha enzima actúa sobre las uniones glucosídicas alfa-1,4.
En base a lo anteriormente expuesto, el objetivo de este trabajo de revisión bibliográfica es auscultar y presentar el estado del arte de la Faseolamina y las investigaciones contemporáneas realizadas alrededor de ella.
MATERIALES Y MÉTODOS
Criterios de búsqueda y selección
1980 en adelante, por tratarse de un tema que tiene datos desde esa época, pero se dio mayor énfasis a literatura actual hasta el año 2022, en idioma español, portugués e inglés y evitando consultar literatura gris. De tal forma que la información fue obtenida desde un centenar de artículos científicos de libre acceso y tesis de grado y post grado de repositorios universitarios, cuyo contenido fue seleccionado tanto por su relación con el tema central como por la actualidad de la publicación.
Método para sistematizar la información
Para cumplir con el objetivo de esta revisión y brindar un fácil entendimiento a los lectores, la información recopilada se organizó considerando los tres ejes de investigación: métodos de extracción de la Faseolamina, condiciones óptimas de inhibición y la estructura de la molécula, se realizó la comparación crítica entre los criterios y resultados de los distintos autores consultados, citando semejanzas y diferencias detectadas en la escala del tiempo, los resultados se resumen y presentan en tablas comparativas para una mejor visualización y comprensión.
RESULTADOS Y DISCUSIÓN
Extracción y purificación de Faseolamina.
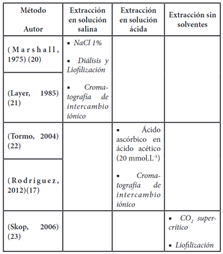
La Tabla 1, presenta la información de los métodos de extracción utilizados por diferentes autores, el primero se refiere al uso de solución salina utilizada en las primeras investigaciones realizadas con Faseolamina, en donde se buscaba comprobar su poder antiamilásico, con este método los autores mencionan que se obtiene aproximadamente del 60 al 70 % de pureza del inhibidor y se logra una inhibición promedio de 97% con NaCl al 1%. Gracias a la última diálisis con tampón de citrato/fosfato, pH 8,0 se obtiene una mayor concentración de proteínas, aproximadamente del 9 a 11%, y un rendimiento de 3,82 g de inhibidor por 500 g de fréjol molido; ambos autores realizaron la purificación mediante cromatografía de intercambio iónico posterior a la extracción; finalmente concuerdan en que el polvo de fréjol crudo contiene cantidades similares de Fito-hemaglutininas, y que el citado procedimiento de purificación parcial elimina en parte la actividad aglutinante que se podría ocasionar en la sangre 20,21.
En el segundo método, correspondiente a la extracción en solución ácida, evidenciamos que el proceso inicia con una acidificación con ácido ascórbico en ácido acético (20 mmol.L-1), además hacen mayor énfasis en los reposos a temperaturas frías y se centran en ajustar el pH con el fin de generar mayor estabilidad del inhibidor. En la evaluación in vivo los dos mencionan que el inhibidor interviene en la pérdida del apetito y el aumento del consumo de agua, además de la disminución de la actividad del páncreas. Aseguran que con este método se obtiene un rendimiento de aproximadamente 1,5 - 2,4 g de inhibidor.kg-1 de harina de fréjol, además de generar el 84,25% de inhibición en promedio, ambos autores realizaron la purificación mediante cromatografía de intercambio iónico, y aseguran que se obtiene una elevada concentración de Faseolamina debido al juego de pH ácidos que manejan (pH 5), finalmente mencionan que la actividad de hemaglutinación no mostró ninguna evidencia de contaminación de Faseolamina con la lectina del fréjol 17,22.
Finalmente, el autor del último método asegura que no se necesita soluciones ácidas ni básicas para realizar la extracción, menciona que las distintas soluciones que se usan en los métodos convencionales son causantes de generar toxicidad al momento del consumo, además de formar parte de las impurezas que no pueden ser eliminadas del producto final. Su método consiste en la extracción bajo presión de vacío a 63ºC con dióxido de carbono supercrítico, lo cual también elimina completamente las impurezas y logra alta estabilidad a temperaturas elevadas y valores de pH extremos como los del estómago humano. Estas características resultan interesantes debido a que dicha estabilidad térmica permite que el inhibidor de α-amilasa se pueda implementar en productos alimenticios con procesos de calor, sin perder el potencial bloqueador sobre el desdoblamiento del almidón, además se evita el efecto negativo dado por las impurezas sobre el sabor en la Faseolamina obtenida. Este método genera un rendimiento de aproximadamente 120 g de Faseolamina purificada por 1000 g de fréjol 23.
Recientemente, Ashu, et al 24 desarrollaron un método simple usando agar para estimar la actividad del inhibidor de la α-amilasa, mediante el tamizaje cualitativo del frijol común (Phaseolus vulgaris L.) y verificado mediante la cuantificación del azúcar reductor (equivalente de maltosa), este método del agar implica utilizar productos químicos más baratos sin requerir equipos sofisticados para procesar un gran número de muestras que contengan un inhibidor de α- amilasa como factor antidiabético.
Así mismo, Yifeng, et al 25, reportan un proceso novedoso y escalable basado en hidrólisis enzimáticapara la preparación del inhibidor de α-amilasa (α-AI) en semillas de frijol blanco (Phaseolus vulgaris), para la hidrólisis enzimática se usó Flavourzyme 500MG, obteniendo el hidrolizado final a los 180 minutos, seguido de la precipitación isoeléctrica a pH 3,6. Así, la pérdida de proteínas misceláneas y el pliegue de purificación fueron relativamente bajos (85,84 y 4,74%, respectivamente), mientras que el rendimiento de la actividad de α-AI (67,12%) fue muy superior a los valores obtenidos por cromatografía.
b. Características óptimas de inhibición enzimática.
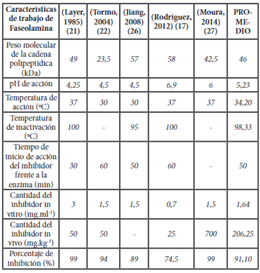
La Tabla 2 muestra el valor promedio de varios indicadores específicos para el trabajo con Faseolamina como inhibidor de alfa amilasa según varios autores, es importante observar la correspondencia de ciertos datos que no han variado significativamente a lo largo del tiempo, es decir son reproducibles y pueden ser utilizados en trabajos experimentales con Faseolamina. En cuanto al perfil de la cadena polipeptídica que forma la proteína, la mayor cantidad se encuentra dentro del eje embrionario del grano de fréjol, corresponde a una globulina y se encuentra dentro del 9 al 11% de la proteína total y 46 kDa de peso molecular 17,28. En cuanto al pH promedio de acción, establecido por varios autores (Tabla 2), tenemos un valor de 5,23, determinado en experimentación simulando condiciones muy parecidas a las del tracto gastrointestinal, con un rango de actividad entre 4,5 y 5,5 para obtener una inhibición aproximadamente del 89% (26), datos semejantes obtuvieron en la experimentación Rodríguez 17 y Marshall 20, este parámetro influye de manera significativa en la estabilidad del inhibidor.
Con respecto a la temperatura de acción, los datos no se alejan mucho en comparación con investigaciones citadas anteriormente, oscila en un rango de 30 a 37ºC, con un promedio de 34,20ºC, temperatura óptima en la que actúa de manera efectiva. El factor temperatura es uno de los parámetros que más se ha investigado, al utilizar α-amilasa pancreática porcina se identificó su acción es efectiva a partir de 30ºC y se inactiva rápidamente cuando sobrepasa los 90ºC 17,21,22,24, la temperatura promedio de inactivación es de 98,33ºC. Este dato resulta de interés ya que puede influir directamente en el almacenamiento de la molécula y también en procesos en donde se la usa como ingrediente en la elaboración de algún producto alimenticio.
El tiempo de inicio de la inhibición enzimática ha sido de vital importancia en estudios in vitro 27, gracias a ello, al momento de realizar experimentación in vivo se suministra en primera instancia el inhibidor previamente purificado y diluido en soluciones de NaCl (pH 9), con anterioridad de modo que la inhibición llegue a su máximo potencial, el valor promedio es de 50 minutos para alcanzar el máximo porcentaje de inhibición 17,21,26. El factor tiempo es indispensable conocer para personas que usan medicamentos concentrados de Faseolámina para tratar Diabetes y obesidad. La concentración de inhibidor a utilizar es 1,64 mg.ml-1, observándose que a mayor concentración se genera una sobre saturación de la enzima, causando un desperdicio del inhibidor 27. En la Tabla 2, Layer 21, reporta un valor elevado de 3 mg.ml-1, puesto que en su investigación utilizó Faseolámina con poca pureza debido al proceso de extracción. Frente a lo mencionado anteriormente, otros autores sugieren que el rango óptimo oscila entre 0,8 y 1,5 mg.ml-1 para estudios in vitro 17,22,26.
Los estudios In vivo muestran efectividad del inhibidor mediante la determinación de glucosa en sangre, almidón en heces fecales, peso de las unidades experimentales, entre otras. El valor promedio para suministro de Faseolámina In vivo es de 206,25 mg.kg-1 de peso vivo, valor que resulta muy diferente y por encima de resultados previos que reportaban un rango de 25 a 50 mg.kg-1 de peso vivo 17,20,22, este promedio está siendo afectado por un valor atípico muy alto reportado por Moura (27), de 700 mg.kg-1, quien en su investigación utiliza comprimidos de Faseolámina comercial, aparentemente sin una buena concentración de la molécula y no un extracto purificado de Phaseolus vulgaris, por lo que para alcanzar un alto porcentaje de inhibición debe incrementar la cantidad del comprimido, a pesar de esto, se demuestra la eficacia del inhibidor.
El porcentaje de inhibición promedio de Faseolámina sobre α-amilasa obtenido con el análisis de datos de la Tabla 2, es de 91.10 %, lo cual resulta interesante para proyectar su uso alimentario y farmacéutico, este valor al parecer está directamente relacionado con el grado de pureza obtenido en la extracción. Marshall 20 menciona que con un adecuado proceso de purificación se logra obtener aproximadamente un 60 a 70% de pureza; además de eliminar la toxicidad debido a la presencia de fito- hemaglutinina (lectina que aglutina la sangre) (17.
Es conocido que el primer paso para la digestión de los polisacáridos es la escisión del almidón en sus componentes mediado por las α-amilasas 29. Esta digestión comienza en la boca con α-amilasa salival 30, convirtiéndolo en oligómeros cortos 31, que se detienen en el estómago por su bajo pH, al pasar al intestino delgado, se neutraliza y la α-amilasa ahí secretada por el páncreas completa la digestión del almidón 30. Actualmente se investiga la inhibición de esta enzima durante el citado proceso con el objetivo de obtener fármacos para reducir la hiperglucemia posprandial, lo que representaría un posible tratamiento para la diabetes y la obesidad 32,33, con una disminución de absorción de glucosa en el intestino 34. Se han realizado varios estudios para evaluar la inhibición de la alfa- amilasa en presencia de inhibidores sintéticos y vegetales de importancia biotecnológica para la agricultura, la medicina y la industria alimentaria y farmacéutica 30,32,33,35,36,37,38,39,40.
Por otro lado, resulta interesante estudiar la inhibición de la alfa-amilasa para el control de las caries dentales, puesto que Streptococcus viridans, una bacteria bucal, se alimenta hidrolizando el almidón con alfa-amilasa, la maltosa resultante termina produciendo ácido láctico gracias a la fermentación de otras bacterias de la boca, éste podría disolver el esmalte dental, ayudando a la formación de placa y dando origen a las caries 37. El estudio de inhibidores también es importante en la agricultura, mediante la obtención de plantas transgénicas resistentes al ataque de plagas, puesto que los insectos se alimentan de almidón 30, aunque estas plantas transgénicas con genes inhibidores de la α-amilasa demuestran tener poco efecto sobre la digestión en los mamíferos 41.
La investigación sobre inhibidores de alfa-amilasa, así como extractos de plantas con potencial hipoglucemiante in vitro y en modelos animales se ha incrementado 32,33,35,37,39,40,42. Se intenta demostrar el potencial de plantas popularmente consideradas como antidiabéticas para obtener la aprobación científica y sistemática para su uso como hipoglucemiantes 32,33,43. Grover et al 44, indican que más de 1123 especies de plantas han sido evaluadas de forma etnofarmacológica o experimental para tratar la diabetes y, se han identificado más de 200 compuestos de plantas que reducen glucosa en sangre 45. En países en desarrollo, donde las personas tienen acceso limitado a medicamentos y tratamientos modernos para la diabetes, las plantas juegan un rol de gran importancia 32. En general, las plantas contienen un gran número de inhibidores frente a amilasas y proteinasas, están presentes en semillas y otros órganos, y son responsables de la resistencia contra el ataque por insectos 34. Estos inhibidores presentes en las plantas se clasifican en proteicos y no proteicos 46. Existen siete tipos de inhibidores de alfa-amilasa identificados por similitudes en la secuencia y la estructura tridimensional 47,48. De estos, seis se obtienen de plantas superiores (tipo lectina, tipo knottin, tipo cereal, tipo kunitz, tipo γ-puotionina y tipo taumatina) 49, y uno de Streptomyces sp50,51. Varias investigaciones sobre inhibidores de amilasa citan a compuestos obtenidos desde cereales 34,52,53,54, como el trigo (Triticum aestivum) 55, la cebada (Hordeum vulgareum) 56, el centeno (Secale cereale) 36, así como en legumbres como el frijol (Phaseolus vulgaris) 53.
A continuación, se citan varios trabajos realizados en relación a los inhibidores enzimáticos como la Faseolámina:
Obiro, et al 57 indica que algunos suplementos dietéticos utilizados para controlar la obesidad se basan en concentrados de proteína de frijol (Phaseolus vulgaris), por su contenido significativo de inhibidor de α-amilasa también conocido como faseolamina (α-AI), útil en la prevención de la hiperglucemia posprandial bloqueando el acceso al sitio activo de la enzima digestiva del almidón. Shah, et al 58, citan que las semillas de Cajanus cajan L. una planta de la familia Fabaceae, tratadas con agua buferada, alcanzan el 100% de inhibición sobre α-amilasa, y las flores de Hibiscus sabdariffa L. de la familia Malvaceae tratadas con methanol, lo hacen en un 50%. Jay, et al 59, citan que al realizar un metaanálisis sobre investigaciones que evaluaron el efecto de la suplementación con un inhibidor patentado (Phase2®) de α-amilasa extraído de Phaseolus vulgaris sobre la pérdida de peso en 573 sujetos (11 estudios) y reducción de la grasa corporal en 110 individuos (3 estudios), se obtuvo que esta suplementación mostró un efecto promedio de 1,08 kg de disminución del peso (0,42 kg a 1,16 kg) y un efecto promedio de 3,26 kg de reducción de grasa corporal (2,35 kg a 4,163 kg). Este metaanálisis encontró efectos estadísticamente significativos de la suplementación con Phaseolus vulgaris sobre el peso y la grasa corporales.
Bhawna, et al 60, mencionan que al analizar muestras de Cassia tora, Cassia occidentalis, Cassia floribunda y Crotalaria albida se encontró un inhibidor de α-amilasa, con un 94% de efectividad, siendo estable al calor (70°C), se purificó hasta la homogeneidad con 752,79 veces de purificación y 22,77% de recuperación, consiste en subunidades de menos de 200 KDa. Fatemeh, et al 61, indican que al evaluar in vitro la actividad inhibidora sobre α-amilasa pancreática, la estabilidad térmica y la hemaglutinación del extracto de cuatro variedades de Phaseolus vulgaris (Frijoles rojos, pintos, blancos y caupí) se encontró que todos los extractos de frijol mostraron actividad de inhibición, la cual fue mayor en las variedades blanco, rojo y pinto, en el estudio In vivo en ratas Wistar machos durante 21 días de suplementación, se evidenció disminución del nivel de glucosa en sangre al suplementar con extracto de frejol blanco, en comparación con el control, por lo que este extracto puede ser usado en la preparación farmacéutica de inhibidores de α-amilasa para controlar los niveles de glucemia. Guangqiu, et al 62, evaluaron la toxicidad de un extracto de frijol blanco (Phaseolus vulgaris) mediante una dosis repetida de 90 días en 80 ratas Sprague-Dawley, dosificadas con 4, 2 y 1 g/ kg de peso corporal al día, vía oral, los resultados mostraron que el extracto de frijol blanco en dosis de hasta 4 g/kg/día no indujo cambios significativos en el peso corporal, peso de los órganos, consumo de alimentos, hematología, constantes bioquímicas e histopatología en las ratas, en comparación con el control.
De Andrade, et al63, al estudiar el contenido y actividad de los compuestos bioactivos fenólicos responsables de la actividad anti hiperglucémica de 5 genotipos de frijol común (Phaseolus vulgaris), demostraron que estos dependen del genotipo de la planta, y deben investigarse los genotipos más promisorios para encontrar estrategias de intervención dietética saludable y terapéutica.
Micheli, et al64, estudiaron los efectos de la isoforma 1 del inhibidor de la α-amilasa llamada Faseolamina, contra el síndrome metabólico en ratones, en los cuales se obtuvo la reducción del peso corporal, la glucemia, los triglicéridos y el colesterol, llegando a normalizar este síndrome, las deficiencias motoras que produce y las alteraciones del umbral nociceptivo, el análisis de órganos específicos reveló que el extracto de Phaseolus vulgaris disminuyó la esteatosis hepática y peroxidación lipídica en el hígado, protegió al corazón de las alteraciones oxidativas del síndrome, aumentando la expresión de las enzimas desintoxicantes catalasa y glutatión reductasa, así como la normalización del nivel de NADH deshidrogenasa, el análisis histológico de la aorta mostró una protección sobre el desarrollo de vetas grasas en las capas musculares, resultados que postulan a este producto vegetal como una posible opción terapéutica contra el síndrome metabólico. Wai, et al 65, reportan que al estudiar cuatro métodos de procesamiento de alimentos (remojo, calentamiento húmedo, esterilización en autoclave y congelación) para evaluar su eficacia en la eliminación de los inhibidores enzimáticos (tripsina, quimotripsina y α-amilasa) presentes en siete leguminosas, se determinó que al esterilizar en autoclave a 121°C durante 15 minutos redujo el inhibidor de la α-amilasa en todas las leguminosas analizadas, por otro lado el calentamiento húmedo a 50° C durante 60 minutos inactivó con éxito tanto la α-amilasa como la quimotripsina del maní, mientras la congelación a -80°C durante 24 h inactivó la quimotripsina.
Castillo, et al66, reportan que los extractos de frijol tienen una potente capacidad lipolítica tanto in vitro como ex vivo, con un efecto antiadipogénico durante la diferenciación de 3T3-preadipocitos L1, así, el frijol podría utilizarse en el desarrollo de ingredientes funcionales para reducir las altas tasas de muerte por enfermedades cardiovasculares asociadas con la obesidad. Shiqi, et al67, reportan que el producto denominado RCM-107, una fórmula de ocho hierbas chinas que incluye: Camellia sinensis (green tea), Poria, Nelumbinis folium (lotus leaf), Alismatis rhizoma, Plantaginis semen, Cassiae semen, Sophorae flos y Gardeniae fructus, que es una modificación de RCM-104, produjo la pérdida de peso en ensayos clínicos, por sus efectos inhibitorios sobre α-amilasa, al poseer biocomponentes activos como: alisol B, (-)-epigalocatequina-3-galato (EGCG) y el plantagósido, que interactúan con los marcadores Glu233, Gln63, His305, Asp300 y Tyr151 de α-amilasa. Ziaul, et al 68, estudiaron tres plantas silvestres de Blangadesh: Achyranthes aspera L., Eclipta alba L. (Kalokeshi), y Vitex negundo L., determinando que éstas son ricas en fibra, proteína, minerales, antioxidantes e inhibidores de alfa amilasa, por lo que su mayor ingesta podría proporcionar beneficios para la salud. Uci, et al 69, reportan que Phaseolus vulgaris L., posee varios componentes bioactivos asociados con beneficios para la salud, como alcaloides, antocianinas, carbohidratos, catequinas, fibra, flavonoides, ácido fítico, quercetina, saponinas, esteroides, taninos, terpenoides e inhibidores de tripsina, por ello actúa como analgésico, antiinflamatorio, antibacteriano, diurético, antioxidante, hipocolesterolémico, antiobesidad y antidiabético.
Like, et al70, al diseñar y evaluar microesferas a base de carbohidratos (maltodextrina) para tener diferentes tasas de digestión desde rápidas hasta lentas, observaron que estas podrían modular el vaciamiento gástrico a través del freno ileal, según un estudio efectuado en ratas, en este tipo de productos podría ser posible el uso de la Faseolamina que al inhibir la acción de alfa amilasa podría generar una digestión lenta y una menor disposición de azúcares para el organismo con efecto sobre las respuestas glucémicas e insulinémicas. Kim, et al71, evaluaron los efectos de una mezcla de extractos de Phaseolus multiflorus y Pleurotus eryngii, sobre la inhibición de la digestión enzimática con efecto anti obesidad en ratones y citan una reducción del peso corporal, la masa grasa, el hígado, el nivel de triglicéridos y azúcares. Luzardo, et al72, indica que una dieta combinada de frijoles y maíz, propia de América Latina, proporciona compuestos bioactivos con efectos hipolipidémicos y reductores de glucosa, ya que se ha demostrado su capacidad para mitigar la obesidad y la diabetes tipo II. Hussein, et al73, sostiene que el rábano (Raphanus raphanistrum) puede ser usado como producto terapéutico en pacientes con diabetes tipo II, puesto que gracias a sus componentes fenólicos inhibe un 95,5 % la acción de la enzima α-amilasa, reduciendo el nivel de glucosa en la sangre posprandial. Khadayat, et al74, reportaron que la evaluación in vitro e in vivo reveló que algunas plantas medicinales de Nepal como Acacia catechu y Swertia chirata, son una potente fuente de inhibición de α-amilasa, ya que produjeron una reducción significativa de la concentración de glucosa en sangre hasta 30 min después de la dosis oral de 250 mg/kg y podrían utilizarse en el desarrollo de fármacos para tratar la diabetes sin efectos secundarios adversos. Sultana, et al75, reportan que el extracto de espinaca india, una planta popular de Bangladesh, alcanza el 100% de inhibición de α-amilasa in vitro, ya que contiene glucósidos polifenólicos, cuyo efecto supera al fármaco comercial Orlistat y se proyecta su uso para controlar la hiperglucemia, hiperlipidemia e hipertensión.
Wang, et al76, manifiestan que el consumo de 2400 mg.día-1 antes de cada comida, durante 35 días del extracto de Phaseolus vulgaris en voluntarios obesos Chinos, produjo una pérdida de peso promedio de 2,24 kg, disminuyó el índice de masa corporal en 0,79 y la grasa corporal decreció en 1,53%, con disminución del espesor de la grasa subcutánea, la circunferencia de la cintura y cadera, en ese periodo, con diferencias significativas con el tratamiento control, sin observarse efectos secundarios adversos. Serna, et al. 77, evaluó el efecto inhibitorio de fibra dietética rica en fenoles (ácidos clorogénico y elágico) de mezclas de harinas de maíz y frijol común, sobre enzimas involucradas en el metabolismo de glucosa/lípidos in vitro, encontrando un 20% de inhibición para α-glucosidasa y un 25 % para la lipasa pancreática, por lo que se podría considerar un alimento funcional contra la obesidad y la diabetes tipo II. Marikkar, et al 78, determinaron que el mayor efecto inhibidor (39,57%) contra α-glucosidasa lo exhibió un extracto de frijol rojo y el mayor efecto inhibitorio contra la α-amilasa (96,18%) fue mostrado por un extracto de salvado de arroz, ambos obtenidos mediante extracción química con una solución etanol-agua del 80%, considerando a estos productos como buenos reguladores de la hiperglucemia posprandial. Abdulrahman, et al79, concluyeron que diferentes extractos de Phaseolus vulgaris demostraron actividades antidiabéticas in vitro bajas, pero muy prometedoras, sin embargo, el extracto de etanol mostró una actividad más alta que los otros, sugiriendo al fréjol como alimento funcional, así como nutracéutico en términos de control de la diabetes tipo 2. Singh, et al80, manifiestan que al evaluar 15 cultivares de frejol (Phaseolus vulgaris) como inhibidor de alfa- amilasa, encontraron variaciones significativas entre ellos, resaltando la máxima actividad inhibidora (70,2 ± 0,84) con el cultivar Purola, el cual actúa a temperaturas de 20 a 100ºC, formado por dos subunidades de 17 kd y 14 kd, con un peso molecular total purificado en PAGE nativo (electroforesis en gel de poliacrilamida) de 31 kDa. Shi, et al81, indican que el extracto de frijol blanco común, rico en polifenoles, produce efectos inhibitorios sobre la diferenciación de adipocitos 3T3-L1, reduciendo su contenido lipídico en un 79,29% y en un 90,20% en adipocitos maduros, también se evidenció que por efecto del extracto polifenólico del fréjol, se suprimió el nivel de expresión de ARNm y de la proteína del receptor activado por el proliferador de peroxisomas γ(PPAR γ), potenciador de CCAAT, α(C/EBPα), elementos reguladores de esteroles 1c(SREBP-1c), lipoproteína lipasa (LPL) y proteína fijadora de ácidos grasos (ap2).
Sparvoli, et al82, reportan que Phaseolus vulgaris L., son una fuente importante de nutrientes para humanos, sin embargo, contienen lectinas, que limitan el uso directo de su harina en alimentos preparados sin tratamiento térmico, y ácido fítico, que reduce la biodisponibilidad de cationes minerales, por ello al proponer la obtención de snacks biofortificados y una crema utilizando harina de frijol desprovista de lectinas activas y con contenido reducido de ácido fítico se obtuvo que estos nuevos productos no retuvieron actividad hemaglutinante residual debido a las lectinas; mostraron una actividad inhibidora de -amilasa residual más alta (de 2,2 a 135 veces), calculándose in vitro una reducción del índice glucémico en aproximadamente 5 unidades y mayor biodisponibilidad de hierro en comparación con los productos con harina original; así como una mejor apreciación organoléptica, lo cual determina ventajas en la preparación de alimentos seguros y nutritivos para el consumidor. Ezzat, et al83, indican que el extracto de vainas de Phaseolus vulgaris en ratas experimentalmente diabéticas, disminuyó la glucosa en sangre entre el 57 y 65 %, por otro lado, la fracción no-polar de este extracto estimula el asentamiento de células madre en el páncreas potencializando su actividad antidiabética, habiéndose identificado 26 compuestos de los cuales 4 fueron aislados en forma pura: acetato de calotroprocerilo, fridelina, calotroprocerilo A y el estigmasterol, los cuales demostraron buena actividad inhibitoria sobre lipasa y alfa amilasa pancreáticas, por lo que puede considerarse como un nutriente saludable y podría ser utilizado en terapias futuras con células madre para el tratamiento de diabetes tipo 1.
Un estudio brasileño reporta que son 29 los fitoterapéuticos más requeridos y dispensados a nivel de fito farmacia en el Municipio de Sousa, Paraíba, en los que destaca la faseolamina a partir de Phaseolus vulgaris en forma de cápsulas y saches, solicitado como producto para bajar de peso 84. Otro estudio cita que los medicamentos a base de hierbas para adelgazar más dispensados en las farmacias de compuestos botánicos de la ciudad de Ipatinga, estado de Minas Gerais, Brasil, son: té verde (Carmellia sinensis), baya de Goji, Garcinia cambogia, faseolamina e hibisco (Hibiscus sabdariffa L). Así la Faseolamina, está indicada para generar pérdida de peso por su efecto hipoglucemiante, pero la ingesta prolongada puede provocar cambios en la actividad pancreática, lo que aumenta el riesgo de desarrollar cáncer de páncreas 85. El consumo de esta glicoproteína en presentaciones comerciales disminuye el 33% de la glucosa en sangre tras las comidas, los ensayos In vitro mostraron una inhibición de hasta el 99% de α-amilasa, sin haberse detectado casos de intoxicación por su consumo en ratas alimentadas durante 43 días con dosis de 442 U del inhibidor 86. La dosis evaluada de 1g/70 Kg de peso vivo/día de Faseolamina comercial o harina de frejol blanco no afectó el crecimiento ni causó efectos deletéreos en ratones, con una actividad inhibitoria in vitro sobre alfa amilasa de 6,02 UIA/mg MS 87. Por otro lado, se ha observado que el tratamiento térmico de los fréjoles reduce la concentración de Faseolamina 88. Brasil a través de la Agencia Nacional de Vigilancia Sanitaria, prohibió mediante Resolución RE No.1992 del 3 de mayo de 2010, la publicidad en todos los medios de productos naturales sin registro que estén expendidos para bajar de peso en cualquier presentación, entre ellas la Faseolamina y otras 89. En la Figura 2, se aprecia un ejemplo de presentación comercial de Faseolamina para consumo humano.
Estructura química de la Faseolamina
Las alfa-amilasas son endoglucanasas, que se encuentran en la naturaleza formando parte de bacterias, archaeas y eukaryotas, su función es la hidrólisis y transglicosilación de polisacáridos 90,91, de tal forma que trabajan en el metabolismo de carbohidratos tanto en microorganismos, como en plantas y animales 47. Henrissat 92, señala que, según su estructura primaria, se clasificaron dentro de la familia 13 de las glicosil hidrolasas.
Le Berre-Anton 93, manifiesta que el investigador Marshall en 1975, purificó la faseolamina a partir Phaseolus vulgaris (frijoles blancos), identificándolo como un inhibidor de la alfa-amilasa. Posteriormente se determinó que esta molécula era una glicoproteína tetramérica formada por dos subunidades alfa de 10,8 kDa, dos subunidades beta de 15 kDa con un efecto inhibitorio óptimo a un pH de 5,5 y una temperatura de 37ºC. En efecto, la faseolamina inhibe las alfa-amilasas animales, pero no actúa contra las amilasas vegetales, bacterianas y fúngicas 20. Además, Santimone et al. 53, sostienen que Phaseolus vulgaris contiene otras proteínas de defensa que incluyen: fitohemaglutininas (PHA), arcelinas e inhibidores de alfa-amilasa (α-AI), esta última con tres isoformas distintas: α-AI1, α-AI2 y α-AI3.
La Faseolamina es una glicoproteína de almacenamiento que corresponde aproximadamente al 80% del total de las proteínas de la semilla, contiene aproximadamente 8,6% de carbohidratos no definidos que probablemente se unen de manera covalente mediante enlace amida a la asparagina, es rico en ácido aspártico, ácido glutámico, serina, treonina y valina, escaso en cisteína y no contiene prolina 94. Se presume que en su estructura están presentes los tres compuestos de lectinas del fréjol común Fito- hemaglutininas (PHA), Arcelinas y α-AI (α-AI1, α-AI2, α-AIL) las 3 se asemejan en la secuencia de aminoácidos aproximadamente de 50-90% (Figura 3). Jiang 26, afirma que corresponde a una estructura típica de tetrámeros de lectina (α2 - β2), las cadenas α y β se forman a través de un procesamiento proteolítico en las vacuolas de almacenamiento de proteínas por medio del cual se genera la forma activa del inhibidor a partir del precursor. Este planteamiento tiene similitud con lo que menciona Gamero 95 en sus resultados, la forma activa del inhibidor está compuesta por dos subunidades, con residuos de alanina y serina en el extremo N-terminal. Estas subunidades se forman a partir de precursores proteicos, que son degradados por proteasas, lo que permite la unión entre las moléculas precursoras maduradas, formando la proteína inhibidora, sin embargo, el mecanismo mediante el cual se forman los inhibidores debe ser investigado con mayor profundidad ya que no existe información específica sobre la estructura química como tal del inhibidor. Sin embargo, la efectividad de la molécula se ve reflejada claramente en los resultados de investigaciones previas donde se ha demostrado eficazmente que la proteína presenta una alta actividad de inhibición frente a la α-amilasa intraluminal y duodenal, de modo que resulta interesante el pensar en implementarla en futuros productos alimenticios para generar un impacto positivo en la industria de alimentos, pensando en ayudar a mantener niveles de glucosa controlados principalmente en personas que sufren enfermedades de sobre peso y Diabetes. En la Figura 3 se aprecia la estructura propuesta para la α-amilasa pancreática humana.
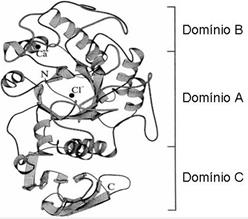
Según Brayer et al 97
Figura 3 Esquema de la cadena polipeptídica de alfa-amilasa pancreática humana con sus tres dominios estructurales (A, B y C), sitios de unión del cloro y el calcio y los extremos N y C de la cadena
CONCLUSIONES
En cumplimiento de los objetivos de esta revisión bibliográfica y en base a los datos encontrados y analizados, se concluye que:
La Faseolamina desde el punto de vista químico es una glicoproteína tetramérica extraída del grano de fréjol (Phaseolus vulgaris), que ha sido estudiada desde 1975, cuyo peso molecular está alrededor de los 46 KDa, corresponde al 80% del total de proteínas del grano, contiene un 8,6 % de carbohidratos asociados, rica en ácido aspártico, ácido glutámico, serina, treonina y valina, escasa en cisteína y no contiene prolina, se presume que en su estructura están presentes los tres compuestos de lectinas del fréjol común: Fito-hemaglutininas (PHA), Arcelinas y α-AI (α- AI1, α-AI2, α-AIL), sin embargo, el mecanismo mediante el cual se forman estos tres inhibidores debe ser investigado con mayor profundidad ya que no existe información específica sobre la estructura química como tal del inhibidor.
Al parecer el mejor método de extracción de Faseolamina es aquel realizado bajo presión de vacío a 63ºC con dióxido de carbono supercrítico, éste garantiza alta pureza y estabilidad de la molécula a altas temperatura y pH bajo, lo cual es apropiado para proyectar su uso en la industria alimenticia y farmacéutica.
Un valor superior al 90% de inhibición de la alfa amilasa se logra cuando la Faseolamina es utilizada a un pH alrededor de 5, una temperatura de 34 °C, con una dosis de aproximadamente 1,6 mg.ml-1 in vitro y de 25 a 50 mg.Kg-1 in vivo, logrando su activación a partir de los 50 minutos post consumo y se inactiva usando temperaturas a partir de los 95 °C.
La efectividad inhibidora de esta molécula frente a la α-amilasa se ve reflejada claramente en los resultados de las investigaciones consultadas, demostrando una alta actividad de inhibición intraluminal y duodenal, de modo que resulta interesante el diseño de productos alimenticios y/o farmacéuticos para un mercado cautivo no atendido, no solamente de consumidores que padecen enfermedades de sobre peso y diabetes, sino de quienes buscar reducir su peso o simplemente mantenerse en forma sin dietas rigurosas.