I. INTRODUCCIÓN
Los vertidos líquidos derivados del sacrificio de ganado son una fuente importante de contaminación de las aguas superficiales de acuerdo a datos de la Organización Mundial de la Salud (OMS), lo que coincide con el reporte de la Organización de las Naciones Unidas (ONU) entre 1990 y 2010, que señala un aumento de materia biodegradable que afecta uno de cada siete kilómetros de los ríos en América Latina 1.
La materia orgánica presente en estas descargas, es utilizada por los microorganismos como fuente de nutrientes para la generación de energía, consumiendo oxígeno hasta alcanzar niveles de anaerobiosis 2. El incremento de la turbidez y la disminución de la cantidad de luz afectan a la vegetación y a especies acuáticas 3.
Existe una creciente problemática frente al tratamiento de aguas residuales y la posibilidad de reutilizarlas, por lo que se han planteado sistemas biológicos capaces de remover los contaminantes a costos reducidos 4. Las algas constituyen una alternativa eficiente de tratamiento al ser capaces de utilizar las aguas residuales como sustrato para su crecimiento 5. Estos organismos unicelulares fotosintéticos captan luz solar, CO2 y nutrientes del medio para producir biomasa que puede ser aprovechada por su alto contenido proteico 6, para la producción de biocombustibles 7,8,9, reducción de CO2 atmosférico 4, o para la producción de metabolitos secundarios para salud y cosméticos 10.
El camal municipal del cantón Shushufindi, Provincia de Sucumbíos - Ecuador, se encuentra situado junto al río Eno en el que se descarga el agua residual proveniente de sus actividades, un efluente con altas concentraciones de proteínas, grasas, aceites, sólidos suspendidos y residuos procedentes de esta industria, y por lo tanto rica en nitratos, nitritos, fosfatos, sulfatos y materia orgánica.
Este trabajo ha evaluado la capacidad de las algas Chlorophyta presentes en la laguna Limoncocha para depurar las aguas residuales del camal municipal del cantón Shushufindi, al ser organismos que presentan una alta capacidad para utilizar elementos como el nitrógeno y fósforo presentes en el agua 3, de fácil manejo y adaptación y crecimiento rápido.
II. MATERIALES Y MÉTODOS
Muestreo y cultivo de algas Chlorophyta
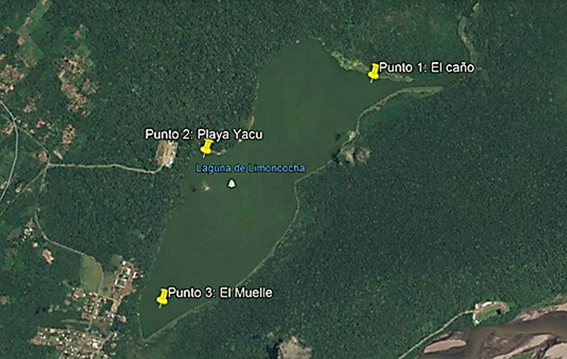
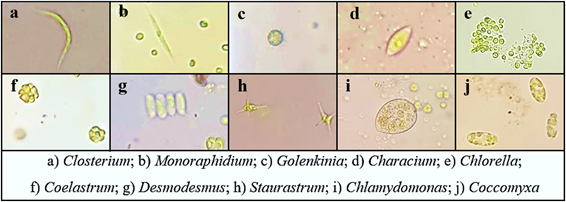
Las algas Chlorophyta fueron aisladas a partir de muestras superficiales de 300 mL del agua de la laguna Limoncocha tomadas en tres puntos: punto 1, El Caño; punto 2, desembocadura de Playa Yacu; punto 3, Muelle. La toma de muestras se realizó en base a la Norma Técnica Ecuatoriana NTE INEN 2176: muestreo de fitoplancton. Éstas fueron homogenizadas para formar una muestra compuesta y luego cultivadas en Nitrofoska foliar al 5% v/v durante 15 días, posteriormente se verificó la presencia de las algas mediante la prueba de Lugol 11.
El muestreo del agua residual procedente del camal municipal del cantón Shushufindi se realizó en base a la Norma Técnica Ecuatoriana NTE INEN 2176: muestreo de agua. Para la formulación de muestras compuestas de 5L, se tomó una muestra simple por cada hora de funcionamiento 7 en total, su volumen se determinó en relación al caudal medido por método de vertedero circular en el punto de descarga.
Pruebas de control de crecimiento y degradación de materia orgánica.
Las pruebas incluyeron seis distintos tratamientos de 1.8 L, con cinco repeticiones cada uno, en un fotobiorreactor tubular discontinuo con un fotoperiodo de 12 horas, lámparas led de 800 Lux, a una temperatura de 22.38°C y un pH de 8.45.
Para el control de crecimiento se utilizó Nitrofoska foliar al 5% como medio de cultivo 12, al que se adicionó el inóculo algal al 5% v/v 12,13; el tratamiento dos (T2) recibió aireación y el tratamiento uno (T1) se mantuvo sin aireación.
Las pruebas de reducción de materia orgánica incluyeron cuatro tratamientos que utilizaron el agua residual del camal en dilución de 1:3 1,3; dos unidades experimentales fueron inoculadas con algas Chlorophyta al 5% v/v, un tratamiento sin aireación (T3) y otro con aireación (T4); y dos unidades experimentales sin inoculación de algas, un tratamiento sin aireación (T5) y otro con aireación (T6).
Medición de parámetros
Los valores de pH fueron monitoreados cada 24 horas utilizando el pH-metro Acumet XL150, considerando que el pH del agua residual fue de 8.44 ± 0.22, un valor óptimo para el cultivo de algas 13, no fue necesario el uso de un agente corrector. El pH inicial promedio de los cultivos con Nitrofoska foliar fue de 6.99 ± 0.05, por lo que se utilizó KOH al 10% para corregirlo.
El conteo diario en cámara de Neübauer permitió obtener las curvas de crecimiento y calcular la productividad celular 1; se realizó la medición de parámetros fisicoquímicos para cada tratamiento hasta el día en el que se evidenciaba un decremento del número celular.
El registro diario de conductividad, sólidos disueltos totales (TDS) y temperatura se obtuvo mediante un multiparámetros KETOTEK.
Para la determinación de DBO5 se utilizó el método respirométrico 5210-B, el valor del nitrógeno total se obtuvo por el método de Kjeldahl, para la medición del nivel de fosfatos se utilizó el método de fósforo soluble en agua por ácido ascórbico 3500-D y para los sulfatos se usó el método 4-229-A. Estas mediciones se llevaron a cabo al inicio y al final del ensayo.
III. RESULTADOS Y DISCUSIÓN
Control del pH
Se recomienda un pH alcalino para el crecimiento óptimo de algas porque facilita la solubilidad de minerales como el calcio, hierro, magnesio, cobre y zinc, permitiendo una mejor absorción de nutrientes 13.
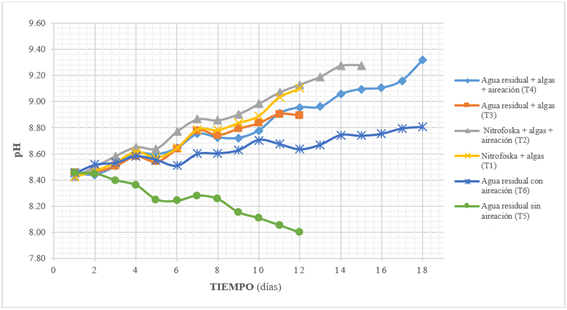
El agua residual presentó un pH inicial de 8.45 ± 0.22, y los tratamientos con Nitrofoska foliar registraron un pH inicial promedio de 8.42 ± 0.14, observándose una tendencia creciente en los tratamientos a lo largo del ensayo (Gráfico 1). Los valores promedio de pH medidos fueron: tratamiento cuatro (T4), 9.32 ± 0.17; tratamiento dos (T2), 9.28 ± 0.15; tratamiento uno (T1), 9.0 ± 0.1; tratamiento tres (T3), 8.89 ± 0.33; tratamiento seis (T6), 8.81 ± 0.13; y, tratamiento cinco (T5), 8.25 ± 0.10.
Los tratamientos que incluyen el inóculo de algas Chlorophyta y reciben aireación (T4 y T2) presentan el mayor incremento del valor de pH, sin diferencias significativas entre ellos, y los tratamientos con algas pero sin aireación (T1 y T3) muestran un incremento moderado del valor del pH, sin diferencias significativas entre ellos. Este efecto se debería a la actividad fotosintética de las algas por la asimilación del CO2 del medio 14; el CO2, al estar disuelto en agua, forma moléculas de ácido carbónico (H2CO3) que se disocia con gran facilidad en protones (H+) e iones bicarbonato (HCO3-) (2), y estos a su vez se disocian en iones carbonato (CO3 2-) y protones (H+) (15).
La acidificación observada en el tratamiento cinco (T5), que no recibió el inóculo algal ni aireación, podría deberse a bacterias anaerobias; estos organismos generan energía mediante vías fermentativas principalmente, produciendo sustancias orgánicas como el ácido láctico, ácido propiónico, ácido acético, butanol, etanol y acetona, cuya presencia causa la disminución del valor pH en el medio 16.
Crecimiento celular
Se evaluaron los cuatro tratamientos a los que se aplicó el inóculo algal: los tratamientos uno (T1) y dos (T2), que utilizaron Nitrofoska foliar como medio para el crecimiento celular; y, los tratamientos tres (T3) y cuatro (T4), formulados a partir del agua residual.
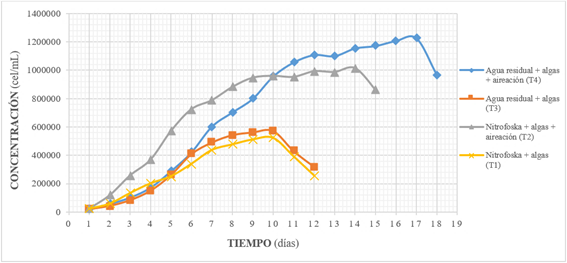
Los tratamientos sin aireación presentan menor crecimiento celular y llegan a la fase de muerte más rápidamente que los tratamientos que se oxigenaron (Gráfico 2).
El tratamiento cuatro (T4) presenta la mayor productividad celular, con 41944 células/L/día a los 17 días, seguido por el tratamiento dos (T2), con 39061 células/L/día a los 14 días.
Los resultados demuestran que la oxigenación es un factor limitante por encima del contenido de nutrientes en el medio 17. La eficiencia de los tratamientos con aireación se debería a la complementación biológica entre las algas y bacterias presentes en el sistema; tanto nitrificantes como bacterias que degradan la materia orgánica del efluente en presencia de oxígeno, despidiendo dióxido de carbono.
Este dióxido de carbono junto con el incorporado gracias a la aireación es utilizado por las algas en su proceso metabólico, desprendiendo el oxígeno requerido por la biomasa bacteriana. Estos datos sugieren que las aguas residuales con elevado contenido de materia orgánica constituyen un medio eficiente para la producción de biomasa algal 18.
Degradación de la materia orgánica
Se evaluaron los cuatro tratamientos formulados a partir del agua residual: tres (T3), cuatro (T4), cinco (T5) y seis (T6); considerando que el inóculo algal se aplicó únicamente a los dos primeros tratamientos citados.
La conductividad eléctrica (CE) y sólidos totales disueltos (TDS) permiten evaluar el consumo de iones metálicos y sales minerales presentes en el agua, elementos que intervienen en el proceso de fotosíntesis llevado a cabo por las algas 31, y cuyos valores se consideran requerimientos principales para el cultivo de algas 30, afectando de forma directa a la diversidad y crecimiento de algas 29.
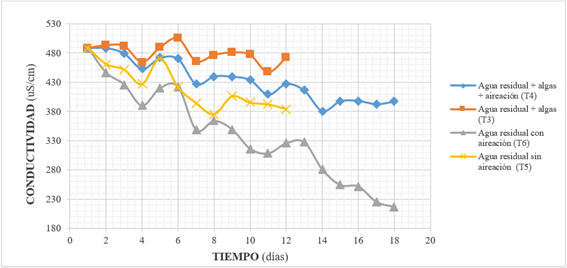
El porcentaje promedio de reducción de la conductividad eléctrica (CE) fue: 4.22% en T3, 20.65% en T4, 20.32% en T5, y 43.76% en T6; en general, las bacterias consumen más iones que las algas durante la respiración celular, lo que explica el rápido descenso en T6 y T5 19. Como se observa en el Gráfico 3, la CE tiende a disminuir en todos los tratamientos, lo que supondría también una reducción de los niveles de cloruros, nitratos, sulfatos, fosfatos, sodio, magnesio y calcio, principalmente 20.
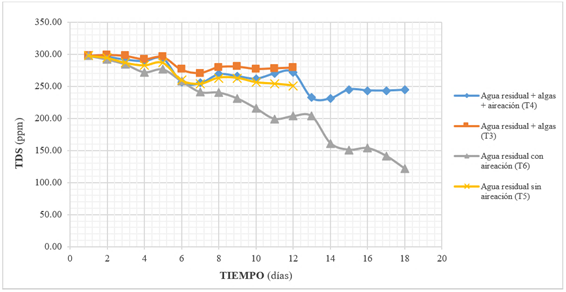
En función de la eficiencia en la reducción de sólidos disueltos totales (TDS), se tienen los siguientes resultados: tratamiento seis (T6), 56.93%; tratamiento cuatro (T4), 20.66%; tratamiento cinco (T5), 16.64%; y, tratamiento tres (T3), 8.84%. Como se observa en el Gráfico 4, el nivel de TDS tiende a disminuir en todos los tratamientos en el transcurso del tiempo, al igual que el efecto observado durante el monitoreo de la CE, lo que representa el descenso de la concentración de las sustancias inorgánicas y orgánicas contenidas en el medio en forma molecular, ionizada o en forma de suspensión micro-granular 20, notándose una menor eficiencia en los tratamientos que no recibieron aireación.
Los niveles de fosfatos, nitrógeno total Kjeldahl y demanda bioquímica de oxígeno (DBO5) del agua residual procedente del camal, exceden los límites establecidos en el Anexo 1 del Libro VI del Texto Unificado de Legislación Secundaria del Ministerio del Ambiente del Ecuador: Norma de calidad ambiental y de descarga de efluentes al recurso agua; 43 mg/L de fosfatos frente a un máximo de 10 mg/L, 47.8 g/L de nitrógeno total Kjeldahl con relación al límite de 15 mg/L y, 1676 mg/L correspondientes a la DBO5 sobre 100 mg/L permitidos. El único parámetro que se encuentra dentro de la norma es el de sulfatos, con un valor de 429 mg/L respecto al límite permitido que es de 1000mg/L (21). La evaluación de la depuración del agua residual se centró en la evolución de estos parámetros mediante la aplicación de los cuatro tratamientos antes citados.
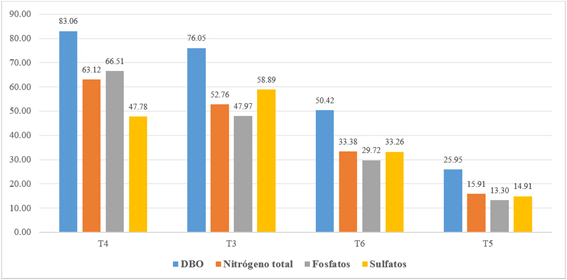
La tasa de reducción de la DBO5 fue: 83.1% ± 5.9 en T4, 76.1% ± 4.4 T3, 50.4% ± 5.7 en T6, y 25.9% ± 5.1 en T5. Como se muestra en el gráfico 5, los tratamientos que incluyeron el inóculo algal (T4 y T3) demostraron ser los más eficientes en la disminución de los niveles de materia orgánica susceptible de degradación biológica, lo que se fundamenta en la complementación existente entre las algas y bacterias presentes en el sistema.
Las bacterias degradan la materia orgánica transformándola en agua y dióxido de carbono, con un incremento de biomasa, productos que son utilizados por las algas en su proceso metabólico tras el cual desprenden oxígeno que será requerido por estas especies bacterianas 22.
En cuanto a los niveles de nitrógeno total Kjeldahl, se observa que el tratamiento cuatro (T4) logra una reducción de 63.1% ±2.3, seguida de T3, con 52.8% ± 5.3; T6, con 33.3% ± 7.1; y, finalmente T5, con 14.9% ± 6.6 (Gráfico 5). La eficiencia de T4 se atribuiría al crecimiento de las Chlorophyta considerando que el nitrógeno es uno de los principales requerimientos nutricionales de las algas.
El estado de este elemento en el cultivo es importante para la productividad de biomasa 20; la diferencia en los porcentajes de reducción con respecto a otros estudios se debería a que algunas formas de nitrógeno no pudieron ser asimiladas por las algas, debido a las condiciones de cultivo y a la variedad de especies presentes (17, 23, 24).
El porcentaje promedio de reducción de fosfatos en los diferentes tratamientos se muestra a continuación: T4, 66.5% ± 7.7; T3, 48.0% ± 6.6; T6, 29.7% ± 7.6; y T5, 13.3% ± 3.4 (Gráfico 5).
Todos los tratamientos son estadísticamente diferentes, siendo el tratamiento cuatro (T4) el más eficiente; este resultado se relaciona con la necesidad de fósforo como requerimiento esencial en los organismos fotosintéticos para la producción de ATP.
A diferencia del efecto de reducción observado con la DBO5, el nivel de nitrógeno y los fosfatos, en donde T4 resultó ser el tratamiento más eficiente, en el caso de los sulfatos fue T3 el tratamiento que generó la mayor tasa de disminución con 58.9% ± 7.7; seguido por T4, con 47.8% ± 8.7; a continuación T6, con 33.3% ± 7.1; y, finalmente T5, con 14.9% ± 6.6 (Gráfico 5). La mayor reducción de sulfatos en cultivos sin aireación estaría relacionada con la capacidad de ciertas especies de Chlorophyta de crecer a bajas concentraciones de CO2 como organismos mixotróficos, utilizando compuestos orgánicos e inorgánicos como aceptores de electrones en el proceso de respiración, entre ellos los sulfatos (25, 26, 27).
IV. CONCLUSIONES
Los datos demuestran que los tratamientos con algas Chlorophyta logran una reducción eficiente de materia orgánica por los requerimientos metabólicos de nutrientes como nitrógeno, fosfatos y sulfatos, y por las asociaciones simbióticas con las bacterias generando cantidades representativas de biomasa.
El nitrógeno y su disponibilidad se manifiestan como nutriente limitante para el crecimiento celular, siendo la relación N/P obtenida en los ensayos de 1.1/1N/P frente a 4/3 que se establece bibliográficamente como óptima 32, sin embargo la oxigenación constituyó un factor limitante por encima del contenido de nutrientes en el medio.
El tratamiento más eficiente para la remoción de DBO5, fosfatos y nitrógeno total es el tratamiento cuatro (T4), correspondiente al cultivo de algas en agua residual de camal con aireación.
Además, este tratamiento presenta una productividad celular mayor a la obtenida mediante el uso de un medio de cultivo, lo que demuestra que las aguas residuales de camal constituyen una alternativa óptima y económica para la producción de biomasa algal con gran potencial biotecnológico que podría beneficiar a la comunidad