I. INTRODUCCIÓN
La relación entre salud y nutrición ha puesto su atención en compuestos bioactivos de los alimentos que puedan mejorar las condiciones y calidad de vida 1. La principal fuente de nutrientes son las frutas, las cuales aportan vitaminas, minerales, proteína y fibra. Por otro lado, gracias al metabolismo secundario, las plantas producen compuestos como carotenoides, esteroles, glucosinolatos, polifenoles, entre otros; 2,3 que le sirven para protegerse frente a factores bióticos y abióticos 4 y para la comunicación alelopática 5. Las bayas o “berries” son frutas caracterizadas por ser aromáticas y poseer vistosos colores. Estas características son otorgadas por algunos de los metabolitos secundarios antes mencionados, producidos por estas frutas como mecanismo de protección frente a radiación y baja temperatura 5,6. En diversos estudios se ha determinado que dichos compuestos brindan beneficios claros en nuestra salud, ya que tienen la capacidad de evitar el estrés oxidativo 7.
Si se considera el contenido de compuestos bioactivos, a la presente fecha, la promoción del consumo de frutos rojos es creciente, ya que los compuestos químicos que ellas producen, están asociados con la protección frente a enfermedades degenerativas 8, crónicas 9, inflamatorias 10, entre otras. En Chile, existe una amplia diversidad de bayas que crecen bajo distintas condiciones ecológicas 11, sin embargo, algunas como el arrayán o arrayana (Luma apiculata) 12, calafate (Berberis microphylla) 13, frutilla blanca (Fragaria chiloensis ssp. chiloensis) 14 y murtilla (Ugni molinae) 15 que, por su condición silvestre o de semi-domesticación, su valor a nivel agronómico, industrial, y nutracéutico aún no ha sido explotado. A pesar de no ser nativa, otra baya de importancia por su representatividad en la cultura vitivinícola chilena es la uva tintorera, que es uno de los pocos cultivares de Vitis vinifera con una pulpa de bayas de color rojo, (cultivar teinturier) y que por su alto potencial de intensidad de color se usa para mejorar vinos menos coloreados 16.
En la mayoría de los berries comerciales se han encontrado antocianinas como delfinidina glicosilada, petunidina, malvidina, peonidina y cianidina 17-19, así como ácido elágico, y elagitaninos en frutillas y fresas 20; muchos de ellos están asociados con los efectos de los beneficios de salud 9. La absorción de fuentes de polifenoles asegura la eliminación de radicales libres y también aumenta las propiedades cognitivas y previene o reduce el riesgo de enfermedades neurodegenerativas 21.
Por los antecedentes se conoce que las bayas tienen una producción considerable de metabolitos secundarios la misma que está condicionada por los factores edafoclimáticos que rodeen a la planta, así, el presente trabajo busca destacar el potencial de cinco berries nativos chilenos del centro y sur de Chile, para promoción de futuros trabajos y generación de alimentos funcionales en relación a los compuestos bioactivos de arrayan, calafate, murtilla, frutilla blanca y uva tintorera.
II. MATERIALES Y MÉTODOS
2.1 Material vegetal
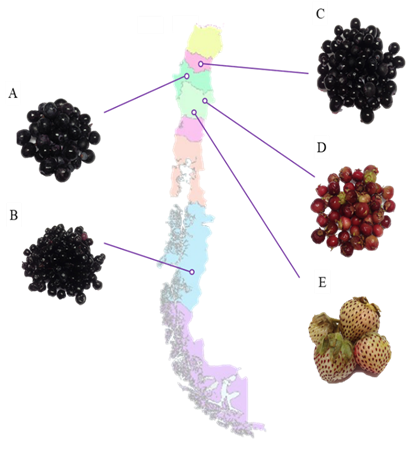
Se trabajó con bayas en estado óptimo de maduración colectadas de la zona centro y sur de Chile: arrayana (Luma apiculata) de Mulchén, Región de Bio-Bio, calafate (Berberis microphylla) de Coyhaique, Región Aysén; frutilla blanca (Fragaria chiloensis ssp.chiloensis) de Purén, Región de la Araucanía, murtilla (Ugni molinae) de Temuco, Región de la Araucanía y tintorera (Vitis vinífera) de Quillón, Región de Ñuble (Fig. 1); y se mantuvieron a -80°C en el Laboratorio de Química, Departamento de Producción Vegetal de la Universidad de Concepción - campus Chillan previo a su análisis.
2.2 Reactivos
Estándares comerciales de delfinidina-3-glucósido (98.84 %), cianidina3-glucósido (99.21 %), petunidin-3-glucósido (99.90 %), malvidin-3-glucósido (99.91 %), Peonidin-3-glucósido (> 97 %), cianidina-3-lathyroside (> 97 %) de Sigma -Aldrich. El reactivo Folin-Ciocalteu, carbonato sódico (Na2CO3), buffer de cloruro de potasio pH 1 y buffer acetato de sodio pH 4,5, el radical 2,2-difenil-1-picrilhidracil (DPPH), Trolox, FeCl3-6H2O, HCl, TPTZ por Merck (Alemania) y ácido fórmico, acetonitrilo, metanol y agua en grado HPLC de Merk.
2.3 Características físico-químicas y preparación de extractos
La determinación de las propiedades físico-químicas se realizó a partir de frutos elegidos al azar. Se midieron diámetros ecuatorial y polar de 20 berries por especie y el peso en 100 frutos de cada una de las muestras. El pH, solidos solubles y acidez se obtuvieron a partir de frutos triturados, utilizando el pHmetro digital marca INOLAB serie PH7110 para pH y la medición de solidos solubles en °Brix utilizando un refractómetro SPER SCIENTIFIC serie 300010. La acidez se determinó por titulación con NaOH 0,1M a partir de 0,5 g de muestra triturada y diluida en 150 ml de agua destilada. La extracción de antioxidantes se realizó por ultrasonido a partir de 0,5 g de muestra en 5 ml de metanol/agua/acido fórmico (25:24:1 / v: v: v) con 1 hora de ultrasonido, incubación a 0°C durante 24h y posterior centrifugación a 3.500 rpm durante 15 minutos.
2.4 Determinación de polifenoles totales, antocianinas y capacidad antioxidante
El análisis de polifenoles totales se realizó por el método de Folin Ciocalteu 22, con una curva de calibración de ácido gálico como estándar (0, 0.1, 0,25; 0,5 y 1 g/l) y medición de la absorbancia de las muestras a una longitud de onda de 760 nm a través de un espectrofotómetro UV/vis Thermo Scientific; agregando a cada vial 120 μl de reactivo de Folin Ciocalteu 1N, 25 μl del extracto (muestra), 1,62 ml de agua y finalmente 340 μl de la disolución de carbonato de sodio al 20 %, y 2 horas de incubación en oscuridad. El contenido de polifenoles fue expresado en mg. de equivalente ác. gálico /100g peso fresco de muestra.
Para la determinación de antocianinas totales se utilizó el ensayo de pH diferencial con tampones de cloruro de potasio 0,025 M a pH 1 y acetato de sodio 0,4 M a pH 4,5. 23 De cada extracto obtenido previamente se extrajeron dos muestras con 0,1 ml en dos tubos por separado se agregó 2,9 ml de tampón KCl y al tubo 2 se adicionó 2,9 ml de tampón CH3CO2Na y se leyó la absorbancia a 510 y 700 nm de cada uno de los tubos (4 medidas espectrofotométricas en total) en un espectrofotómetro UV vis Thermo Scientific™. Los datos se expresaron en mg de cianidina-3-glucósido/100g de peso fresco.
El valor de capacidad antioxidante FRAP se obtuvo con 30 µl del extracto, 300 µl de agua destilada y la adición de 3000 µl del reactivo FRAP (FeCl3-6H2O 20mM, TPTZ10mM y tampón acetato 0,3mM) incubados a 37 °C durante 30 min y medidos a 595 nm de absorbancia en el espectrofotómetro antes descrito. El blanco fue agua destilada. Los resultados se enunciaron como µmol trolox/100g de muestra peso fresco. Respecto a la capacidad antioxidante DPPH, se utilizó 100 µl del extracto y 2,9 ml de la solución DPPH agitados constantemente y posterior incubación en oscuridad durante 1 hora. Finalmente se realizó la lectura a 515 nm. Los resultados se expresaron en µmol trolox en100g de muestra peso fresco. El blanco contenía 3 ml de metanol.
2.5 Identificación y cuantificación de compuestos fenólicos por HPLC-DAD.
Los análisis HPLC-DAD para la identificación y cuantificación de polifenoles se llevaron a cabo en una columna columna Kromolith de fase inversa (RP) -18 (250-4,6 mm id) equipada con un detector de fotodiodos (DAD) (Merk-Hitachi, Darmstadt, Alemania). con fase móvil compuesto por dos disolventes: agua (A) y ácido fórmico (B) (99:1, v/v) y caudal de 1 ml/mincon variación del gradiente de 8 % de disolvente B, 15 % a 25 min, 22 % a 55 min y 40 % a 60 min, mantenido hasta 70 min. Los compuestos se identificaron por comparación con patrones. Para los análisis cuantitativos, se registraron los cromatogramas a 360 y 520 nm (Figura 2 y Figura 3). Como estándares se utilizaron para las antocianinas cianidina-3-glucósido a 520 nm y para los flavonoles, quercetina-3-rutinósido a 360nm (Sigma Chemical Co. St. Louis, MO).
Para determinar, polifenoles totales, antocianinas totales y capacidad antioxidante por los métodos FRAP y DPPH, cada muestra se replicó tres veces y los resultados se informan en medias ± desviación estándar y análisis de varianza (ANOVA) con un nivel de significancia p<0,05 y prueba de comparación de Tukey, utilizando el programa estadístico SAS versión 8.0 para Windows.
III. RESULTADOS
Las características físico-químicas y preparación de extractos se presentan en la Tabla 1. Los resultados muestran que el pH de los berries está entre 3,7 y 4,2. siendo murtilla la más ácida y arrayan la más alcalina. Respecto a los azucares totales, la frutilla posee 7,5 g/100g por ende es la más dulce, seguido por calafate y uva tintorera. Estas características confirman la posibilidad de aceptación de estos berries para el consumo y aseguran el aprovechamiento de éstas en dietas sanas y/o la elaboración de alimentos funcionales.
En la Tabla 2, se registra el valor más alto (1066,4 ± 24,9 mg ácido gálico /100g de muestra y 1031,9 ± 48,1 mg de cianidina/100g de peso fresco) en polifenoles y antocianinas (respectivamente) en calafate superior a otros reportes 24. Los valores menores en cuanto a polifenoles, se obtuvieron para murtilla y frutilla blanca. Murtilla, presentan un total de 260,5 ± 20,2 mg ác. gálico/100g muestra, similar a otro reporte 15, mientras que, frutilla blanca coincide con lo obtenido por otros investigadores 12.
Tabla 1 Comparación de características físico-químicas de arrayan (L. apiculata), uva tintorera (V. vinífera), frutilla blanca (F. chiloensis ssp. chiloensis), murtilla (U. molinae) y calafate (B. microphylla) del centro y sur de Chile.
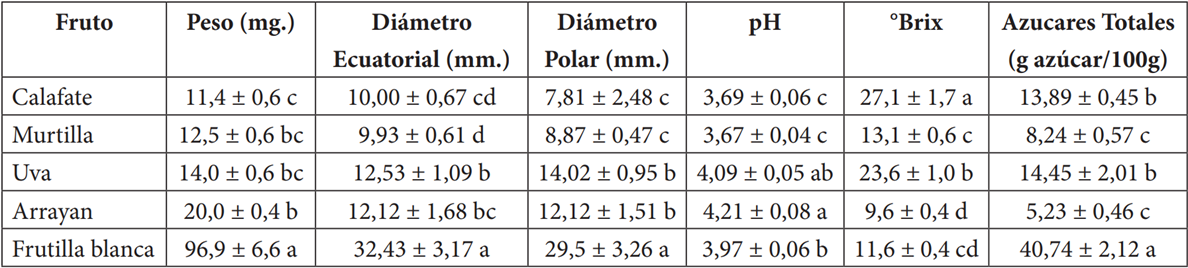
*Peso medido en mg. y los diámetros polar y ecuatorial en mm. Letras diferentes indican diferencias significativas entre valores de la misma columna (p> 0.05).
En cuanto a capacidad antioxidante, los resultados (Tabla 2) demuestran que calafate posee el más alto poder reductor de radicales libre mediante método FRAP (11279,2 ± 2027,4 μmol/100g); similares datos han sido alcanzados previamente 13. Para el radical DPPH, los mejores resultados son calafate (5235,0 ± 445,9 a μmol/100g.), arrayan (4401,7 ± 493,9) y uva tintorera (4335,0 ± 156,1 μmol/100g). Los valores para tintorera son superiores a lo reportado para uvas comerciales 27.
Tabla 2 Polifenoles totales, antocianinas totales, y capacidad antioxidante por medición del poder de reducción del radical libre DPPH y reducción férrica (FRAP) en arrayan (L. apiculata), uva tintorera (V. vinífera), frutilla blanca (F. chiloensis ssp. chiloensis), murtilla (U. molinae) y calafate (B. microphylla) del centro y sur de Chile.
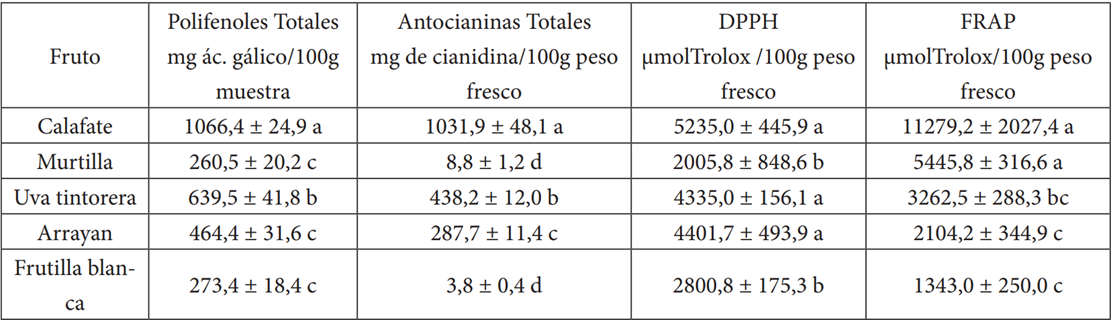
*Letras diferentes indican diferencias significativas entre valores de la misma columna (p> 0.05).
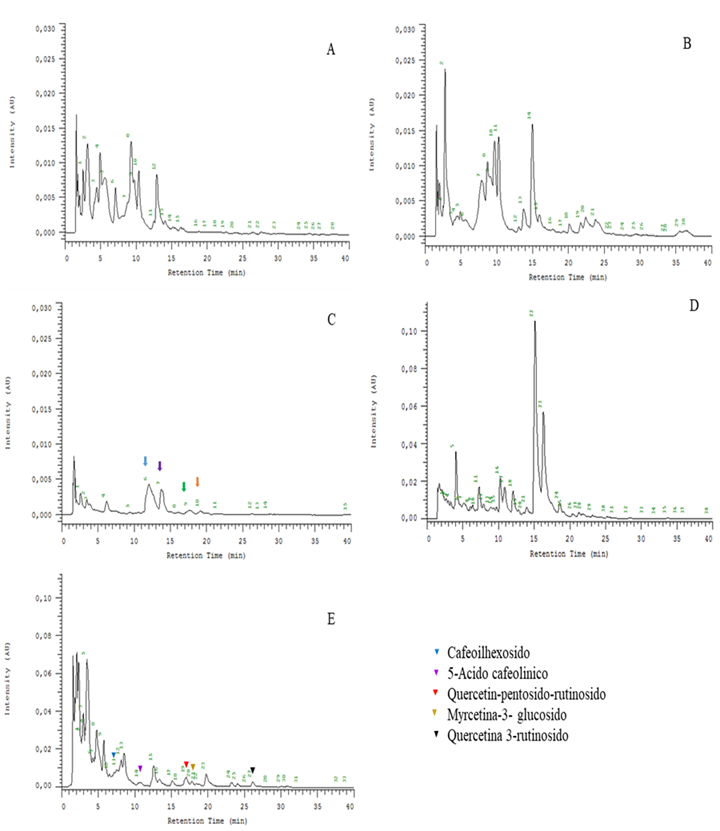
Figura 2 Cromatogramas HPLC-DAD, longitud de onda 360nm. A Arrayan (L. apiculata) B. Tintorera (V. vinífera) C. Frutilla blanca (F. chiloensis ssp. chiloensis) D. murtilla (U. molinae) y E. calafate (B. microphylla).
El perfil químico (Fig. 2), a longitud de onda 360nm muestra diferencias en los cromatogramas generando más de 30 posibles flavonoles. Se reportaron 26 flavonoles principalmente quercetina y myricetina para berries similares a los utilizados en este estudio 26. La Fig. 2-C muestra el cromatograma de frutilla blanca donde se han marcado compuestos que esta fruta posee pero que no se identificaron. Estos pudieran corresponder a elagitaninos (ácido elágico, glucósidos de ác. elágico y elagitaninos), además de pelargonidin-3-glucósido y cianidina-3-glucósido como describen otros investigadores 20 y similar a otro reporte donde a partir de fruta liofilizada se encontraron 2,12 mg de quercetina/g. 27 como parte de los ácidos hidroxicinámicos (elagitaninos) y que presentan evitan daños cardiovasculares y cáncer 28.
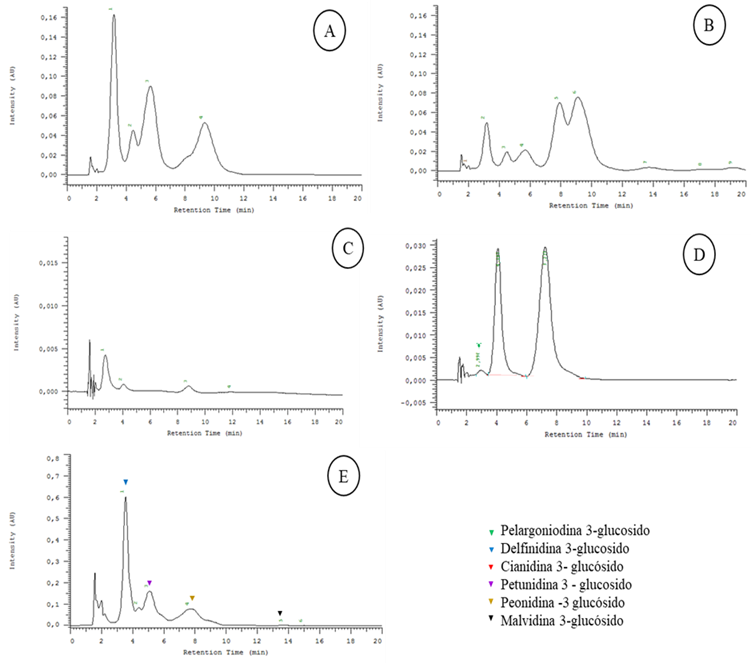
Figura 3 Cromatogramas HPLC-DAD, longitud de onda 520 nm. A Arrayan (L. apiculata) B. Tintorera (V. vinífera) C. Frutilla blanca (F. chiloensis ssp. chiloensis) D. murtilla (U. molinae) y E. calafate (B. microphylla).
En el presente estudio para los 5 berries mediante HPLC-DAD se identificaron 9 antocianinas a partir de extractos, todas ellas variantes glucosiladas de cianidina, delfinidina, malvidina, peonidina, petunidina y pelargonidina. Los cromatogramas individuales constan en la Figura 3. Estos resultados son similares a los reportados en otras investigaciones donde se menciona que los compuestos predominantes en todos los berries comestibles son malvidina-3-glucósido, cumarato de malvidina-3-glucósido y la delfinidina-3-glucósido 24) (17 y se destaca este último presente en calafate (Fig. 3 E) que se encuentra en mayor cantidad respecto a las otras bayas 27.
IV. DISCUSIÓN
Según la FAO, en frutas el pH 3,5 es el mínimo requerido para la aceptación y consumo 29; en consecuencia, todas las frutas analizadas en este trabajo pueden tener alta probabilidad de ser aceptadas por los consumidores. Los grados Brix (entre 5 y 20) y alto contenido de azúcares totales son indicadores de madurez y calidad gustativa 30 en este calafate y uva tintorera sobresalen. Por otro lado, algunas antocianinas se enlazan con diferentes azúcares 2, lo que indica que la presencia de altos contenidos de azúcar podría potenciar el efecto de dichos flavonoides frente al estrés oxidativo.
La caracterización de diferentes tipos de frutas y su contenido de componentes antioxidantes específicos responde a la orientación actual de consumo de alimentos que contengan compuestos bioactivos y presenten beneficios a la salud 3. Los resultados respecto a polifenoles y antocianinas en calafate mostraron valores superiores a otros reportes 24. Así mismo, se pudo constatar que todos los berries en estudio poseen contenidos de compuestos fenólicos considerables, incluso superiores a los resultados reportados para bayas comerciales como en el caso de uva tintorera (639,5 ± 41,8) frente a lo probado para uvas comerciales 460,45 ± 45 mg ácido gálico /100g de muestra 17.
Así, el poder reductor de estas bayas es promisorio. Las diferencias en las cuantificaciones analíticas, respecto al poder reductor de las frutas nativas chilenas comparado con los valores obtenidos por otros investigadores se debe a que la cantidad de polifenoles totales como de antocianinas totales depende de diversos factores medio ambientales, localidad de recolección, etapa de maduración, especie, tipo de cultivo, entre otros 31. De igual forma, trabajos previos 9,10,32 demuestran que las antocianinas tienen efectos beneficiosos para el tratamiento de enfermedades crónicas, por ello, la referencia en término de estos compuestos es importante para continuar con estudios tanto in vitro como in vivo respecto a las propiedades neuroprotectoras, cardioprotectoras, antiinflamatorias y anticancerígenas que estos berries pudieran ofrecer.
V. CONCLUSIONES
Estos resultados preliminares indican que los perfiles de antocianinas de las cinco 5 bayas recolectadas de la región centro y sur de Chile mostraron un alto predominio de antocianinas (delfinidina y derivados de cianidina). Calafate (B. microphylla) es la baya que mostró los niveles más altos de antocianinas totales y actividad antioxidante por el método FRAP y DPPH seguida de uva tintorera y arrayan. Por su parte murtilla y frutilla blanca, a pesar de mostrar cantidades menores de antocianinas y polifenoles, gracias al estudio del perfil químico, se encontraron compuestos que podrían ser de interés para estudios posteriores como los elagitaninos en frutilla blanca (F. chiloensis ssp. chiloensis). Estos frutos ricos en compuestos polifenólicos tienen un futuro prometedor para ser incorporados como ingredientes funcionales, por lo que es meritorio continuar con el estudio de estas bayas.