1. Introducción
La comercialización de bioplaguicidas microbianos a base de hongos se ha incrementado en los últimos años y representa entre el 10 y el 15 % del mercado total de bioplaguicidas, el cual se estima que alcance los 6,6 mil millones de dólares para el año 2022 (Pathan et al., 2019). La mayoría de los hongos producidos comercialmente para ser utilizados en programas de manejo integrado de plagas y enfermedades pertenecen al orden Hypocreales, destacándose Trichoderma spp., Metarhizium spp., Isaria spp., Lecanicillum spp., Paecilomyces spp. y Beauveria spp. (Miranda-Hernández et al., 2017).
Aproximadamente el 60 % de todos los bioplaguicidas a base de hongos están constituidos por productos cuyo principio activo son especies de Trichoderma spp., los cuales están disponibles en diferentes formulaciones. Lo anterior se debe a sus diversos mecanismos de control contra patógenos de plantas como Botrytis cinerea, Fusarium sp., Phytophthora sp., Rhizoctonia solani y Sclerotium rolfsii (Mukhopadhyay y Kumar, 2020; Rodríguez-León et al., 1999). En el caso específico de Trichoderma spp., esta utiliza múltiples mecanismos para ejercer un control biológico contra fitopatógenos, como es el micoparasitismo, la producción de metabolitos secundarios con actividad antibiótica, competencia por nutrientes y espacio, y la inducción de la respuesta sistémica en plantas. Además, en los últimos años se han reportado múltiples investigaciones en las cuales Trichoderma ejerce efectos promotores de crecimiento en plantas, contribuyendo a su crecimiento y desarrollo. Dentro de estos mecanismos, ayuda a la degradación de la materia orgánica, aumentando la disponibilidad de nutrientes para las plantas y mejorando la absorción de minerales como MnO2, Zn, Ca2+, Mg2+, K y P y aumentando el contenido, confiriendo beneficios a la salud y nutrición de las plantas (Saldaña-Mendoza et al., 2023; Zaki et al., 2020).
Para el caso de hongos entomopatógenos, los bioplaguicidas más desarrollados y disponibles comercialmente pertenecen a dos géneros: Beauveria spp. y Metarhizium spp. (Ascomycota: Hypocreales) (Faria y Wraight, 2007; McGuire y Northfield, 2020); esto se debe a su amplia distribución, diversidad de hospederos y a su alta persistencia en el medio ambiente (Brunner-Mendoza et al., 2019). Metarhizium anisopliae y Beauveria bassiana son dos especies de hongos entomopatógenos que han sido ampliamente estudiados por su uso en el control biológico. Ambas especies se encuentran de manera natural y se han reportado en una amplia gama de plagas de insectos, lo que las hace versátiles en su aplicación. Además, estos hongos también son conocidos por su alta virulencia y capacidad de persistir en el ambiente (Diego-Nava et al., 2023; Kala et al., 2020).
En la actualidad, es de gran interés la estandarización de métodos económicos y rápidos para evaluar la calidad de bioinsumos agrícolas. Específicamente, el control de calidad puede aplicarse en diferentes etapas de la producción de bioinsumos como: en la obtención de materias primas e insumos, en el proceso de producción y en el producto terminado. La implementación del control de calidad en cada etapa asegura la máxima eficacia en campo y el cumplimiento de los requerimientos de inocuidad (Santos Díaz et al., 2022). El control de calidad microbiológico se enfoca en la identificación, autentificación, cuantificación y viabilidad del principio activo y en la determinación del contenido de contaminantes. La viabilidad de los principios activos de bioplaguicidas a base de hongos (conidios, células, blastosporas) puede evaluarse por medio del recuento en placa o la germinación de conidios; este último parámetro es uno de los más utilizados para determinar la calidad de bioinsumos a base de hongos filamentosos y en algunos casos permite evaluar los efectos de condiciones ambientales como la radiación ultravioleta, temperaturas extremas y condiciones de almacenamiento (Oliveira et al., 2015; Stentelaire et al., 2001). Los conidios son el principio activo de casi el 75 % de los bioplaguicidas disponibles en el mercado a nivel mundial (Zaki et al., 2020). Debido a esto, el protocolo para evaluar la germinación de los conidios es habitualmente la técnica más utilizada en el proceso de control de calidad de productos a base de hongos filamentosos. Sin embargo, existen diferencias en los protocolos y, por tanto, es una necesidad determinar las mejores características para que el método sea implementado por tipo de microorganismo. Algunos de los factores que influyen en la germinación de conidios de hongos biocontroladores son el pH, la composición del medio de cultivo, la disponibilidad de agua, el proceso de hidratación del producto, la temperatura de incubación y el uso de sustancias sincronizadoras de germinación (Alves et al., 1996; Faria et al., 2010; Le Grand y Cliquet, 2013; Oliveira et al., 2015).
En resumen, se sigue el procedimiento descrito por Inglis et al. (2012), en donde la muestra a evaluar se diluye en diluciones seriadas en base 10 y la dilución con una concentración aproximada de 107 conidios mL-1 se siembra en un medio de cultivo apropiado; las cajas de Petri inoculadas se incuban aproximadamente durante 18 a 24 h y trascurrido este tiempo, los conidios germinados y no germinados se cuantifican mediante observación en microscopio (Inglis et al., 2012). En ese sentido, varios autores reconocen la necesidad de establecer variables críticas en la metodología, como son: la selección del medio de cultivo, el tiempo de incubación, la forma de siembra, el uso de colorantes, o la adición de sustancias sincronizadoras del proceso de germinación, entre otros (Lopes and Faria, 2019; Faria et al., 2010; Hsia et al., 2014; Oliveira et al., 2015). Con el propósito de contribuir en los procesos de estandarización de control de calidad de bioinsumos a base de hongos filamentosos, el objetivo de este estudio fue seleccionar los medios de cultivo adecuados, el tiempo de incubación y la concentración de sustancia sincronizadora de germinación para las cepas élite Trichoderma koningiopsis (Th003), Lecanicillium lecanii (Vl026) y Metarhizium robertsii (Mt004). Estas fueron seleccionadas en trabajo previos por sus características biológicas (Cotes Prado, 2018) y porque son principios activos de bioplaguicidas comercializados para uso agrícola. Además, es importante mencionar que pertenecen a los géneros más utilizados en el desarrollo de bioinsumos agrícolas.
2. Materiales y Métodos
2.1. Cepas élite de hongos
Los hongos filamentosos T. koningiopsis Th003, M. robertsii Mt004 y L. lecanii Vl026 evaluados en este estudio fueron proporcionados por el Banco de Germoplasma de Microorganismos de Agrosavia (BGMA) ubicado en Mosquera, Colombia, y registrado en el Registro Nacional de Colecciones Biológicas (RNC) bajo el número RNC:129.
2.2. Selección de medios de cultivo, tiempos de incubación y concentración de sustancia sincronizadora para la prueba de germinación
Para T. koningiopsis y M. robertsii se evaluaron los medios de cultivo agar agua (AA) y papa dextrosa agar (PDA) sin y con benomil (sustancia sincronizadora de germinación) a las concentraciones de 0,0003 % y 0,0005 %. Para L. lecanii Vl026 la germinación se evaluó en los medios de cultivo AA y agar extracto de malta (EM), con y sin benomil a las mismas concentraciones. También se evaluaron los tiempos de lectura de 18 y 24 h. Para esto, a partir de cultivos esporulados de 5 días de edad de Th003, Vl026 y Mt004 se realizó un raspado con 5 mL de Tween® 80, posteriormente se filtró y se realizaron diluciones seriadas hasta 10-2 (dilución que permitiera contar mínimo 300 conidios por cámara de Neubauer). Se realizaron dos recuentos por cada cepa y se ajustó la concentración final de 1x107 conidios mL-1, la cual permite realizar un recuento de conidios estadísticamente representativo, según Santos Díaz et al. (2022) y Oliveira et al. (2015). De cada microorganismo se sembraron 100 μL en los medios de cultivo específicos y las cajas de Petri inoculadas se incubaron a 25 ± 2 °C durante 18 y 24 h. En cada tiempo de evaluación se realizó el recuento de conidios germinados y no germinados mediante observación al microscopio con el objetivo 40×. Un conidio se consideró germinado cuando el tubo germinal era igual o mayor a la longitud del mismo conidio (Permadi et al., 2020). El porcentaje de germinación se calculó de acuerdo con la ecuación (1) (Santos Díaz et al., 2022).
El diseño experimental fue completamente al azar con un arreglo factorial 2x2x3 y cuatro medidas repetidas en el tiempo. La unidad experimental se definió como una caja de Petri con dos lecturas y un total de 8 datos (n=8) por tratamiento. Para el análisis estadístico se utilizó un análisis de varianza multifactorial con una interacción de orden máximo de 1, empleando el programa STATGRAPHICS Centurion XVI versión 16.1.03. Para el análisis de la normalidad y la homocedasticidad de los resultados se realizó la prueba de Shapiro Wilks (95 %) y Bartlett (95 %), respectivamente. Una vez que se demostraron estos principios se realizó un análisis de varianza ANOVA y una prueba de comparación de medias de Tukey (95 %). Los datos que no cumplieron con los principios de normalidad y homocedasticidad se analizaron con una prueba no paramétrica de Kruskal-Wallis (95 %). Finalmente, para la selección de las condiciones de la prueba de germinación se diseñó una matriz de decisión siguiendo el modelo de jerarquización. Para esto, los criterios fueron: formación de tubo germinal y morfología del conidio clasificados según Tabla 1. Las condiciones favorables para cada microorganismo correspondieron al tratamiento con las más altas valoraciones por cada criterio de selección.
3. Resultados y Discusión
Para las tres cepas élite evaluadas se validó que el uso de medios enriquecidos como PDA y EM, favorecen la germinación de los conidios en comparación con el uso de medios de cultivo basales como el AA. Este resultado era de esperarse, teniendo en cuenta que estos son medios enriquecidos y empleados comúnmente para su crecimiento. Sin embargo, es frecuente que el uso de este tipo de medios cause una germinación asincrónica de los conidios, generando la necesidad de seleccionar medios alternativos que permitan lograr una correcta evaluación de la probabilidad del establecimiento exitoso de los conidios y su germinación (Gilchrist et al., 2006). Es por esto que la adición de sustancias como el benomil a concentraciones inferiores a 0,001 % permite que el proceso de germinación de conidios sea sincrónico, preciso y reproducible. El análisis de los factores medio de cultivo y tiempo de incubación sobre la germinación de los conidios de los hongos evaluados evidenció que para el hongo T. koningiopsis Th003, el medio de cultivo tiene un efecto estadísticamente significativo sobre la germinación de los conidios (F5,95 = 15,73; p = 0,000), mientras que el factor tiempo no evidenció un efecto significativo sobre esta variable (F5,95 = 0,02, p = 0,891) con un 95 % de confianza. En contraste, el medio de cultivo seleccionado para los hongos M. robertsii Mt004 (F5,95 = 8,99; p = 0,000) y L. lecanii Vl026 (F5,95 = 47,56; p = 0,000) y la variable tiempo de incubación (F5,95 = 9,50; p = 0,003 y F5,95 = 26,30; p = 0,000), evidenciaron un efecto significativo sobre el resultado de la germinación de los conidios de los dos hongos, respectivamente.
Al evaluar los diferentes medios de cultivo con T. koningiopsis Th003 se evidenció que en PDA y AA los porcentajes de germinación promedio (n=8) alcanzados después de 18 h de incubación a 25 °C fueron de 100 % y 97,24 %, respectivamente y no se presentaron diferencias significativas entre los dos medios evaluados. La adición de benomil a una concentración de 0,0003 % al medio PDA causó una disminución significativa del número de conidios germinados mayor a 15 % a las 18 h de incubación. Mientras que la adición de benomil a la misma concentración en AA, evidenció una germinación de los conidios de 93,49 % con una disminución menor a 5 %. La adición de benomil en los medios PDA y AA, ajustado a una concentración de 0,0005 %, permitió la germinación de los conidios de Th003 entre un 94 % y un 70 %, respectivamente. Sin embargo, los conidios germinados evidenciaron disminución en la elongación del tubo germinal y deformación desde las 18 hasta las 24 h de incubación a 25 °C, respectivamente.
Los resultados de germinación obtenidos en este estudio sugieren que en el caso de Th003, la elección del medio de cultivo (ya sea enriquecido o basal) y la sustancia empleada para inducir una germinación sincronizada son elementos críticos que influyen significativamente en la evaluación precisa de potencial biológico del agente biocontrolador. Este resultado concuerda con lo descrito por Jackson (1997) quienes reportaron que las condiciones nutricionales durante el crecimiento y la esporulación de un hongo influyen en la acumulación de reservas endógenas apropiadas para que las esporas recién formadas mantengan sus características biológicas. En este sentido, es probable que los conidios inoculados mantuvieran reservas para lograr su germinación sobre los dos medios evaluados, pero la adición de benomil, aún a bajas concentraciones, no permitió el correcto desarrollo y elongación del tubo germinal; probablemente debido a que el benomil inhibe la polimerización de la tubulina y actúa sobre un punto del metabolismo del hongo que afecta el proceso de división celular (Castellanos González et al., 2022). A pesar de no observarse diferencias en el porcentaje de germinación alcanzado en el tiempo para los resultados de este estudio, es crucial evitar la introducción de variables que puedan interferir con el desempeño de potencial biológico del hongo biocontrolador. Por lo tanto, estos resultados nos permiten seleccionar la concentración adecuada de benomil para la evaluación de la germinación sincrónica de la cepa élite y poder identificar alguna anomalía propia del hongo. En relación con los intervalos de tiempo de evaluación, no se identificó una diferencia significativa en cuanto al recuento de conidios germinados entre las 18 y 24 horas de incubación en ninguno de los medios analizados. Estos resultados sugieren que el rango de tiempo de incubación evaluado permitió una lectura adecuada de un número de conidios que estadísticamente aseguran su viabilidad, lo que corresponde a uno de los aspectos cruciales para garantizar la actividad biológica deseada de los microorganismos empleados como principio activo de bioinsumos de uso agrícola (Daryaei et al., 2016).
Para evaluar la germinación de los conidios de L. lecanii Vl026 se emplearon los medios agar extracto de malta EM y agar agua AA solos y suplementados con benomil. En el medio agar EM con y sin adición de benomil en las dosis de 0,0003 % y 0,0005 % se logró una germinación de 100 % desde las 18 h de incubación, similar al obtenido con AA sin benomil. Este resultado concuerda con lo reportado por Francisco et al. (2006) quienes evaluaron la germinación de un aislamiento de L. lecanii en diferentes medios de cultivo y reportaron una tasa de germinación promedio superior a 99 % en medio AA, PDA y Agar Sabouraud-Dextrosa. Estos resultados sugieren que este microorganismo posee la capacidad de mantener una reserva nutricional adecuada para asegurar la germinación y el crecimiento del hongo, incluso cuando se cultivan en medios mínimos o basales como el AA (Francisco et al., 2006).
En contraste, la germinación de los conidios en el medio AA suplementado con benomil en las dos dosis, causó una disminución significativa en el número de conidios que germinaron y, esta reducción fue directamente proporcional a la concentración de benomil suplementada al medio. A medida que se incrementó la concentración de benomil se observó una disminución del 10 % y 17 % en el número de conidios germinados a las 18 y 24 h de incubación, respectivamente (Tabla 2). A diferencia de lo que se observó con Th003, el tiempo de lectura evidenció un efecto significativo sobre el número de conidios germinados a las 18 y a las 24 h, en el medio AA suplementado con benomil ajustado a 0,003 % y 0,0005 %, respectivamente. Este resultado evidenció el efecto negativo que ejerce la adición de benomil en ambas concentraciones en el medio AA y valida la influencia que tienen las sustancias sincronizadoras sobre la viabilidad de los conidios (Francisco et al., 2006; Meirelles et al. 2023).
Tabla 2 Germinación (%) de conidios de cepas élite de hongos evaluadas en condiciones de medios de cultivo con o suplementados con benomil y tiempo de incubación. / Germination (%) of conidia of elite fungal strains evaluated in culture media with or supplemented with benomyl and incubation time.
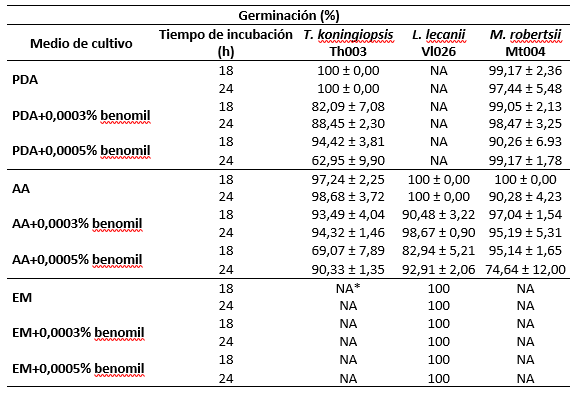
*NA: No se evaluó la germinación en este medio de cultivo. / NA: Germination was not evaluated in this culture medium.
Para el hongo M. robertsii (Mt004), la germinación en AA en los dos tiempos de lectura (18 y 24 h) fue igual a 100 % (Tabla 2). Sin embargo, se evidenció que el tubo germinal era de un tamaño mayor a dos veces el conidio y en algunos campos de observación se presentó la formación de hifas. Cuando el AA se suplementó con benomil al 0,0003 % a las 18 h de incubación se obtuvo una germinación del 97,0 % y de 95,19 % a las 24 h de incubación, valores que no presentaron diferencias significativas entre sí (F5,95 = 9,50; p = 0,0027). En AA con 0,0005 % de benomil se presentaron valores de 95,14 % a las 18 h y a las 24 h de incubación la germinación disminuyó hasta el 73,88 %. En este medio de cultivo, se observó a las 18 h un tamaño de conidio adecuado, sin embargo, después de las 24 h de incubación, los conidios presentaron algún tipo de deformación. Lo anterior, posiblemente se debe a que la concentración de 0,0005 % de benomil generó un efecto fungicida, más no fungistático en comparación con la concentración de 0,0003 %. Es necesario tener en cuenta, que el modo de acción de este producto es inhibir las etapas de la división celular mitótica, lo que conduce a la formación normal del tubo germinal, pero previene el desarrollo posterior de las hifas y, en consecuencia, el crecimiento excesivo de los hongos en medios de agar nutritivos, pero en concentraciones altas genera deformación y posteriormente la muerte del conidio (Oliveira et al., 2015).
M. robertsii en agar PDA presentó un comportamiento homogéneo en los tres medios de cultivo evaluados, con porcentajes de germinación superiores al 90,52 % (Tabla 2). En PDA sin suplementar la germinación fue mayor al 97 %, pero los conidios presentaron una germinación en donde se desarrolló la hifa y por lo tanto el proceso de recuento no era el adecuado, dado que se presentó solapamiento entre los tubos germinados (Santos Díaz et al., 2022). En PDA con benomil al 0,0003 % se evidenció un tamaño de tubo germinal adecuado en los dos tiempos de lectura (18 y 24 h); además la morfología de los conidios no se afectó permitiendo un recuento adecuado con germinaciones superiores al 98,47 %. En PDA suplementado con 0,0005 %, la germinación aumentó a medida que aumentaba el tiempo de incubación, dado que a las 18 h se obtuvo una germinación del 90,52 %, valor que aumentó a 99,17 % a las 24 h de incubación. Este medio de cultivo ha sido ampliamente reportado como adecuado para la evaluación de la viabilidad de cepas de M. robertsii (Afifah et al., 2020; Rangel et al., 2005; Santos Díaz et al., 2022), ya que el hongo asimila de forma fácil las fuentes de carbono del medio al ser compatible con este ingrediente activo (Yáñez y France, 2010).
En la Tabla 1 se presenta la matriz de decisión, en la cual los criterios de evaluación seleccionados fueron la formación del tubo germinal (específicamente el tamaño del tubo germinal) y la morfología de los conidios. Para las cepas T. koningiopsis Th003 y L. lecanii Vl026 se seleccionó el AA suplementado con benomil al 0,0003 %, ya que se obtuvieron porcentajes de germinación sincrónicos superiores al 98 % y la formación del tubo germinal fue de un tamaño adecuado para la lectura (igual o mayor al conidio). En el caso de la cepa M. robertsii Mt004 el medio de cultivo seleccionado fue PDA suplementado con 0,0003 % de benomil (Tabla 3).
Tabla 3 Matriz de decisión para selección de medios de cultivo y condiciones para la evaluación de germinación de las cepas élite. / Decision matrix for the selection of culture media and germination conditions for elite strains.
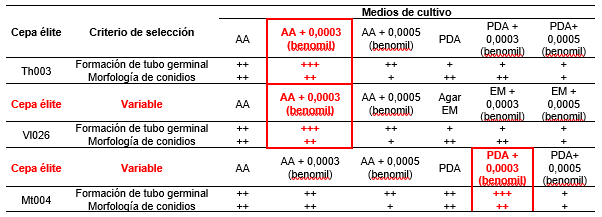
Para la selección del tiempo de lectura, se realizó una comparación de medias de Kruskal Wallis al 95 %, en donde para Th003 no se encontraron diferencias significativas (p > 0,000) por lo que el tiempo de lectura seleccionado fue de 18 h. Para la cepa Vl026 la germinación a las 24 h fue significativamente superior en comparación con la obtenida a 18 h, por lo que se seleccionó el mayor tiempo de incubación. Para la cepa M. anisopliae Mt004 el medio de cultivo seleccionado no se presentaron diferencias significativas entre los tiempos de evaluación, por lo que se seleccionó las 18 h de incubación para la lectura adecuada (Figura 1).
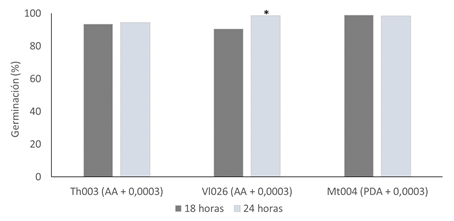
Figura 1 Comparación de tiempos de lectura (18 y 24 h) para el medio de cultivo seleccionado para las cepas élite T. koningiopsis Th003, L. lecanii Vl026 y M. robertsii Mt004. * indica que hay diferencias significativas, según prueba de Kruskal Wallis (α = 0,05). / Comparison of incubation times (18 and 24 h) for the selected culture medium for the elite strains T. koningiopsis Th003, L. lecanii Vl026, and M. robertsii Mt004. * indicates significant differences, according to Kruskal Wallis test (α = 0.05).
4. Conclusiones
La selección del medio de cultivo, tiempo de incubación y concentración de sustancia sincronizadora de germinación para los diferentes géneros de hongos con potencial como agentes biocontroladores constituye una estrategia esencial para garantizar una evaluación fiable de la germinación conidios, asegurando así la consistencia y efectividad de los resultados obtenidos.
El uso de medio AA suplementado con 0,0003 % de benomil favoreció la germinación sincrónica de los conidios de T. koningiopsis (Th003) y L. lecanii (Lv026) desde las 18 h de evaluación.
La germinación sincrónica de los conidios de M. robertsii (Mt004) se logró empleando en medio PDA suplementado con 0,0003 % de benomil.
La adición de benomil ajustado a 0,0005 % en AA y PDA causó anomalías durante la elongación del tubo germinal, lo que sugiere el uso adecuado de una dosis de 0,0003 % para la evaluación de germinación de conidios de hongos élite.

















