1 Introducción
El maíz harinoso (Zea mays L. var. Amylacea) es uno de los cultivos más importantes de la sierra ecuatoriana, debido a la gran cantidad de superficie que se destina a su producción y a su papel en la dieta básica de la población (Yánez y col., 2013). Anualmente se cultivan alrededor de 62 581 ha de este cereal, duplicando la superficie sembrada con otros cultivos importantes en la sierra como la papa, el fríjol, el trigo y la cebada (Encuesta de Superficies y Producción Agropecuarias Continua) (ESPAC, 2018). Lamentablemente, el rendimiento de este tipo de maíz alcanza hasta 0,93 t ha−1 para el grano seco, y 3,75 t ha−1 para el maíz fresco, colocando al Ecuador entre los niveles de productividad más bajos de maíz harinero en Sudamérica (Boada y Espinosa,
2016).
El maíz harinoso normalmente se siembra en pequeños lotes de hasta una hectárea, y una gran proporción de estos lotes se encuentran en suelos pobres que incluyen zonas de ladera, con suelos expuestos a la erosión y sin instalaciones de riego. Además, la mayoría de los agricultores utilizan semillas no certificadas y variedades autóctonas no mejoradas. Todos estos y otros factores socioeconómicos hacen que el rendimiento del maíz sea muy bajo, lo que limita el poder adquisitivo de los agricultores y restringe el uso de insumos, como los fertilizantes.
El rendimiento del maíz está estrechamente relacionado con la disponibilidad de nutrientes del suelo. Para el maíz cultivado en el altiplano se recomienda aplicar 80 kg ha−1 de nitrógeno y 40 kg ha−1 de fósforo en suelos de mediana fertilidad (Yánez y col., 2013). Después del nitrógeno, el fósforo es uno de los elementos más importantes en las primeras etapas del desarrollo de la planta, y una deficiencia de estos elementos en el cultivo puede provocar un crecimiento lento, poco desarrollo del sistema radicular y por lo tanto un bajo rendimiento de la cosecha (Guzmán, 2012). Las bacterias promotoras del crecimiento vegetal (PGPB) facilitan el crecimiento de las plantas, aportando nitrógeno o fósforo fijado, e inducen la producción de fitohormonas durante la colonización de las raíces. Estas fitohormonas producen cambios fisiológicos en la planta que favorecen una mayor absorción de nutrientes, promueven el crecimiento y aumentan la producción (Glick, 2012; Santoyo y col., 2016).
Actualmente es necesario investigar la microbiota del suelo para obtener estrategias para mejorar la productividad agrícola. Una de estas estrategias es la aplicación de bioinoculantes con microorganismos que una vez aplicados al suelo o a la semilla generan un impacto positivo en la nutrición y en el rendimiento de las plantas (Glick, 2012; Díaz-Blanco y Márquez-Reina, 2011). El uso de bioinoculantes elaborados a partir de microorganismos benéficos, como Azospirillum sp. y Pseudomonas fluorescens, que viven asociados o en simbiosis con las raíces del maíz, puede contribuir a la fijación de nitrógeno, solubilización de fósforo y fertilidad natural del suelo, proporcionando un efecto agrobiológico positivo que constituye una alternativa importante para la reducción o sustitución parcial de los fertilizantes minerales (Grageda y col., 2012; Pereira y col., 2020).
El estudio y manejo de los microorganismos benéficos ha ido incrementando. La producción y comercialización de bioinoculantes tiene como objetivo fortalecer un sistema de producción sostenible con un equilibrio ecológico del suelo (Ruiz, 2015; Urrutia, 2019). Varios estudios han demostrado los beneficios del uso de bioinoculantes o biofertilizantes en maíz dentado y flint en tierras bajas, incrementando el rendimiento y la rentabilidad para los agricultores, pero los reportes acerca del maíz harinoso en tierras altas son escasos. En México, García, Mendoza-Herrera y Mayek-Pérez (2012) mostraron que la inoculación con A. brasilense aumentó el rendimiento del grano en comparación con el control no fertilizado y no inoculado, aumentando el coste/beneficio en un 56% aproximadamente. Posteriormente, Martínez-Reyes y col. (2018) reportaron que el uso de un biofertilizante con A. brasilense incrementó el rendimiento de grano hasta en un 28,0% (1,67 t ha−1) con respecto al control absoluto, logrando un mayor beneficio neto que el uso de la fertilización química convencional. En Brasil, Pereira y col. (2020) reportaron que el uso de bioinoculantes incrementó el rendimiento de grano hasta un 39,5 y 34,7% cuando la semilla de maíz se inoculó con Bacillus subtillis y A. brasilense, respectivamente.
El Instituto Nacional de Investigaciones Agropecuarias-INIAP cuenta con una colección de cepas de Azospirillum sp. y P. fluorescens aisladas de la rizosfera de plantas de maíz, recolectadas a lo largo de la sierra ecuatoriana. Estas cepas han sido caracterizadas y evaluadas, y como resultados la cepa C2 de Azospirillum sp. y la cepa nI5 de P. fluorescens con una concentración de 1×109 ufc mL−1 han mostrado los mejores resultados en estudios preliminares (Rivadeneira, 2012; Pincay, 2014; Sangoquiza, Yánez y Borges, 2019). Los objetivos de esta investigación fueron evaluar el efecto de estas cepas nativas andinas en la producción de maíz harinoso fresco (“elotes” o “choclos”) y estimar el coste/beneficio de la inoculación.
2 Materiales y Métodos
2.1 Área de estudio
El experimento se llevó a cabo en un campo de producción comercial de maíz ubicado en la provincia de Pichincha, Ecuador, en la parroquia de Amaguaña (0◦23’9.87” S y 78◦30’3.4” O), a una altura de 2 675 msnm, durante el ciclo 2017-2018. La temperatura media de Amaguaña es de 17◦C con una precipitación media de 960 mm (Bastidas, 2016).
2.2 Cepas bacterianas y bioinoculante
El inóculo se desarrolló a partir de la cepa liofilizada C2 de Azospirillum sp., aislada de ’Laguacoto’, parroquia Veintimilla, cantón Guaranda, provincia de Bolívar, y la cepa nl5 de P. fluorescens aislada de ’Tunibamba’ de la parroquia ’El Sagrario’ cantón Cotacachi, provincia de Imbabura. Las cepas fueron recolectadas de la rizosfera de plantas de maíz cultivadas en la sierra de Ecuador (Carrera, 2012; Pincay, 2014). Las cepas se conservan en el laboratorio del Programa de Maíz de la Estación Experimental Santa Catalina del INIAP. El inóculo y la inoculación de las semillas se realizaron según lo reportado por Sangoquiza, Yánez y Borges (2019). Brevemente, se colocaron 1000 µL de peptona al 1% en los tubos Eppendorf, agitando hasta homogeneizar la mezcla con la ayuda del vortex. Posteriormente, se tomaron 50 µL del inóculo y se colocaron en placas de Petri con el medio de cultivo rojo Congo de ácido málico sólido para el caso de Azospirillum sp. y King B para P. fluorescens. Posteriormente, el inóculo se colocó en una incubadora a 30◦C durante 7 días. Transcurrido este tiempo, se tomaron secciones puras de las bacterias y se colocaron en placas de Petri con los medios de crecimiento específicos.
El bioinoculante se realizó en un soporte líquido con 2% de melaza con agua destilada estéril, pH 7, a una concentración bacteriana de 1×109 ufc mL−1. En 300 mL de la solución de bioinoculante, 280 mL correspondieron al soporte líquido y 20 mL a las bacterias (10 mL de Azospirillum sp. y 10 mL de P. fluorescens). La concentración de bacterias se midió con un espectrofotómetro (Thermo Scientific, GENESYS), y se obtuvo al alcanzar el valor de 1 en la absorbancia, lo que se confirmó mediante pruebas de crecimiento por dispersión en una placa. El recuento de ufc se realizó mediante diluciones seriadas. El bioinoculante se aplicó directamente a la semilla en el momento de la siembra, tal y como indican Yánez, Clavijo y Cool Zambrano (2010). Brevemente, se colocaron 420 semillas de maíz en un recipiente de plástico con una capacidad de 5 L. Luego, se aplicaron 200 mL del bioinoculante a la semilla, mezclándolo uniformemente para asegurar el contacto con la superficie de la semilla. Tras la inoculación, la semilla se dejó reposar a la sombra durante una hora, antes de utilizarla para la siembra.
La prueba de viabilidad de las bacterias se realizó con los 100 mL restantes del bioinoculante. La evaluación de la viabilidad se realizó tomando una muestra del bioinoculante en la que se hicieron diluciones seriadas, tomando 0,1 mL de cada dilución y sembrando en placas de Petri con el medio de cultivo específico para cada bacteria. Estas se incubaron a 30◦C durante 7 días. La presencia de bacterias se determinó por recuento en placa.
2.3 Diseño experimental
La siembra se realizó en un suelo franco arenoso al inicio de la temporada de lluvias en el mes de noviembre, con la variedad de maíz harinoso INIAP101 (Caviedes, 2013). Los tratamientos correspondieron a: T1 (Azospirillum sp; 1×109 ufc mL−1), T2 (P. fluorescens; 1×109 ufc mL−1), T3 (Azospirillum sp. y P. fluorescens; 1×109 ufc mL−1), T4 (control, fertilización química convencional) y T5 (control absoluto). La fertilización química se aplicó únicamente en las parcelas correspondientes al tratamiento T4. La fertilización en base a los resultados del análisis de suelo (Tabla 1) fue de 57 kg de N ha−1, 57 kg de P 2 O 5 ha−1, 10 kg K 2 O ha−1, 25 kg S ha−1, y 10 kg de Mg ha−1, distribuyendo equitativamente el nitrógeno entre la siembra y la cuesta, que se realizó 45 días después de la siembra. Los demás nutrientes se aplicaron en el momento de la siembra. El tamaño de cada parcela fue de cuatro surcos de 5,00 m de largo y 3,20 m de ancho, con 80 plantas en cada parcela. La distancia de plantación fue de 0,80 m entre hileras y 0,25 m entre plantas, con una densidad de 50 000 plantas ha−1. El contenido nutricional del suelo donde se plantó el experimento que se analizó en el Departamento de Suelos de la Estación Experimental Santa Catalina, se presenta en la Tabla 1.
Tabla 1 Valores nutricionales del suelo de Amaguaña donde se evaluó el efecto de la inoculación de Azospirillum y Pseudomonas en maíz harinoso.

Las prácticas agronómicas del cultivo se realizaron siguiendo las recomendaciones dadas a los pequeños agricultores (Yánez y col., 2013). En resumen, se realizó un pase de arado y un pase de rastra para incorporar los restos del cultivo anterior (maíz). Durante el desarrollo del cultivo se eliminaron manualmente las malezas y se controlaron las plagas de insectos con dos aplicaciones de insecticidas (Cipermetrina y Clorpirifos) a los 60 y 120 días, con a dosis de 1 L ha−1. El cultivo se cosechó y evaluó en estado fresco (maíz fresco), en el estado de crecimiento R3 (estado lechoso), a los 150 días de la siembra (Yánez y col., 2013).
2.4 Variables evaluadas
La evaluación agronómica se llevó a cabo en la cosecha, según los procedimientos del Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT) para ensayos internacionales (CIMMYT, 1999). A continuación se detalla la evaluación de las variables:
Altura de la planta: se midió la longitud desde la base de la planta hasta el punto en que
la panícula comienza a dividirse, en diez plantas seleccionadas al azar en los surcos centrales de cada parcela. Esta variable se registró en m utilizando un medidor de altura en la cosecha.
Longitud de la raíz: se tomaron 10 plantas al azar de los surcos centrales de la parcela en el momento de la cosecha. Se separó la parte aérea de las plantas y se midió la longitud de la raíz desde la base de la planta hasta la punta de la raíz más larga con la ayuda de un metro. Esto se midió en cm.
Longituddelamazorca: se midieron diez mazorcas con brácteas tomadas al azar en los surcos centrales de cada parcela desde la base hasta la punta de la mazorca con la ayuda de una cinta métrica. Se midió en cm.
Diámetro de la mazorca: se midió con un calibre el punto central de 10 mazorcas elegidas al azar de los surcos centrales con brácteas de cada tratamiento, los datos se expresaron en cm.
Rendimiento: se cosecharon mazorcas con brácteas, aptas para el consumo en fresco en la etapa R2-3 (“elote”, “choclo”), de los dos surcos centrales (40 plantas) de cada parcela experimental. El rendimiento de maíz fresco se registró en kg, pero los datos se muestran como t ha−1.
Índice de efectividad de la inoculación (IEI): se calculó en porcentaje utilizando la Ecuación 1 (Escobar y col., 2011).
Coste/beneficio: se estimó a partir de los ingresos por la venta del maíz fresco cosechado y el coste de producción (insumos, mano de obra, preparación del suelo y costes indirectos) de cada tratamiento. El ingreso bruto (USD ha−1) se estimó multiplicando el rendimiento de maíz fresco (t ha−1) por su valor comercial (USD t−1). El beneficio neto por hectárea se estimó por la diferencia entre el ingreso bruto en dólares y el coste de producción. El coste por cada dólar obtenido (CU) se calculó dividiendo el coste de producción (USD ha−1) por el ingreso bruto (USD ha−1), y la relación coste-beneficio (C/B) se estimó dividiendo el beneficio neto (USD ha−1) por el coste de producción (USD ha−1).
2.5 Análisis estadístico
Se utilizó un diseño de bloques completamente al azar con seis repeticiones para evaluar el efecto de tres bioinoculantes (T1, T2 y T3) y dos controles (T5 y T6). Los resultados se sometieron a una prueba de normalidad modificada de Shapiro-Wilks, y a continuación se realizó un análisis de la varianza y una prueba de comparación múltiple de Tukey (p < 0,05) para todos los rasgos agronómicos. Para el análisis se utilizó el programa estadístico INFOSTAT.
3 Resultados
La Tabla 2 muestra los resultados de los rasgos agronómicos evaluados en los diferentes tratamientos. Se observaron diferencias estadísticas significativas (p < 0,05) entre los tratamientos para todas las características. El control absoluto, como era de esperar, mostró los valores más bajos y la clasificación más baja de la prueba de Tukey, lo que significa el peor rendimiento agronómico. El uso de la fertilización química convencional (T4) mostró la mayor altura de la planta con 2,44 m, y aunque no se diferenció estadísticamente de los tratamientos inoculados (T1, T2 y T3), sí lo hizo del testigo absoluto (T5), que obtuvo las plantas más cortas con 2,20 m.
El rendimiento de maíz fresco obtenido con el uso de bioinoculantes (T1, T2 y T3) no difirió estadísticamente del rendimiento obtenido con la fertilización química (T4), según la prueba de Tukey (p < 0,05). Esto fue consistente con el rendimiento observado en la altura de la planta, la longitud de la mazorca y la longitud de la raíz. El IEI de la inoculación con Azospirillum sp. y P. fluorescens (T3) fue de 46,58%, casi el doble que cuando se realizó solamente con la bacteria (T1 o T2) (Tabla 2). El uso del bioinoculante con ambos aislados (T3, Azospirillum sp. y P. fluorescens) mostró el mejor rendimiento agronómico para el diámetro de la mazorca, el rendimiento y el IEI (Tabla 2). No hubo diferencias significativas (p > 0,05) entre el T3 y el control de fertilización química convencional (T4) para ninguno de las características evaluados, excepto para el diámetro de la mazorca, donde T3 obtuvo mazorcas más gruesas que T4, con 21,47 cm y 20,13 cm, respectivamente.
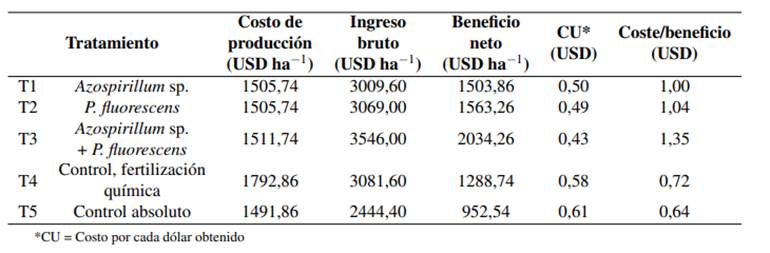
La evaluación económica mostró el coste/beneficio de la aplicación de estos bioinoculantes en el maíz harinoso (Tabla 3). La inoculación de las semillas realizada con el biofertilizante combinado T3 (Azospirillum sp. y P. fluorescens) obtuvo el mayor beneficio neto 3546,00 USD ha−1, y la mayor relación C/B 1,35. Aunque el coste de producción del bioinoculante combinado (T3) fue mayor que el de los bioinoculantes con un solo aislado (T1 y T2), el ingreso bruto de T3 fue mayor debido al incremento de rendimiento obtenido al inocular con ambos aislados (Tabla 2).
4.1 Efecto de la aplicación de bioinoculantes en las características agronómicas del maíz
El uso de bioinoculantes con Azospirillum sp. y P. fluorescens en maíz de harina fresca mostró el mismo rendimiento agronómico que el uso de la fertilización química convencional (Tabla 2). Los resultados obtenidos en este estudio podrían atribuirse a que estas bacterias tienen la capacidad de fijar nitrógeno, solubilizar fósforo y producir compuestos que estimulan el crecimiento vegetal (Aguirre y Espinosa Moreno, 2016; Rueda y col., 2016). Estas bacterias promovieron el crecimiento y desarrollo de las plantas de maíz harinoso, mostrando raíces más largas, plantas más altas y mazorcas más gruesas que el control absoluto (T5). Los cereales inoculados con estas bacterias han mostrado una mayor capacidad de absorción eficiente de agua y nutrientes del suelo (Sala y col., 2005; Oliveira y col., 2018; Pereira y col., 2020).
Los bioinoculantes basados en cepas de Azospirillum y Pseudomonas tienen una alta capacidad de producir ácido indolacético (AIA) provocando el desarrollo de las raíces y la elongación celular. Existen estudios que muestran la influencia de Azospirillum en la formación de raíces laterales debido a la secreción de nitritos (Camelo, Vera y Bonilla, 2011; Bécquer y col., 2012). La producción de AIA y la alta sensibilidad de las raíces a esta hormona son fundamentales para la respuesta a la inoculación de Azospirillum y Pseudomonas, donde frecuentemente se observa un mayor desarrollo radical, lo que se traduce en una mayor superficie de absorción de nutrientes, y, por tanto, un mayor desarrollo de la parte aérea de la planta (García y col., 2007).
El maíz harinoso INIAP 101 mostró un incremento en la altura de la planta, la longitud de la mazorca y el diámetro de las plantas inoculadas, en comparación con el control absoluto (Tabla 2). Estos resultados concuerdan con Piscoya y Ugaz (2016), quienes señalaron que las especies de Azospirillum presentaron un incremento en la altura, número de hojas y diámetro de tallos en el cultivo de maíz duro, mientras que Piromyou y col. (2011) demostraron la acción benéfica de la inoculación individual y mixta de microorganismos benéficos en el cultivo de maíz dentado, al mejorar su funcionamiento radical en la absorción del nitrógeno e invadir externamente la raíz del maíz, favoreciéndolo con la síntesis de sustancias promotoras del crecimiento vegetal.
La cepa C2 de Azospirillum sp. y la cepa nl5 de P. fluorescens utilizadas en este estudio han demostrado su capacidad de promover la absorción de nitrógeno y fósforo. Sangoquiza, Yánez y Borges (2019) reportaron un mayor porcentaje de acumulación de nitrógeno y fósforo en el tejido de las hojas de las plantas INIAP-101 inoculadas con estos aislamientos. Estudios similares sobre el efecto de Azospirillum sp. mostraron un mayor porcentaje de nitrógeno en el tejido foliar del maíz (Ortíz, 2010), mientras que la inoculación de A. brasilense y P. fluorescens aumentó el contenido de fósforo total en 187 kg ha−1 (Faggioli y col., 2003).
Tabla 3 Evaluación económica de la aplicación de bioinoculantes en el maíz harinoso INIAP 101 en la sierra del Ecuador.
4.2 Índice de efectividad de la inoculación (IEI) de los bioinoculantes
Para el IEI, el tratamiento T3 mostró diferencias estadísticamente significativas con los tratamientos T1 y T2 según la prueba de Tukey (p < 0,05) (Tabla 2). Estos resultados indicaron que la combinación de Azospirillum y P. fluorescens favoreció el rendimiento del maíz, lo que sugiere una simbiosis asociativa que puede mejorar la morfología y fisiología de las raíces, logrando un mejor aprovechamiento del agua y de nutrientes como el nitrógeno y el fósforo, generando una mejor calidad y desarrollo del grano (Gálvez, Magallón y Torres, 2014). Martins y col. (2018) señalaron que los efectos de estos microorganismos en el desarrollo de las plantas han favorecido el rendimiento de diversos cultivos cuando se aplican solos o en combinación, logrando una mayor colonización y aumentando la producción. Una revisión más detallada de los beneficios de los biofertilizantes fue publicada recientemente por Zambrano-Mendoza y col. (2021).
4.3 Evaluación económica del uso de los bioinoculantes
El análisis de los parámetros económicos mostró la ventaja de aplicar estos bioinoculantes al promover un buen desarrollo de las plantas inoculadas y un mayor rendimiento económico (Tabla 3). El mayor coste de producción se obtuvo con el T4 (control de fertilización química convencional), mientras que el menor coste de producción se obtuvo con el T5 (control absoluto), donde no se aplicó ninguna fertilización ni bioinoculante. La principal diferencia entre los costos de producción de cada tratamiento se debió al valor del fertilizante químico y el coste de su aplicación. En relación con la recomendación química convencional (T4), el uso del bioinoculante T3 (Azospirillum y P. fluorescens) permitió un ahorro de 281,12 USD ha−1, lo que representa una disminución de aproximadamente 16% en el costo de producción, sin afectar significativamente el rendimiento (Tabla 2). Esto demuestra que es posible sustituir el uso de fertilizantes químicos por bioinoculantes sin afectar la producción de maíz, abriendo la oportunidad a sistemas de producción más sustentables y amigables con el medio ambiente.
Muchos productores de maíz de la sierra no utilizan fertilizantes químicos, asemejándose al tratamiento T5 (control absoluto). Con el uso de Azospirillum y P. fluorescens, los agricultores pueden duplicar su beneficio neto de 952,54 USD ha−1 a 2034,26 USD ha−1 con una inversión adicional de aproximadamente 20,0 USD ha−1 (Tabla 3). Otros estudios llevados a cabo en diversas condiciones ambientales podrían aclarar esta posibilidad.
El C/B de la producción de maíz fresco utilizando el bioinoculante T3 (Azospirillum y P. fluorescens) aumentó en un 87,5% en relación con la fertilización química convencional (T4) (Tabla 3). Este valor es superior al incremento de 56,0% reportado por García, Mendoza-Herrera y Mayek-Pérez (2012), y al incremento de 36,0% reportado por García y col. (2007), cuando evaluaron el efecto de la aplicación de A. brasilense en maíz dentado en el norte de México. En términos económicos, estos resultados mostraron que la inoculación con bacterias promotoras del crecimiento vegetal (Azospirillum sp. y P. fluorescens) incrementó el beneficio neto y la relación C/B del cultivo de maíz; por lo tanto, el uso de estos bioinoculantes podría generar una tecnología económicamente viable para la producción de maíz harinoso en la Región Andina.
5 Conclusiones
La inoculación con Azospirillum sp. mejoró el rendimiento de maíz fresco (“choclo”), aumentó el desarrollo de la raíz, y el diámetro y la longitud de la mazorca en comparación con el testigo. La inoculación con P. fluorescens mostró un mayor rendimiento y diámetro de la mazorca en comparación al control. La combinación entre Azospirillum sp. y P. fluorescens aumentó significativamente el rendimiento de maíz fresco en un 46,58% con relación al control sin fertilización. El rendimiento de las plantas tratadas con fertilizante químico fue similar al obtenido con las plantas inoculadas con estos microorganismos. La combinación de Azospirillum sp. y P. fluorescens produjo la mayor ganancia neta y relación C/B, aumentando en un 87,5% el C/B de la fertilización química convencional.
Azospirillum sp. y P. fluorescens redujeron el uso de fertilizantes sintéticos en aproximadamente un 50%, reduciendo el coste de producción. Esto demostró que es factible sustituir el uso de fertilizantes sintéticos por biofertilizantes, abriendo la posibilidad de un sistema de producción de maíz sostenible y respetuoso con el medio ambiente en la sierra ecuatoriana.

















