Introducción
La definición de un endófito sigue siendo un tema debatible hoy en día. Se dice que las bacterias que se aíslan de los tejidos internos de la planta y que no causan ningún daño a su huésped se clasifican como endófitas. Otras descripciones indican que la ocupación bacteriana ocurre en los tejidos internos de la planta. El altruismo, el comensalismo, la simbiosis o la pasividad a la patogenicidad se han utilizado para describir esta interacción endófita única del huésped; por lo tanto, en las relaciones específicas involucradas, la colonización interna de las plantas por bacterias constituye un nicho ecológico vasto y, sin embargo, poco investigado (Kobayashi y Palumbo, 2000; Hallmann y col., 1997). La diversidad bacteriana que se ha descrito como endófitos abarca una variedad de importantes bacterias Gram negativas y Gram positivas que contienen géneros de alfa, beta y gamma-proteobacterias, bacteroidetes, actinobacterias y firmicutes (Bacon e Hinton, 2007; Lodewyckx y col., 2002).
Casi 1250 especies de Senecio están ampliamente distribuidas y comprenden unas 6 especies que se encuentran en Egipto, entre ellas S. glaucus, S. flavus, S. aegyptius, S. Vulgaris, S. hoggariensis y S. belbeysius. Este género es importante por sus propiedades farmacológicas, botánicas y toxicológicas (Singh, Satish y Manisha, 2017; Nori-Shargh, Raftari y Deyhimi, 2008). Un estudio sobre el examen fitoquímico de los extractos de Senecio reveló propiedades antioxidantes, antimicrobianas, citotóxicas (Tundis y col., 2009), antiinflamatorias, insecticidas y antivirales (Sultan, Elsayed y El-Amir, 2022; El- Amier, Abdelghany y Abed Zaid, 2014; Joshi, Sah y Mishra, 2013; Kahriman y col., 2011).
Las especies de Senecio que habitan en las llanuras arenosas y en las cuevas del desierto se utilizan como sedante del sistema nervioso central, diurético y emético en Egipto (Eissa y col., 2014). Senecio glaucus L. (Morrar) es una hierba anual que crece en Egipto y tiene dos subespecies S. glaucus subsp. coronopifloius (Maire) C. Alexander. Subsp. Coronopifloius y S. glaucus L. subsp. glaucus que crecen en áreas desérticas, suelos salinos, arenas costeras y bordes de cultivo y en Egipto el más común es subsp. glaucus Boulos2002. Los endófitos pueden beneficiar a las plantas indirectamente al mejorar las infecciones del herbívoro o la resistencia al estrés, o por otros procesos que aún no se conocen (Schulz y Boyle, 2005). En varios estudios se ha encontrado que los endófitos pueden proteger a sus huéspedes de la sequía (Clay y Schardl, 2002).
Según Waller y col. (2005), las plantas infectadas con endófitos mostraron tolerancia a la sal y a la temperatura. Los endófitos actúan como desencadenantes biológicos para estimular la respuesta al estrés de forma más rápida que las plantas no simbióticas, promoviendo el crecimiento de las plantas y protegiéndolas para reducir enfermedades de insectos y plagas, según Redman y col. (2002).
Las bacterias endófitas pueden solubilizar el fosfato y proporcionar nitrógeno asimilable a las plantas (Rosenblueth y Martínez-Romero, 2006). Además, las interacciones entre plantas y bacterias endófitas pueden ayudar en los procesos de restauración de ecosistemas, protegiendo a las plantas del estrés biótico y abiótico y promoviendo la producción de metabolitos secundarios importantes (Mowafy y col., 2021; Cheng y col., 2019; Müller y col., 2015; Alavi y col., 2013).
El trasfondo genético de las especies de hospederos vegetales, la idoneidad, los nutrientes y los nichos ecológicos (Jia y col., 2016), las circunstancias ambientales, los genotipos de los hospederos, las especies bacterianas (Chebotar y col., 2015), y la etapa de desarrollo del hospedero y la densidad del inóculo (Dudeja y Giri, 2014), tienen un impacto significativo en la población de bacterias endófitas.
Se descubrieron algunas bacterias resistentes al frío en las raíces y las hojas de Senecio vulgaris y se definieron como unidades taxonómicas operativas bacterianas básicas y se informó de que tenían un fuerte efecto antibacteriano aparente y la capacidad de sobrevivir en ambientes extremadamente bajos, secos y contaminados con rayos UV (Gaspard y Rice, 1989; Koo y col., 2016; Vishnivetskaya, Kathariou y Tiedje, 2009).
Los endófitos son ventajosos para S. vulgaris (Cheng y col., 2019; Singh y col., 2016), y su aplicación al arroz resultó en una reducción de la acumulación de arsénico y la generación de IAA, lo que ayuda en la promoción del crecimiento; la resistencia a metales pesados, particularmente la tolerancia al cadmio; la capacidad de fijación de nitrógeno (Purchase, Miles y Young, 1997); y la promoción del crecimiento de plantas de maíz y lechuga (Gamel y col., 2017; Chabot, Antoun y Cescas, 1996).
Debido a su larga historia de uso en la medicina tradicional y la selección en una variedad de hábitats climáticos, edáficos y bióticos en lugares geográficamente diferentes, S. glaucus presenta una gran diversidad. Se informó de que existen entre 102 y 104 poblaciones de bacterias endófitas por gramo de tejido vegetal (Kobayashi y Palumbo, 2000). Este estudio tiene como objetivo evaluar la variedad de comunidades de endófitos bacterianos aisladosde S. glaucus en dos hábitats diferentes en Egipto: Ciudad Gamasa (costa mediterránea) y Wadi Araba (desierto oriental).
Materiales y Métodos
Recolección del material vegetal
Se tomaron al azar plantas enteras sanas de S. glaucus en las fases de floración de dos localidades separadas: Wadi Araba (Desierto Oriental, 29°4’23.72˝N32°25’38.49˝E) y Ciudad Gamesa (costa mediterránea, 31°26’58.78˝N 31°28’36.14˝E) para el aislamiento de endófitos bacterianos. Las muestras se envasaron en bolsas de plástico limpias y se transportaron al Laboratorio de Microbiología para su posterior análisis, como se muestra en la Figura 1.
Aislamiento y purificación de los endófitos
El aislamiento y purificación de los endófitos se realizó de acuerdo con el procedimiento de Bacon e Hinton (2002) utilizando medio de agar LB (1,25 g de extracto de levadura; 2,5 g de peptona; 2,5 g de cloruro de sodio; 3,75 g de agar y 250 ml de agua destilada). Las muestras de plantas se lavaron primero bajo el agua del grifo y luego se separaron en 4 partes, que incluyen raíz, tallo, hoja y cápsula, y luego se esterilizaron en la superficie (Geris dos Santos y col., 2003).
La esterilización superficial se logró enjuagando las partes de la planta con etanol (C2H5OH) al 70% durante 30 segundos, luego hipoclorito de sodio (NaOCl) al 0,5% durante 2-3 minutos y finalmente agua destilada estéril (Dil.H2O) durante 10 minutos (2-3 veces). Después de esto, se secaron los pliegues del material vegetal usando papeles filtrantes estériles.
Con un bisturí esterilizado en llama se retiraron los extremos cortados de los segmentos esterilizados en la superficie y se colocaron en medios de agar LB apropiados, con la superficie cortada tocando el agar. Las máximas colonias posibles de endófitos bacterianos se determinaron mediante la incubación de placas a 35 °C durante 48 horas.
Caracterización de bacterias endófitas
Caracterización morfológica
Aneja y col. (2006) y Cappuccino y Sherman (1992) utilizaron el procedimiento de tinción de gram estándar para determinar la forma celular, el color de la colonia y la textura y para definir los aislamientos y establecer la morfología de las células bacterianas.
Caracterización bioquímica
Las cepas bacterianas endófitas seleccionadas se caracterizaron bioquímicamente mediante métodos estándar como la prueba de amilasa, la prueba de catalasa, la prueba de lipasa, la prueba de celulasa, la prueba de proteasa, la prueba de nitrato reductasa y la prueba de indol; y se caracterizaron mediante métodos estándar como la prueba de solubilización de fosfato, la prueba de producción de indol, la prueba de producción de ácidos de giberelina y la prueba de producción de sulfuro de hidrógeno (Cappuccino y Sherman, 1992).
Secuenciación del gen 16S rRNA
Las bacterias aisladas se identificaron molecularmente utilizando la metodología MicroSeq® 500 16SrRNA Bacterial Identification Kits. Las reacciones de secuenciación se llevaron a cabo en los termocicladores 9700 con un volumen total de 20 l (producto de PCR purificado de 7 l y módulo de secuenciación de 13 l) ajustando el termociclador a 96 °C durante 10 segundos, 50 °C durante 5 segundos y 60 °C durante 4 segundos (25 ciclos). El kit de centrifugado Dye ExTM 2.0 se utilizó para eliminar el exceso de terminadores de colorantes y cebadores de la reacción de secuenciación del ciclo (Qiagen PN 63204). Para el análisis de las secuencias se utilizó el software Finch TV (versión 1.4.0) y MEGA-X (versión 10.2.5), y el software Seaview para la creación de árboles filogenéticos utilizando las secuencias de los tipos de cepas publicadas más recientemente. Las secuencias de los aislamientos obtenidas en esta investigación fueron sometidas a la base de datos GeneBank del NCBI.
Resultados
En este estudio se aislaron 10 bacterias endófitas de diferentes partes de la planta de Senecio glaucus recolectadas en 2 sitios diferentes (4 aislamientos de la planta costera mediterránea y 6 aislamientos de la planta del desierto) en medio L.B agar bajo condiciones asépticas y de acuerdo con la diferencia morfológicas mostrada en las figuras 2 y 3, y con los códigos (SGC-R, SGC-S, SGC-L, SGC-C) para las muestras costeras y (SGD-R, SGD-S, SGD-L, SGD-C) para las muestras del desierto.
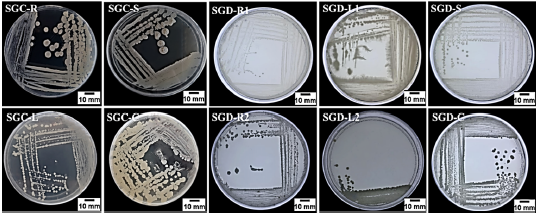
Figura 2 Endófitos bacterianos aislados de S. glaucus SGC-R: Senecio glaucus costera, SGC-S: -tallo, SGC-L: -Hoja y SGC-C: -Capitula; SGD-R: S. glaucus del desierto, SGD-S: -tallo, SGD-L: -Hoja y SGD-C: - Tejido capitulear.
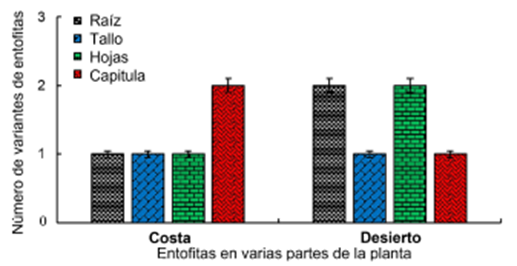
Figura 3 Número de bacterias endófitas aisladas de diferentes tejidos de la planta medicinal S. glaucus recolectadas en hábitats costeros y desérticos.
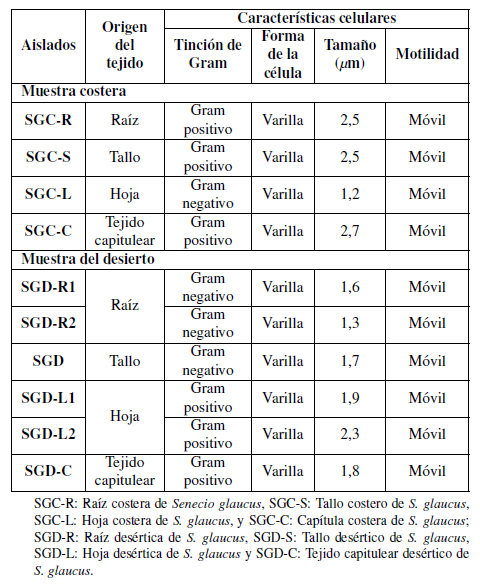
Los aislamientos bacterianos se caracterizaron morfológicamente de acuerdo con la forma de la colonia, margen, elevación, textura y pigmentación como se muestra en la Tabla 1, y se analizaron microscópicamente de acuerdo con la forma de la célula, donde cabe mencionar que todos los aislamientos tuvieron una forma de varilla y coloración de Gram. La muestra costera mostró 3 cepas Gram positivas y 1 cepa Gram negativas; por otra parte, la muestra del desierto mostró 3 cepas Gram positivas y 3 cepas Gram negativas (Tabla 2).
Tabla 1 Características morfológicas de colonias de bacterias endófitas aisladas de diferentes tejidos de la planta medicinal S. glaucus recolectadas en hábitats costeros y desérticos en Egipto.
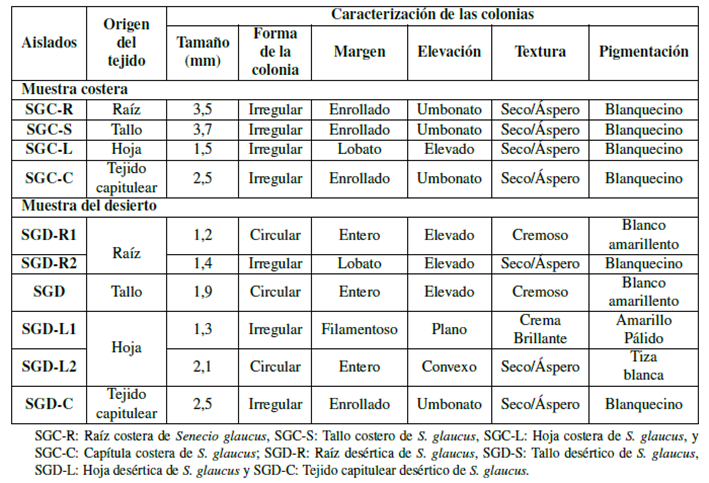
Tabla 2 Características morfológicas de células de bacterias endófitas aisladas de diferentes tejidos de la planta medicinal S. glaucus recolectadas en hábitats costeros y desérticos en Egipto.
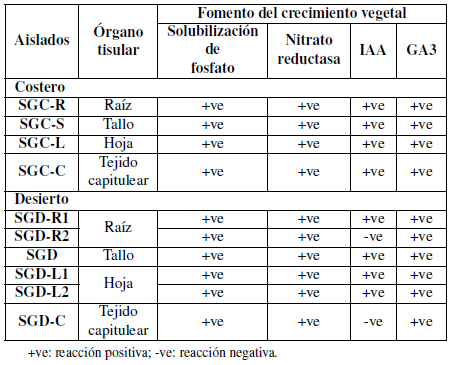
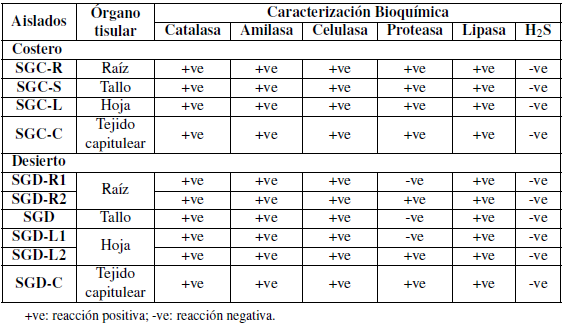
Los aislamientos purificados se caracterizaron bioquímicamente de acuerdo con la actividad enzimática y las propiedades funcionales. Los aislados mostraron una capacidad variada para producir una variedad de enzimas (Tablas 3 y 4).
Tanto los aislamientos bacterianos costeros como los desérticos fueron capaces de producir indol en concentraciones variables que oscilaban entre alta y bajas en comparación con la muestra control.
Los aislados SGC-L y SGC-C presentaron resultados muy débiles, mientras que los aislados SGDL2 y SGD-C no mostraron resultados positivos como se muestra en la Tabla 4.
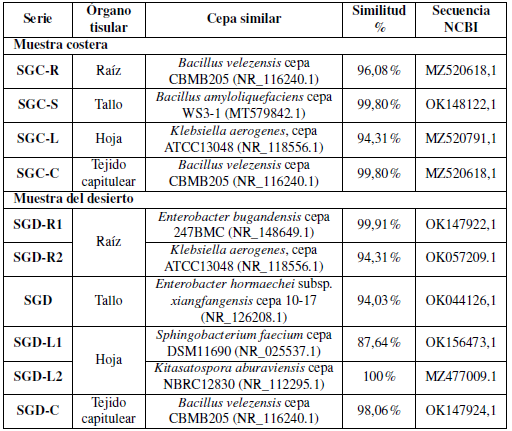
Basándose en el análisis de la secuencia del gen 16S rRNA, las cepas aisladas se identificaron como Bacillus velezensis cepa CBMB205 (NR_116240.1), Bacillus velezensis cepa CBMB205 (NR_116240.1), Bacillus amyloliquefaciens cepa WS3-1 (MT579842.1), cepa ATCC3 048 (NR_118556.1), Enterobacter bugandensis cepa 247BMC (NR_148649.1), Enterobacter hormaechei subsp. xiangfangensis cepa 10- 17 (NR_126208.1), Sphingobacterium faecium cepa DSM11690 (NR_025537.1), y Kitaspora aburaviensis cepa NBRC12830 (NR_112295.1); todas las cepas se correlacionaron en la distancia genética como se muestra en la Tabla 5 y Figura 4.
Tabla 3 Análisis cualitativo de la caracterización bioquímica de las bacterias endófitas aisladas de diferentes tejidos de la planta medicinal S. glaucus recolectadas de diferentes hábitats en Egipto.
Discusión
Desde hace mucho tiempo se sabe que hay endófitos bacterianos en la mayoría de los tejidos sanos de las plantas (McInroy y Kloepper, 1995; Sturz, 1995; Frommel, Nowak y Lazarovits, 1993). Se han encontrado bacterias endófitas en todas las especies de plantas estudiadas, según Partida-Martínez y Heil (2011), así como en este estudio. Se ha encontrado que varias especies de plantas tienen diversas comunidades bacterianas endófitas que mostraron una importante diversidad fenotípica y genotípica (Santoyo y col., 2016; Miliute y col., 2015). El estudio de la diversidad poblacional de endófitos bacterianos aislados de la muestra desértica de S. glaucus mostró mayor diversidad de especies que la muestra costera (Figura 3). La especie hospedera de la planta, la especificidad del hospedero y los tipos de tejido pueden afectar fuertemente el tipo de comunidad endófita (Ding y Melcher, 2016). Las variaciones cualitativas y cuantitativas entre especies vegetales en la colonización microbiana se deben principalmente a la compatibilidad genotípica hospedero-endófita y a las condiciones ecológicas (tropical versus templado) (Rajan, 2012).
Las cepas se aislaron de las raíces, tallos, hojas y tejidos capituléales de S. glaucus. La mayor población de endófitos se obtuvo de los tejidos internos de las raíces y hojas de la planta (Figura 3). La morfología de las colonias indicó la variación de los endófitos. Los aislamientos evaluados fueron elegidos por su variación morfológica y dominancia (Tabla 1). Una gran variedad de bacterias Gram negativas y Gram positivas están involucradas en las bacterias endófitas (Lodewyckx y col., 2002). Curiosamente, los Gram positivos fueron la población más distribuida en la muestra costera que los Gram negativos aislados de S. glaucus. Por otra parte, la población Gram negativa fue igual a la de los aislados Gram positivos de la muestra del desierto (Tabla 2), como se informó en varias plantas; se identificó una presencia igual de bacterias Gram negativas y Gram positivas (Zinniel y col., 2002). Existe un predominio de bacterias gramnegativas en los tejidos de diversas plantas (Elbeltagy y col., 2000; Stoltzfus y col., 1997). Estas especies bacterianas podrían haber coevolucionado con la planta para adaptarse a un hábitat árido específico que es pobre en nutrientes. Como respuesta a las condiciones ambientales como pH, temperatura y salinidad, las bacterias Grampositivas de las cepas aisladas forman esporas, lo que puede proporcionar una ventaja de supervivencia.
Toda la morfología de las células aisladas mostró ser bacilos/varilla (Tabla 2). Según Jacobs, Bugbee y Gabrielson (1985), Erwinia sp., Enterobacter sp., Bacillus sp., Pseudomonas sp., Micrococcus, Microbacterium, Stenotrophomonas, Pantoea, Burkholderia, Pseudomonas y Flavobacterium sp. fueron los géneros bacterianos aislados más comunes de bacterias endófitas en varias plantas como tomate, algodón, soja, arroz y maíz (Chaturvedi, Singh y Gupta, 2016; Hallmann y col., 1997).
Anteriormente se han aislado bacterias endófitas de tejidos de especies de Senecio. Cheng y col. (2019) y Singh y col. (2016) aislaron los endófitos Brevundimonas diminuta y Rhizobium leguminosarum de S. vulgaris; Sphingomonas aerolata, Sphingomonas faeni, Exiguobacterium sibiricum y Oxalobacteraceae (OTU3) y se caracterizaron en hojas y raíces de S. vulgaris (Gaspard y Rice, 1989; Koo y col., 2016; Vishnivetskaya, Kathariou y Tiedje, 2009).
En este estudio, los aislamientos obtenidos se caracterizaron bioquímicamente de acuerdo con la actividad enzimática y las propiedades funcionales (Tabla 3). Los aislados mostraron una variada capacidad para producir una variedad de enzimas tales como enzimas catalasas, enzimas amilolíticas, celulolíticas, proteolíticas y lipolíticas. Sin embargo, no se ha realizado ningún estudio sobre la secreción de estas enzimas por los endófitos (Elbeltagy y col., 2000; Reinhold-Hurek y Hurek, 1998). Las bacterias endófitas pueden actuar como factores de virulencia para bacterias fitopatógenas debido a las celulasas y las enzimas hidrolíticas pueden desempeñar un papel en los mecanismos que entran y persisten en la planta huésped, como se informó para Enterobacter asburiae JM22 Quadt-Hallmann1997 y Azoarcus sp. (Hurek y col., 1994).
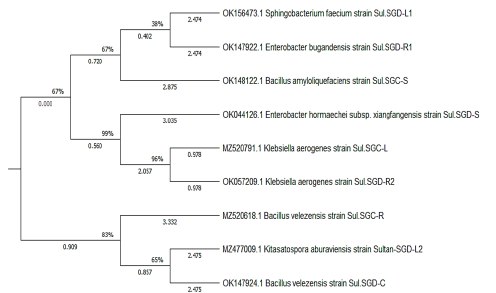
Figura 4 El árbol filogenético se creó de las secuencias del gen 16S rRNA de las 10 cepas bacterianas endófitas.
Las bacterias endófitas aisladas del S. glaucus costero indicaron la mayor producción de las enzimas estudiadas en comparación a los aislados del desierto, a pesar de la alta diversidad en la muestra de S. glaucus del desierto (Figuras 4 y 5). Todos los aislamientos secretaron amilasas, celulasas, proteasa y lipasa, excepto Enterobacter hormaechei subsp. Xiangfangensis y Sphingobacterium faecium que no pudieron producir enzimas proteasas (Tabla 3). La actividad celulósica de estos endófitos puede ser una ventaja para la entrada intercelular y la propagación de los endófitos en la planta huésped, ya que la pared celular de la planta huésped contiene celulosa (Hallmann y col., 1997). Las hidrolasas, enzimas extracelulares producidas por bacterias endófitas ayudan en el establecimiento de resistencia sistémica para la invasión de patógenos en plantas (Singh y col., 2017; Elbeltagy y col., 2000).
Además, todos los aislamientos se caracterizaron bioquímicamente de acuerdo con sus propiedades funcionales (Tabla 4). Los aislados mostraron una variada capacidad para producir una variación de fitohormonas que pueden ayudar a las plantas y pueden ser utilizadas como PGPB ácido indolacético, y ácidos giberélicos, ya que también indicaron su capacidad para solubilizar fosfato y nitrato reductasa. Por otro lado, todos los aislamientos presentaron un resultado negativo para la producción de sulfuro de hidrógeno, así mismo, las cepas SGDR2 y SGD-C aisladas de la muestra desértica fueron negativas para IAA.
Se aislaron 10 cepas con diversas morfologías de colonias y se analizaron sus secuencias del gen 16S rRNA para establecer relaciones taxonómicas (Tabla 5 y Figura 6). No se encontraron bacterias B. japonicum en los aislamientos de S. glaucus esterilizados en superficie, y la mayoría de ellos fueron morfológicamente únicos. De acuerdo con el análisis filogenético, se demostró que los aislados pertenecían a cuatro filos extremadamente diferentes ya conocidos por estar asociados a plantas: bacterioidetes, proteobacterias, actinobacterias y firmicutes (Reinhold-Hurek y col., 2015). Basándose en el análisis de la secuencia del gen 16S rRNA, las cepas aisladas se identificaron como Bacillus velezensis cepa CBMB205 y Bacillus amyloliquefaciens cepa WS3-1 (Clase: Bacilli), Enterobacter bugandensis cepa 247BMC y Enterobacter hormaechei subsp. xiangfangensis cepa 10-17 (Clase: Gamma Proteobacteria), Sphingobacterium faecium cepa DSM 11690 (Clase: Flavobacteria), Klebsiella aerogenes cepa ATCC 13048 (Clase: Gamma Proteobacteria) y Kitasatospora aburaviensis cepa NBRC 12830 (Streptomyces aburaviensis) (Clase: Actinomicetos). El análisis de la secuencia reveló que los aislados pueden contener especies bacterianas previamente desconocidas: las cepas de dos filotipos mostraron una identidad inferior al 98,7%en los genes de ARNr 16S previamente notificados de especies conocidas. Es probable que representen al menos especies únicas, dado que este valor ha sido propuesto recientemente como un “patrón de oro” para distinguir las especies (Stackebrandt, 2006). Todas las cepas se correlacionaron con una distancia genética. El dendrograma filogenético ilustró que la correlación entre seis aislamientos se realizó mediante el programa MEGA-X como se muestra en la Figura 4.
Conclusiones
En conclusión, este estudio confirmó la diversidad y ocurrencia de endófitos bacterianos en diferentes partes de Senecio glaucus (Morrar) recolectados en diferentes hábitats en Egipto. Estas bacterias podrían ser candidatos prometedores para futuras aplicaciones. El aislamiento de las cepas de Bacillus abre posibilidades biotecnológicas para la producción de S. glaucus y la aplicación prospectiva de especies presuntamente únicas. A través de las descripciones bioquímicas de estos aislamientos se muestra su capacidad para producir algunas enzimas descomponedoras como celulasa, amilasa, proteasa, catalasa y lipasa. Por otro lado, los análisis descriptivos mostraron una fuerte indicación de su capacidad para producir algunas hormonas de crecimiento de las plantas que pueden aumentar el crecimiento y proteger a las plantas, como su capacidad para producir reductasas de nitrato, solubilización de fosfato, indol y giberelinas. El hecho de que estas plantas fueran colonizadas con éxito por cada microbio sugiere que podrían ser utilizadas en muchas aplicaciones, como biofertilizantes, biorremediación y control biológico.