Introducción
Vaccinium floribundum Kunth es un fruto nativo de los eriales ecuatorianos (Torres y Pulgar, 2017). Durante la maduración esta baya soporta cambios de color (Xu y col., 2010): inicialmente verde cuando el fruto es inmaduro, rosado al alcanzar la madurez fisiológica y finalmente negro cuando llega a la madurez total (Arteaga, Andrade y Moreno, 2014). Cianidina, malvidina y delfinidina son antocianinas presentes en este tipo de frutos (Jin y col., 2020). Narváez y Suárez (2016), reportaron que por cada gramo de extracto seco de este fruto obtuvieron 3,92 mg de cianidina-3-o-glucosido (Rahman y col., 2021).
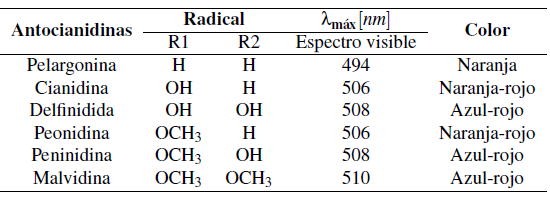
Las antocianinas de origen vegetal son colorantes naturales, (Yépez y Suárez, 2019) con propiedades protectoras para las plantas frente a: luz UV, oxidantes y radicales libres (Enaru y col., 2021). Su utilidad en la industria cosmética, alimenticia y farmacéutica se ha incrementado por sus propiedades bioactivas (Buchweitz y col., 2013) dentro de las cuales se encuentran: efectos antidiabéticos, antitumorales, antiinflamatorios y anticancerígenos (Garzón, 2008). Además, son los ejecutores de la gama de colores que comprende del rojo al azul de varios frutos (Nguyen y col., 2018). Una de las razones de estas amplias tonalidades es la estructura del anillo B presente en la estructura de Malvidina 3-O-Glucósido (Sánchez, 2013)). Este anillo presenta variaciones en sus radicales (Tabla 1), en las cuales se pueden diferenciar mayor metoxilación con desplazamientos hacia coloraciones azules, por otro lado, menor número de metoxilaciones con tonalidades rojas (Rahman y col., 2021).
Para incrementar su solubilidad las antocianinas presentan reemplazos glicosídicos en los radicales 3 y/o 5 (Putra y col., 2023). Por ejemplo, en la naturaleza malvidina está presente en forma de Malvidina 3-glucosido (Ayala y col., 2018). Ver Figura 1.
Las acilaciones aromáticas pueden sustituir grupos glucosídicos, produciendo tonalidades púrpuras (Kader y col., 1998). Además, los pigmentos coloreados se encuentran en cuatro formas químicas diferentes que dependen del pH del medio (Castañeda-Ovando y col., 2009). Así, a pH = 1-3 se forma el catión flavilio, que es soluble en agua y además es responsable de los colores rojo y púrpura (Vasco y col., 2009). Cuando el pH aumenta entre 8 y 10, la especie azul quinoidal es abundante (Belmonte y col., 2016) mientras que a pH entre 12 y 14 aparece la pseudobase de carbinol y una chalcona, compuestos que son incoloros. Sin embargo, los cuatro compuestos son solubles en solventes polares y pueden coexistir en un amplio rango de pH (Enaru y col., 2021).
El solvatocromismo se usa comúnmente en muchos campos para estudiar la polaridad global y local en macrosistemas (Reichardt, 1994). Su estudio comprende fenómenos que involucran fuerzas intermoleculares y dinámicas acopladas al solvente (Marini y col., 2010).
Las antocianinas bajo condiciones experimentales presentan propiedades solvatocrómicas por el contacto con solventes que podrían producir hidroxilaciones, metoxilaciones, cambios en el pH o sustituciones aromáticas (Iosub, Meghea y Geana, 2014). Basándose en datos espectrales, Iosub, Meghea y Geana (2014) establecieron correlaciones entre las propiedades solvatocrómicas con los parámetros de polaridad del solvente. El estudio determinó que los extractos de antocianinas resultan útiles en el estudio del efecto solvatocrómico en solventes de diferente polaridad.
La importancia del estudio del comportamiento solvatocrómico, específicamente en colorantes naturales, con estructura similar a las antocianinas radica en la obtención del método de cuantificación (Klymchenko, 2017). Haciendo énfasis en los datos espectrales, “la ley de Beer explica los aspectos cuantitativos de las mediciones de absorción por la dependencia lineal de la concentración del soluto” (Linying y col., 2022, p. 1386). Las ecuaciones de Lorentz-Lorenz y Clausius-Mosotti son conocidas por la determinación de momentos dipolares, y el propósito “es predecir un fuerte acoplamiento entre los osciladores de soluto y solvente” (Mayerhöfer y Popp, 2020, p. 2). Al involucrar fuerzas intermoleculares con el solvente, es necesario establecer rangos de variación, específicamente con relación a la polaridad (Lee y col., 2013).
Según el Codex Alimentarius, (2021), durante el proceso de fabricación es indispensable que el colorante natural no se vea afectado por variaciones en la longitud de onda al estar en contacto con los ingredientes de la formulación (Loving, Sainlos e Imperiali, 2010). El efecto solvatocrómico de antocianinas en un producto farmacéutico, cosmético o alimenticio se ve reflejado como una degradación (Cai y col., 2020).
Con los antecedentes presentados, el estudio realizado evaluó el comportamiento solvatocrómico de estándar primario de Malvidina -3- glucósido clorhidrato CAS N° 7228-78.6, producido por el acoplamiento soluto-solvente, al variar la fracción molar del solvente. Este análisis determinó la longitud de onda máxima para cada fracción molar de solvente. El comportamiento solvatocrómico también fue evaluado por la diversificación de la longitud de onda máxima de Malvidina -3- glucósido en colorante natural y estabilizado, al modificar el pH del solvente (agua) a 4 y 6, con HCl y NaOH respectivamente. El análisis evaluó si los comportamientos solvatocrómicos en estos pigmentos son estadísticamente significativos, al variar el pH del solvente.
Materiales y Métodos
Estudio solvatocrómico: estándar primario
El comportamiento solvatocrómico fue evaluado en estándar primario de Malvidina -3- glucósido clorhidrato CAS N° 7228-78.6, con variación en la proporción del solvente (etanol-agua: 40,55, y 70% v/v. Durante la determinación experimental de los barridos espectrales con estándar primario el pH se mantuvo en el valor de 2, con la adición de una solución de HCl 1M para preservar la estructura del ion flavilio, lo que concuerda con la bibliografía (Iosub, Meghea y Geana, 2014).
El cambio de longitud de onda máxima de Malvidina 3-O-Glucósido, fue analizado por duplicado durante tres días en un espectrofotómetro VARIAN 50Bio. La variación de los datos fue analizada por desviación estándar a cada concentración de solvente.
Estudio solvatocrómico: colorante natural
Extracción
El método de extracción fue una modificación de la investigación (Almachi, 2018). La obtención de colorante natural de Vaccinium floribundum Kunth inició con el desengrasado del fruto de mortiño previamente seco y molido, mediante Söxleth con nhexano durante 8 horas, seguido de maceración en capuchones de papel filtro con etanol al 96% durante 24 horas. Se percolaron individualmente cada capuchón a una velocidad de 20 gotas por minuto hasta que fuese negativa la prueba de compuestos fenólicos con cloruro férrico 5%. Cada extracto etanólico fue concentrado en el equipo RapidVap: Calor de evaporación 205 Kcal/Kg, Velocidad 45% y Vacío 175 Mbar. Los extractos secos se almacenaron dentro de un desecador protegidos de la luz.
Estabilización
El colorante natural proveniente de extracto seco de Vaccinium floribundum Kunth fue estabilizado en una matriz de pectina comercial (Ceampectin RS 4710), por el método de absorción con las siguientes condiciones: concentración de etanol 60% v/v, concentración de extracto 5% p/v y tiempo de contacto 25 horas.
Solvatocromismo
El comportamiento solvatocrómico fue evaluado por la variación de la longitud de onda máxima de Malvidina -3- glucósido en colorante natural y estabilizado, al modificar el pH del solvente (agua) a 4 y 6, con HCl y NaOH, respectivamente. El estudio se basó en un análisis de covarianza múltiple ANCOVA de dos factores, cada uno con 2 niveles sobre 1 variable respuesta, es decir, K= 2 y n= 1. Para esto se desarrollaron 4 corridas experimentales, con una réplica completa del diseño para determinar la reproducibilidad del modelo, dando un total de 8 corridas experimentales.
Resultados y Discusión
Evaluación del comportamiento solvatocrómico de Malvidina -3- glucósido clorhidrato
En la Tabla 2 se observan los máximos de absorción de Malvidina con su respectiva desviación estándar, evidenciando un efecto solvatocrómico a diferentes concentraciones de solvente.
El efecto del solvente producido por estos sistemas ternarios (agua: etanol: antocianina) está determinado por los parámetros de polaridad de la proporción etanol: agua. El solvatocromismo fue evaluado por la capacidad del solvente para producir cambios dipolares en la molécula de malvidina causados por el cambio de la fracción molar del solvente. Mayerhöfer y Popp (2020) describen que los cambios polares producidos por el solvente presentan modificaciones espectrales de las bandas de absorción. Las variaciones polares producidas por el solvente se evidencian con las alteraciones de la longitud de onda máxima de la Tabla 2. Por lo tanto, al desarrollar un método de cuantificación con moléculas que presenten una estructura similar a Malvidina-3-glucósido clorhidrato, es recomendable mantener la fracción molar del solvente, para de esta manera evitar comportamientos solvatocrómicos del analito.
Evaluación del comportamiento solvatocrómico del colorante natural de Vaccinium floribundum Kunth
Extracción
El proceso de estandarización de extracto seco de mortiño partió de una muestra seca y molida del fruto con las siguientes especificaciones: tamaño de partícula 595μm, humedad 3,05 ± 0,05% y contenido de grasa total de 2,5 ± 0,2%. El método de extracción de colorante natural y su estabilización en pectina descritos en materiales y métodos, permitió obtener un rendimiento como extracto seco del 53,1 ± 4,4% y de colorante estabilizado del 91,8 ± 4,6%.
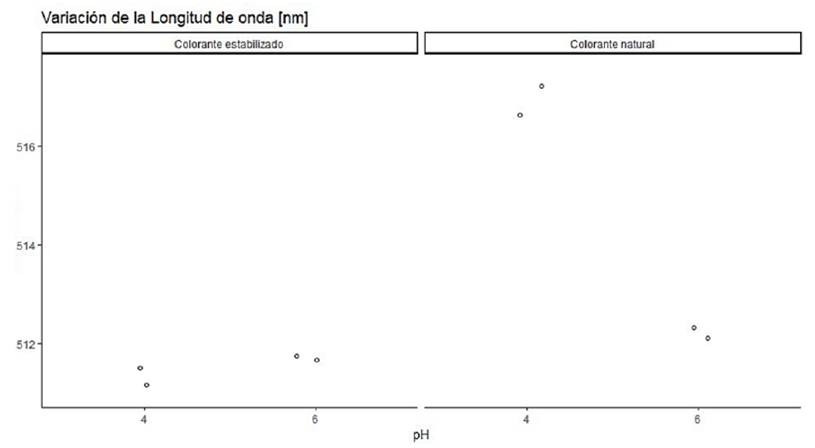
La Tabla 3 presenta longitudes de onda máximas de malvidina en: colorante natural y estabilizado en pectina cuando existe una variación de pH en agua. El análisis ANCOVA determinó que el pH del colorante natural es significativo (Valor-p < 0;05), con un intervalo de confianza del 95%. El pigmento al estar expuesto a una variación de pH de 4 y 6 presenta cambios en la longitud de onda máxima. Estos desplazamientos son producidos por Malvidina -3-glucósido presente en el extracto seco.
En un ambiente entre 2 y 4 deja la forma de antocianina para estar presente como la especie quinoidal, mientras que a pH 6 se encuentra como chalcona (Enaru y col., 2021). Al comparar las longitudes de onda máxima del colorante natural con estabilizado, el análisis ANCOVA de dos factores determinó que existe diferencia significativa (Valor-p < 0;05) con un intervalo de confianza del 95%, lo cual se puede observar en la Figura 2. La unión de Malvidina -3- glucósido con pectina por puentes de hidrógeno con el oxígeno del grupo metoxilo de la antocianina presenta un cambio reflejado en las longitudes de onda máxima (Koh, Xu y Wicker, 2020).
Los colorantes naturales al ser utilizados para fines farmacéuticos, cosméticos o en alimentos deben ser estables frente a cambios de pH durante los procesos de fabricación. El estudio determinó que no existe diferencia significativa (Valor-p > 0;05), al variar el pH del solvente cuando el colorante natural se encuentra estabilizado. La matriz estabilizante pectina impide que Malvidina -3- glucósido interaccione con los iones OH¯, H+ del solvente, impidiendo desplazamientos solvatocrómicos.
Los análisis se realizaron a pH específicos de 4 y 6. Sin embargo, un estudio en alimentos determino que los alimentos industrializados tienen valores de pH ligeramente más ácidos que los alimentos naturales. Este hecho probablemente está relacionado con los métodos de conservación utilizados y la adición de vitaminas. Los cereales registraron valores de pH que oscilaron entre 7.95 y 5.4 (Casaubon y col., 2018, p. 91). Por lo tanto, es necesario determinar cambios solvatocrómicos en un mayor rango de pH.
Conclusiones
La presente investigación evaluó el cambio de polaridad de malvidina -3- glucósido clorhidrato al usar etanol como solvente en tres proporciones distintas. El estudió determinó que existen desplazamientos solvatocrómicos evidenciados por la variación de las longitudes de onda máximas. Los resultados indican que los enlaces de hidrógeno intermoleculares entre el soluto y el solvente son responsables de los cambios solvatocrómicos en las mezclas binarias analizadas. El estudio en estándar primario no se basó en determinar significancia en los cambios solvatocrómicos. El análisis fue la evaluación de la reproducibilidad de cada longitud de onda en diferentes días.
El extracto seco al estar expuesto a una variación de pH de 4 y 6, presenta cambios en la longitud de onda máxima. Estos desplazamientos son producidos por Malvidina -3- glucósido presente en el pigmento. El análisis ANCOVA determinó que la variación de pH en el colorante natural produce variaciones significativas (Valor ˗p < 0,05), con un intervalo de confianza del 95%.
La estabilización del pigmento en una matriz natural determinó que no existe diferencia significativa (Valor ˗p > 0,05), al variar el pH del solvente. Los desplazamientos solvatocromicos que se producen por la presencia de iones hidrogeno e hidroxilo a pH 4 y 6 fueron eliminados por la unión polisacáridopolifenol.