Forma sugerida de citar:
Gutiérrez-Pineda, K. y Herrera, M. (2022). Caracterización fitoquímica preliminar de los extractos etanólicos de hoja, fruto verde y maduro de Terminalia catappa L. (Almendro) en Panamá. La Granja: Revista de Ciencias de la Vida. Vol. 36(2):8-17. http://doi.org/10.17163/lgr.n36.2022.01
1 Introducción
Panamá es uno de los países con mayor diversidad biológica a nivel mundial (Olmedo y col., 2018; López y Mainieri, 2019), con 8 de las 200 ecoregiones reconocidas alrededor del mundo y con 21 veces más especies de plantas por km2 que Brasil (ANAM, 2010). Alrededor de 10000 especies de plantas vasculares se han descrito en el país (Correa, Mireya y Stapf, 2004), sin embargo, esta lista ha incrementado en los últimos años con reportes de especies descritas y nuevos rangos de distribución para Panamá (Flores, Ibanez y Correa, 2016; Flores, Black e Ibáñez, 2017; Flores y col., 2018; Ortiz y col., 2019).
La flora panameña presenta reservorios de productos naturales, siendo de gran valor para la bioprospección de nuevos tratamientos terapéuticos con alto potencial económico y medicinal (Gupta, 2004; Gupta, 2008; Leija y col., 2014), lo que reafirma la importancia y necesidad de aumentar nuevos estudios químicos, biológicos y toxicológicos de las plantas del país.
Uno de los primeros trabajos sobre etnobotánica en Panamá fue expuesto por Esposito y col. (1985), incluyendo las primeras caracterizaciones fitoquímicas de hojas y tallo en almendro de río (Terminalia catappa L.), encontrando la presencia de taninos. Muhammad y Mudi (2011) y Mena, Poli y Almansa (2015) recalcaron la importancia en usos tradicionales y medicinales (e.g. propiedades tónico-astringentes), para países como Costa Rica, Colombia y otros más. En Panamá, los lugareños de la provincia de Los Santos reportan su uso como planta medicinal (Torres y col., 2017). Esta especie es nativa del sureste de Asia e introducida en Panamá (Correa y col., 2010; Farnum y Murillo, 2015; Farnum y Yángüez, 2015; Jiménez y Espino, 2020).
Se han reportado compuestos secundarios (e.g. ácidos triterpénicos, antinflamatorios) de los extractos etanólicos de la hoja de T. catappa (Fan y col., 2004). También se han aislado algunos glucósidos de flavonas [6-C-(2”-O-galloyl)-b-Dglucopyranoside] de los extractos etanólicos de la hoja seca con funciones bioactivas antioxidantes (Lin y col., 2000). Se han reportado funciones afrodisíacas a la semilla, con presencia de alcaloides, aceites, aminoácidos y péptidos (Ratnasooriya y Dharmasiri, 2000). De igual forma, se ha observado que el extracto de la hoja seca inhibe el crecimiento de Bacillus subtilis, una bacteria del suelo que puede actuar como biofungicida (Lahlali y col., 2013), y Staphylococcus aureus, una bacteria de nuestro cuerpo que podría causar infecciones si no es controlada (Lowy, 1998).
De los extractos con cloroformo de las hojas también se han determinado funciones bioactivas hepatoprotectoras contra daños hepáticos agudos inducidos por tetracloruro de carbono (CCl4) y Dgalactosamina, lesión de hepatocitos inducida por (D-GalN). Esta función activa se relaciona con la presencia de triterpenos (Gao y col., 2004). Investigadores han llegado a establecer que el estudio de las diferentes partes de T. catappa L. es de suma importancia para la bioprospección y creación de posibles fármacos contra enfermedades desentendidas (Muhammad y Mudi, 2011; Chanda y col., 2013; Jiménez y Rebolledo, 2015; Calderón, Torres y Pretel, 2013).
Debido a que existen muy pocos estudios realizados en Panamá con T. catappa L. y tras analizar el potencial de esta especie para futuros estudios enfocados en la bioprospección de compuestos secundarios bioactivos, el objetivo de esta investigación es realizar la primera caracterización preliminar de los extractos etanólicos de las hojas nuevas, fruto verde y maduro en T. cattappa L. de Panamá.
2 Materiales y Métodos
2.1. Área de colecta
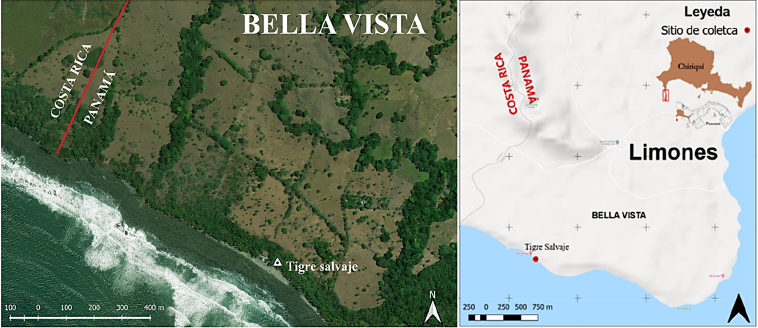
Se colectaron las partes vegetales de T. catappa en la comunidad de Bella Vista, corregimiento de Limones, Punta Burica, Panamá (8◦ 207.15”N, 82◦53022.38”O) (Figura 1). Este corregimiento separa la costa Pacífica de Panamá con Costa Rica. La población humana que habita en esta área ha fragmentado los bosques para realizar actividades socioeconómicas, como pastizales para ganadería y monocultivo de palma aceitera (Miranda, 2013). El área posee un clima tropical húmedo, con una precipitación anual de 4247,8 mm y una temperatura media anual de 26,4-27◦C. La vegetación original dominante en la región según Holdridge es el Bosque Húmedo Tropical (Miranda, 2013).
2.2. Colecta y Preparación del Material Vegetal
Las muestras fueron recolectadas en época de transición seca a lluviosa (mayo-junio, 2017). Se colectaron hojas nuevas (HN), que estaban más cercana a la base del cogollo y son de color verde, y se diferencian de las secas porque cambian de rojo-naranja a chocolate. También se recolectaron muestras de frutos verdes (FV) y de frutos maduros (FM). El FV es de color verde y el FM es de color amarillo, y se logran diferenciar cualitativamente (Figura 2). Las diferentes partes vegetales fueron debidamente prensadas y llevadas al Herbario de la Universidad de Autónoma de Chiriquí (UNACHI), donde posteriormente fueron identificadas por especialistas botánicos.

Figura 2. Ilustración fotográfica de las partes vegetales del almendro (T. catappa L.) A. Fruto maduro, B. Fruto verde, C. Hoja nueva y fruto verde. © Elaboración propia.
Se realizó un tratamiento directo de las HN, FV y FM del almendro, el cual consistió en poner cada una de las partes por separado en etanol al 95% durante un día. El extracto etanólico de estas partes se obtuvo mediante un filtrado por gravedad. Se colocó un papel filtro en un embudo para separar la parte solida de la líquida. Luego este extracto se concentró en un rotavapor al vacío (BUCHI Rotavapor TM R-210) para posteriores análisis (Hostettmann y col., 2008).
2.3. Caracterización fitoquímica
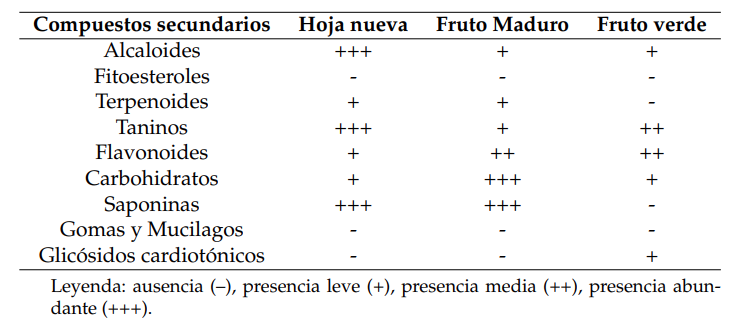
Se realizaron diferentes pruebas cualitativas y semicuantitativas para determinar los tres grandes grupos de compuestos secundarios (compuestos fenólicos, compuestos nitrogenados y terpenos). Las señales cualitativas se identificaron por la aparición de precipitados, cambio de color y formación de espuma al momento de agregar el reactivo correspondiente al tipo de metabolito que se buscaba caracterizar. Las semicuantitativas fueron evaluadas de la siguiente manera: ausencia (–), presencia leve (+), presencia media (++), presencia abundante (+++), de acuerdo con la intensidad de las señales cualitativas anteriormente mencionadas. Se realizaron triplicados por cada prueba, con muestras control del reactivo y del extracto, evitando falsos positivos relacionados.
Los compuestos nitrogenados (alcaloides) fueron caracterizados con Draguendorff, Mayer, Wagner y Hager. Cada subgrupo de terpenos fue caracterizado con el reactivo correspondiente, Terpenoides con Rosenthaler, Fitoesteroles con LiebermannBuchard y Triterpenos con Salkowski. Se utilizó Cloruro Férrico al 5% (FeCl3) en la identificación de taninos; los flavonoides se caracterizaron con H2SO4 concentrado y NaOH al 5%. Para la identificación de saponinas, se preparó una solución acuosa de los extractos y se agitaron, y la formación de espuma es indicativo de su presencia. La identificación de los glicósidos cardiotónicos se realizó con la prueba Legal. Para la identificación de gomas y mucílagos se disolvió un par de mL del extracto en 2,5 mL de agua destilada, por último, se le agregó 5 mL de alcohol al 95% con agitación constante (Albuquerque, 2000; Hostettmann y col., 2008).
Se realizó un análisis de Espectroscopía Infrarroja (FTIR) y Espectroscopía Ultravioleta-Visible (UV) al extracto crudo de cada una de las partes para saber cuáles eran los grupos funcionales presentes y se concuerda con las estructuras base de los compuestos detectados por tamizaje (Hostettmann y col., 2008).
2.4. Análisis de datos
Se utilizó el programa Past 4.02 para realizar una gráfica de abundancia relativa de los compuestos secundarios presentes en cada uno de los extractos de las partes vegetales estudiadas. Se aplicó el índice de Whittaker para evaluar el porcentaje de diferencia en la composición fitoquímica en las diferentes partes vegetales. Este análisis se valoró con respecto a la presencia (1) y ausencia (0) de los grupos de compuestos secundarios (Whittaker, 1960).
3 Resultados y Discusión
Este estudio expande la información fitoquímica preliminar de T. catappa L. en Panamá, a partir de la caracterización fitoquímica cualitativa de las diferentes partes de T. catappa L. Se logró identificar los tres grandes grupos de compuestos secundarios de la planta, presentando similitudes en la composición de compuestos secundarios. La caracterización semicuantitativa o abundancia de estos compuestos es variable para cada parte, sobresaliendo con mayor abundancia los compuestos nitrogenados (alcaloides) y compuestos fenólicos (taninos, flavonoides).
Se detectó la presencia sólo de terpenoides, pero en muy baja abundancia, y ausencia de fitoesteroles. Tampoco hubo presencia de glicósidos cardiotónicos, ni de gomas y mucilagos (Tabla 1, Figura 3). Esta caracterización preliminar coincide con otros reportes. La abundante presencia de compuestos fenólicos o ácidos polifenólicos es una característica particular de las hojas de esta planta (Tanaka, Nonaka y Nishioka, 1986), como por ejemplo el ácido gálico, el cual se considera como uno de los mayoritarios (Marrero y Morales, 2016).
Las señales de FTIR para el extracto del FV de almendro (T. catappa L.) fueron de compuestos aromáticos (1770-2010 cm-1), OH de compuestos fenólicos (1066 cm-1) y C=O-C de éteres aromáticos (1229 cm-1), lo que indica una posible presencia de los grupos de ácidos polifenólicos, taninos gálicos, saponinas y flavonoides. En el caso de las HN, estas muestran tensiones de C-H (2946 cm-1) y C=H (1662 cm-1), que podrían ser posibles indicadores de cadenas de terpenoides o fitoesteroles. De igual forma, FM y FV presentan señales armónicas, indicativos de compuestos aromáticos (1770-2010 cm-1) en conjunto con señales de OH, indicativo de posibles compuestos fenólicos.
En la espectroscopia UV de los extractos de las HN y FV del almendro (T. catappa L.) se obtuvieron picos de 255nm, 294nm, 377nm, los cuales son representativos de compuestos aromáticos, nitrogenados, en este caso podrían ser taninos, alcaloides y flavonoides; a longitudes de onda a 666 y 662 nm, se encuentran las saponinas por sus complejas estructuras esqueléticas.
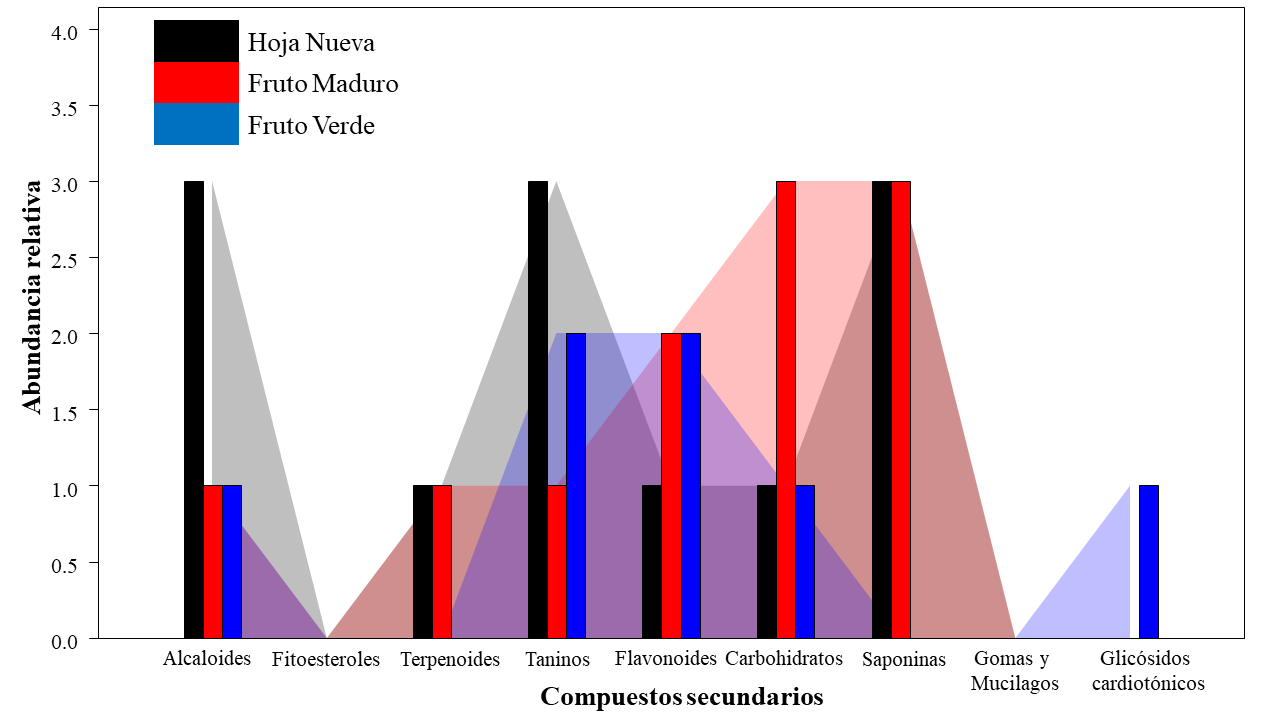
Figura 3. Abundancia relativa con respecto a la caracterización semicuantitativa de los compuestos secundarios.
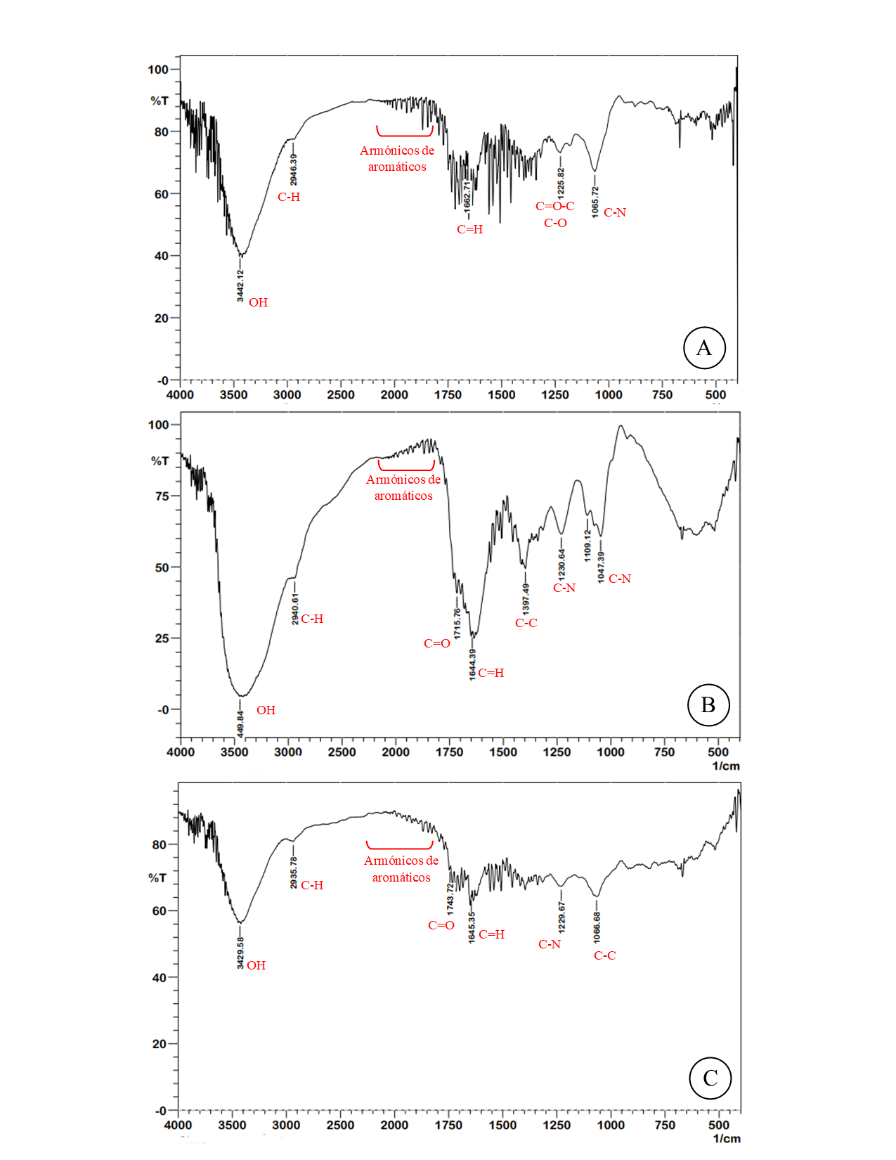
Figura 4. FTIR de las diferentes partes vegetales de T. catappa L. A. Hoja nueva; B. Fruto maduro; C. Fruto verde.
Las investigaciones confirman que la abundan de compuestos polifenólicos está relacionada con funciones bioactivas, como por ejemplo antioxidantes de gran interés a nivel farmacognóstico (Tanaka, Nonaka y Nishioka, 1986; Masuda y col.,1999; Lin y col., 2001; Marques y col., 2012). Uno de los estudios que prueba la posible efectividad de los compuestos fenólicos (Punicalagina) como antioxidantes es el presentado por Chen y col. (2000), donde la Punicalagina suprime la generación de radicales libres intracelulares inducidos por bleomicina, identificados como superóxidos y peróxidos de hidrógeno, evitando la genotoxicidad. También se ha reportado que punicalagina y punicalina tienen actividad antihepatotóxica sobre la toxicidad inducida por el acetaminofén (Paracetamol) en hígado de ratas (Lin y col., 2001).
El índice de Whittaker mostró sólo un 23,53% de diferencia entre las partes de las plantas. La HN con el FM presentó los mismos grupos de compuestos secundarios. El FV con respecto a la HN y el FM presentó 27,27% de diferencia en la composición fitoquímica. El fruto verde presentó cinco grupos de compuestos secundarios, abarcando compuestos nitrogenados (alcaloides) y compuestos fenólicos (taninos y flavonoides). No se obtuvo presencia de terpenoides. En FM se logró la identificación de seis grupos pertenecientes a los tres grandes grupos principales. El FV presentó glicósidos cardiotónicos con mayor abundancia de taninos; sin embargo, el fruto maduro presentó terpenoides, con alta abundancia de carbohidratos y baja de taninos.
Las variaciones en el fruto son comunes en los procesos de maduración, donde se produce mayor contenido de carbohidratos o azucares; también ocurre el aumento en la producción de compuestos volátiles o aromáticos (terpenoides) y la disminución de otros, en este caso taninos (Arrieta, Baquero y Barrera, 2006). La presencia de flavonoides también es importante pues son los que dan el color a las partes vegetales y son un indicativo de maduración. En el caso del fruto del almendro, este disminuye el color verde (clorofila) y aumenta el color amarillo, asociado a un tipo de flavonoide (antocianina) (Ronald, 2011).
Estas variaciones coinciden con lo reportado anteriormente, donde se observa un aumento considerable de carbohidratos en el estado maduro, siendo uno de los compuestos predominantes, seguido de terpenoides y compuestos fenólicos (Ratnasooriya y Dharmasiri, 2000; Santos, Lorenzo y Lannes, 2016). Estos valores de carbohidratos han demostrado que la fruta del almendro tiene un alto valor energético; de igual forma, se ha reportado que suministran sustancias básicas para el crecimiento y mantenimiento de las funciones corporales (Lima, 2012). En el presente está asociado a la presencia de saponinas. Por eso han sido utilizados en diversos productos como materia prima en el enriquecimiento de formulaciones existentes en la industria alimentaria (Nagappa y col., 2003; Lima, 2012; Chanda y col., 2013).
4 Conclusiones
En este estudió se logró la primera base sobre la composición fitoquímica de los extractos etanólicos de las hojas verdes, frutos verdes y maduros de T. catappa L. en Panamá. La caracterización semicuantitativa o abundancia de los compuestos fitoquímicos es variable para cada parte, y se observó con mayor abundancia los compuestos nitrogenados (alcaloides) y compuestos fenólicos (taninos, flavonoides). Se detectó baja abundancia de terpenoides y ausencia de fitoesteroles, glicósidos cardiotónicos, gomas y mucilagos.
Tomando en consideración la composición fitoquímica de T. catappa L. reportada en otros estudios y su similitud con lo encontrado en este trabajo, se puede considerar como un potencial recurso para la salud, siendo de gran valor etnobotánico, farmacológico y para la industria alimenticia en Panamá.