Forma sugerida de citar:
Carhuapoma, V., Valencia,N., Huamán, T., Paucar, R., Hilario, E. y Huere, J.L. (2020). Resistencia antibiótica de Salmonella spp, Escherichia coli aisladas de alpacas (Vicugna pacus) con y sin diarrea. La Granja: Revista de Ciencias de la Vida. Vol. 31(1):108-117. http://doi.org/10.17163/lgr.n31.2020.08.
1 Introducción
La crianza de alpacas para las familias alto andinas del Perú es una actividad de gran importancia socioeconómica, ya que aportan carne de alto valor proteico con bajo contenido de colesterol, y su fibra de gran demanda en mercado nacional y mundial (Rosadio et al., 2012; Siuce et al., 2015). Más del 85% de la crianza de alpacas en el Perú está distribuida en las Comunidades Campesinas y en pequeños productores que viven en condiciones de extrema pobreza y con carencias de asesoramiento técnico, afrontando grandes pérdidas económicas por problemas patológicos y elevadas mortalidades por etiologías parasitarias, bacterianas y vírales (Lucas et al., 2016).
Las elevadas tasas de mortalidad en las crías de alpacas llegan de 12 a 50%, principalmente a causa de problemas diarreicos enteropatógenos de Escherichia coli y Salmonella spp. (Ramírez, 1990; Rosadio et al., 2012), y la resistencia de los antibacterianos frente a Escherichia coli y Salmonella spp. es de preocupación mundial por las serias repercusiones que implica en la salud pública y la producción animal, concebidos por condiciones del uso inadecuado e indiscriminado de los antibacterianos (Yagui, 2018).
Desde el enfoque en la producción animal, el uso de los antibióticos se ha incrementado rápidamente, generando un riesgo de bacterias resistentes (Centeno et al., 2018), debido a que estas bacterias posiblemente sufrieron modificaciones genéticas de su mecanismo de residencia como inactivación enzimática, receptores alterados y transporte del antibiótico alterado, lo cual hacen la permanencia de genotipos bacterianos resistentes a Escherichia coli y Salmonella spp. y un agravante mayor es que existen escasos estudios orientados a la producción animal que posiblemente podrían estar relacionados con lo reportado en la salud humana (Schwarz et al., 2017).
La Salmonella spp. y Escherichia coli son patógenos de importancia clínica en la Salud Animal en los andes del Perú, por ser el agente causal de patologías que cursan con disfunción intestinal, generando el complejo diarreico neonatal en las alpacas, lo cual hace complejo su tratamiento terapéutico (Silvera et al., 2012; Rosadio et al., 2012).
Diversos estudios reportan un aumento de la resistencia antimicrobiana y mínimas posibilidades de sensibilidad a diferentes antibióticos frente a microrganismos patógenos de Salmonella spp. y Escherichia coli en las especies de aves, porcinos, cobayos, bovinos y animales de silvestria como los monos, generando grandes pérdidas del valor genético y socioeconómicas en los criadores (Oha, 2012; Medina et al., 2017; Morales, 2018).
No existen estudios relacionados sobre el uso de antibióticos en el área de veterinaria frente a Salmonella spp. y Escherichia coli provenientes de crías de alpacas con y sin enteropatías diarreicas, a pesar de que mundialmente Perú constituye una actividad de gran importancia para el mercado textil y cárnico, siendo estos microrganismos de importancia clínica emergentes en la producción de alpacas.
Se presume que pueden existir casos de cepas con fenotipos de resistencia similares en alpacas a las que existen en las especies de pollos, porcinos, bovinos y especies domésticos (Ortiz, 2011), lo cual posibilitaría que el uso de diferentes antibióticos antibacterianos en el tratamiento terapéutico en las crías de alpacas con enteropatías diarreicas (La salmonelosis y Escherichia coli) no sean eficaces en las comunidades de zonas alto andinas del Perú.
Ante los aspectos sostenidos, nace la necesidad de evaluar la resistencia antibiótica de Salmonella spp. y Escherichia coli en crías de alpacas con y sin enteropatías diarreicas, lo cual permitirá en un futuro que se implementen acciones para la reducción del uso de antimicrobianos; de igual forma, prevenir la generación y diseminación de bacterias resistentes a los antibióticos a través una aplicación de buenas prácticas sanitarias y del buen uso de antimicrobianos.
2 Materiales y Métodos
Para la investigación se muestrearon por conveniencia y según el teorema del límite central un total de 300 muestras de crías de alpacas con cuadros diarreicos y 300 muestras de crías sin cuadros diarreicos de raza Huacaya, en edades comprendidas entre 10 a 60 días de nacidas sin distinción de sexo, debido a que no se conoció la población de natalidad de crías porque es progresivo y temporal. Se tomaron en cuenta 06 Comunidades Campesinas alpaqueras de Huancavelica -Perú, ubicadas por encima de los 4 200 msnm, con temperaturas que oscilan entre de 5,6 a 8,5 ºC. La actividad se llevó a cabo entre los meses de enero a marzo de 2018, de igual forma se tomaron en cuenta el acta de autorización comunal y el consentimiento informado por los dueños de los rebaños bajo estudio.
Las muestras fueron recolectadas por triplicado por animal muestreado mediante el hisopado rectal en crioviales estériles suspendidos en medio de transporte Stuart (búfer peptonada) en horarios de madrugada (6.00 am a 7.30 am) sin la presencia de rayos solares y con eficiente manejo de bioseguridad, rotulados y registrados (Carhuapoma et al., 2018), y fueron transportados en un medio refrigerante a temperatura 8-12 °C (caja tecnopor con hielo biológico) al Laboratorio de Salud Animal (Área de Microbiología) de la Universidad Nacional de Huancavelica- Perú, para proceder a los estudios bacteriológicos.
El aislamiento de los microorganismos enteropatógenos presentes en las muestras de hisopados rectales se realizó en un pool de inóculos (triplicado muestreado), en tubos con tapa rosca enriquecidas con caldo de infusión cerebro corazón (BIH), haciendo grupos de 300 inóculos sin cuadros diarreicos y 300 inóculos con cuadros diarreicos e incubados a 37 °C/24. Los inóculos enriquecidos se sembraron independientemente por agotamiento en medios selectivos de agar MacConkey y Eosina azul de metileno (EMB) para Escherichia coli y Salmonella-Shigella (SS), Xilosa lisina desoxicolato XHD para Salmonella spp., incubándose a 37 °C/48 h en referencia a la norma ISO 6579:2002.
Para la óptima identificación y diferenciación de las cepas de Salmonella spp. y Escherichia coli se realizó la caracterización microscópica (coloración Gram) y macroscópica como: forma, consistencia y elevación (Murcia, 2010). Las colonias sospechosas se inocularon en medios de agar Hierro tres azúcares (TSI), Lisina (LIA), Citrato de Simmons (HS4), sulfuro-indol-motilidad (SIM), catalasa y Voges-Proskauer e se incubaron a 37° C / 24 horas. Los resultados obtenidos fueron cotejados mediante el Manual of Systematic Bacteriology (Bergey’s, 2008) y el Manual de Procedimientos de Laboratorio (Zurita, 2013) para su identificación.
En referencia a los resultados del aislamiento, se seleccionaron cultivos positivos a Escherichia coli (300), Salmonella spp. (120) provenientes de muestras con diarreas y Escherichia coli (172), Salmonella spp. (72) sin diarreas; a partir de ello se prepararon pool de inóculos madre para Escherichia coli, Salmonella spp. y se replicaron a 320 inóculos independientemente para cada microrganismo en estudio enriquecidas en caldo infusión Cerebro Corazón (BIH) e incubados a 37 °C /12 horas (De Toro et al., 2014: Carhuapoma et al., 2018).
La sensibilidad antibiótica se realizó mediante el Método de Kirby Bauer, para ello se cultivaron cepas de Escherichia coli y Salmonella spp. con un hisopo estéril de manera homogénea en placas Petri con Agar Mueller Hilton, para un total de 320 cultivos por cada microrganismo distribuidos a 40 cultivos por antibiótico como repeticiones (observaciones de independencia de sensibilidad por antibiótico en estudio), con la finalidad de uniformizar el estudio, quedando los siguientes grupos: con enteropatías diarreicas, Escherichia coli (n= 320 [40 repeticiones / antibiótico]); Salmonella spp. (n=320 [40 repeticiones/antibiótico]); sin enteropatías diarreicas, Escherichia coli (n= 320 [40 repeticiones / antibiótico]); Salmonella spp. (n=320 [40 repeticiones /antibiótico]). Los discos antimicrobianos se colocaron de manera independiente incubándose a 37 °C/24 horas, se probaron los antibióticos más utilizados en el mercado farmacéutico-veterinario ( A-Gentamicina (30μg), B-Novomicina (5μg), C-Tetraciclina(30μg), D-Enrofloxacina(10μg), E-Ampicilina(10μg), F-Amikacina(30 μg), G- Ceftriaxona (30μg) y H- Penicilina(10μg)), posterior a ello se leyeron los halos de inhibición del crecimiento y los resultados se interpretaron en referencia a los puntos de corte propuestos por el manual de European Committee on Antimicrobial Susceptibility Testing (EUCAST, 2018).
La prevalencia de microrganismos de Escherichia coli y Salmonella spp. presentes en crías de alpacas con y sin diarreas se realizó mediante la comparación de medias y la distribución de frecuencia (estadística descriptiva), a través de una investigación descriptiva transversal múltiple. Con el fin de determinar la sensibilidad antibiótica entre antibióticos y microrganismos se realizó el análisis de varianza y la prueba de Tukey (P< 0.01) mediante el diseño de arreglo factorial múltiple de 8*2, utilizando el programa SPSS v. 20.
3 Resultados
De un total de 300 muestras analizadas de crías de alpacas con diarreas, se encontraron positivos el 100 % (300/300) a Escherichia coli, 40,0 % (120/300) Salmonella spp. y 20% (120/300) asociados a Escherichia coli-Salmonella spp. con mayor porcentaje de presencia de Escherichia coli y Salmonella spp. De igual forma, 300 muestras evaluadas de crías de alpacas sin presencia de diarreas se encontraron positivos en 57,0% (172/300) a Escherichia coli, 24,0 % (24/300) a Salmonella spp. y 19,0% (56/300) asociados a E. coli-Salmonella spp. (Tabla 1), apreciándose con menor prevalencia de Escherichia coli y Salmonella spp. a las muestras de crías de alpacas con diarreas.
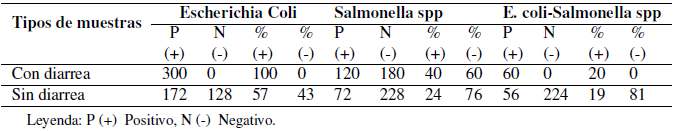
Tabla 1. Distribución porcentual de Escherichia coli y Salmonella spp. asociada de Escherichia coli-Salmonella spp., aislados de muestras con diarreas (n= 300) y sin diarreas (n= 300) en crías de alpacas
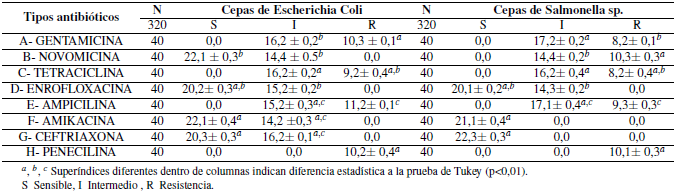
Los microrganismos patógenos de Escherichia coli y Salmonella spp. encontrados en las muestras rectales de crías de alpacas con enteropatías diarreicas demostraron diferencias estadísticas (P< 0.01) de diámetros de halos de inhibición de resistencia frente a los antibióticos de Gentamicina, Novomicina, Tetraciclina, Ampicilina y Penicilina; demostrando multi-resistencia antibiótica para ambos microrganismos, mientras que se observó sensibilidad antibiótica en ambos microrganismos en los antibióticos de Enrofloxacina, Amikacina y Ceftriaxona, demostrando diámetros de halos inhibición dentro del rango de los estándares sensibilidad (Tabla 2), de un total de 8 antibióticos evaluados.
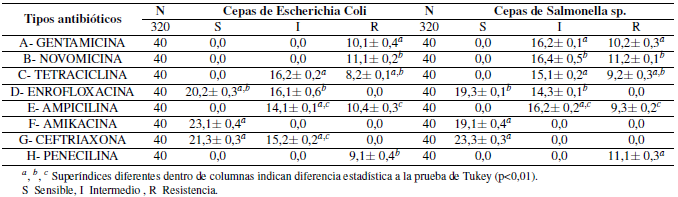
Tabla 2. Medias y desviación estándar de resistencia antibiótica de Escherichia coli (n= 320) y Salmonella spp. (n= 320) provenientes de crías de alpacas con diarreas.
La Escherichia coli y Salmonella spp. aisladas de muestras de heces de crías de alpacas sin enteropatías diarreicas presentaron diferencias significativas (p<0,01) de resistencia antibiótica frente a Gentamicina, Tetraciclina, Ampicilina, Penicilina y Novomicina, y fueron sensibles a Novomicina, Enrofloxacina, Amikacina y Ceftriaxona (Tabla 3).
4 Discusión
Los altos índices de prevalencia de Escherichia coli (100%,57), Salmonella spp. (40%,19%) y la asociación Escherichia coli-Salmonella spp. (20%, 19%) en las muestras rectales de crías de alpacas con y sin enteropatías diarreicas se deben posiblemente a que los productores de alpaca no están realizando un uso terapéutico eficiente y de manera responsable, y se asume que esto podría estar relacionado al uso de productos antibacterianos de mala calidad, lo cual hace difícil el control patológico, incrementando su incidencia. Lo anterior coincide con lo reportado por Carhuapoma et al. (2018, 2019), además las prevalencias de estos microrganismos patógenos bacterianos estarían muy relacionados a animales que nacen con bajos niveles inmunológicas y de madres con condiciones caquécticas, lo cual les hace que sean muy susceptibles a Escherichia coli y Salmonella spp., siendo una patología de importancia clínica en la crianza de alpacas (Rosadio et al., 2012).
Lucas et al. (2016) identificaron Escherichia coli (8,0%), coronavirus (53,3%), rotavirus (36,6%), Salmonella spp. (18,3%) y asociados de bacterias y parásitos 23,3%, virus y bacterias 11,7% y triple asociados 38,3% en crías de alpacas con cuadros diarreicos. De igual forma, Morales et al. (2017), aislaron Escherichia coli 47.78% en alpacas con diarrea y 58,33% sin diarrea, mientras que Chuquizuta et al. (2017) detectaron Escherichia coli (40,84%), Salmonella spp. (39.27%) en cuyes gazapos muertos, y Carhuapoma et al. (2018) encontraron la presencia de Escherichia coli en 80% en crías de alpacas con diarreas. Carhuapoma et al. (2019) reportan presencia de Escherichia coli y Salmonella spp. 12% en machos y hembras, asociados de Escherichia coli-Salmonella spp. en un 10%, para un total de 104 crías con diarreas; los resultados encontrados en este estudio resultan ser de mayor prevalencia en ambos microrganismos frente a los reportados.
Cebra et al. (2003), mencionaron que la salmonela en diarreas de alpacas no es una causa común, pero Whitehead y Anderson (2006) detectaron diversas especies de Salmonela en animales con casos de diarreas; posteriormente, Lucas et al. (2016) y Carhuapoma et al. (2019) manifiestan que la presencia de salmonela en cuadros diarreicos en alpacas es muy frecuente en rebaños mixtos (aves, cuyes, porcinos). Lo anterior indica que esta bacteria es facultativa, lo cual hace que su ciclo de transmisión epidemiológica sea muy viable y su patogenia sea frecuente en los animales domésticos, así como en las crías de alpacas.
Zambrano et al. (2013) identificaron Salmonella spp. en 23,5% y 32,4% en muestras de superficie corporal e hisopado cloacal en pollos de engorde. De igual forma, Salvatierra et al. (2015) presenciaron Salmonella spp. 6,3 ± 2,4% en carcasas del vientre y 1,8% en sub-muestras de piel de cabeza en porcinas, y Talavera et al. (2011) reportaron el 1,34% de Salmonella del grupo B (Typhimurium) en muestras de hígados de pollo para la venta. Los resultados encontrados en la investigación son similares con algunos reportados, pero difieren a otros debido a que se encontraron mayor % Enteropatógenos de Escherichia coli, Salmonella spp. y de Escherichia coli-Salmonela sp. en crías de alpacas; por ello, la existencia de Salmonella spp. y E. coli-Salmonela sp. se debe a agentes causales de patologías que cursan con disfunción intestinal, generando el cuadro diarreico agudo neonatal en las alpacas (More et al., 2011; Ontiveros et al., 2004; Ruiz et al., 2014) por ser la Salmonela un potencial de infección que pertenece a la familia enterobacteriaceae (Del Mar et al., 2012; Ríos, 2018) y al existir muy pocos estudios de casos clínicos de infestación de salmonelosis en alpacas, a pesar de que esta patología zoonotica es de importancia clínica para la salud pública y se presume que podría estar presentes en los serovares Typhimurium e Enteritidis, debido a las características bioquímicas, macromicroscópicas, la colonización y a las manifestaciones clínicas visualizadas en el estudio.
La multi-resistencia antibiótica presentada por Escherichia coli y Salmonella spp. frente a los antibacterianos de Gentamicina, Tetraciclina, Ampicilina, Penicilina y Novomicina, evidencian que los antibióticos probados posiblemente sufrieron modificaciones de su mecanismo de acción como: inactivación enzimática de antibióticos, impermeabilidad de la membrana o pared celular, expulsión por mecanismos activos del antibiótico y modificación del sitio blanco del antibiótico en la bacteria, como se reporta en la literatura, lo cual reduce las opciones terapéuticas (Ontiveros et al., 2004; Schwarz et. al., 2017; Ríos, 2018; Gatica y Rojas, 2018).
Además, las altas tendencias de resistencia de 8 antibióticos probados en el estudio estarían relacionados a la aplicación deficiente y el uso inapropiado de los antibióticos que vienen practicando los productores de alpacas en sus rebaños, además de la masiva distribución irresponsable de fármacos por los programas nacionales fomentados por profesionales no calificados, lo cual hace la tendencia progresiva de resistencia antibiótica en forma bidireccional entre el humano y el animal.
Zambrano et al. (2013), Lucas et al. (2016), reportan que la Salmonella spp. y Escherichia coli serian posiblemente resistentes a los antibacterianos de primera línea como la Fosfomicina, Enrofloxacina, Ciprofloxacina, Gentamicina, Oxitetraciclina, Penicilina, Ceftazidima y Trimetoprim-sulfametoxazol porque son de uso más frecuente en veterinaria e indiscriminadamente desde muchos años atrás en las especies de bovinos, pollos, gorrinos y cuyes, por ello no sería recomendable el uso como antibióticos de primera elección para el tratamiento del complejo diarreico en las crías de alpacas sin antes realizar las pruebas de susceptibilidad en laboratorios (Espada et al., 2014; Siuce et al., 2015; Carhuapoma et al., 2019).
Barboza y Suarez (2012), encontraron resistencia antibiótica en un 30 % en Gentamicina, Norfloxacina y Tetraciclina en Salmonella spp. aisladas de casos de Tifosis aviar. Cordero et al. (2002), reportaron multi-resistencia en 84.4% a Tetraciclina, Gentamicina, Ampicilina y Amikacina en bacterias Gram positivas y negativas de 11 antibióticos probados, y De la Fuente et al. (2015) encontraron una resistencia del 91% en cepas de Salmonella spp. a Ampicilina, Nitrofurantoína y 55% a Cefalotina y Cloranfenicol, mientras que Quesada et al. (2016) reportaron multi-resistencia de Salmonella spp. a los antibióticos de ácido Nalidíxico, Estreptomicina, Tetraciclina, Cloranfenicol, Ampicilina, Trimetoprim/sulfametoxazol, Gentamicina, Ciprofloxacina y Cefalosporinas. Estos reportes resultan similares a los resultados encontrados en este estudio, ya que coinciden casi con todos los antibióticos estudiados y estos mismos comportamientos de resistencia se pueden generar en los animales de sangre caliente (Castillo et al., 2014), por ello, la resistencia antibiótica de Salmonella spp. y Escherichia coli podría ser una alarma epidemiológica en el campo veterinario (Rivera et al., 2012), ocasionados por falta de práctica en las pruebas de sensibilidad en los laboratorios antes de realizar los tratamientos en los animales y por la deficiente capacidad de conocimiento farmacológico de técnicos operarios y médicos veterinarios (Barboza, Suarez, 2012; Carhuapoma, et al.,2018).
La sensibilidad antibiótica demostrada por las cepas de Escherichia coli y Salmonella spp. aisladas de hisopado rectales de crías de alpacas con y sin enteropatías diarreicas frente a los antibacterianos de Enrofloxacina, Amikacina, Novomicina y Ceftriaxona, se debe a que posiblemente lo antimicrobianos no fueron de uso prolongado o indiscriminado en los rebaños (Carhuapoma et al., 2018), y que posiblemente no hayan generado la modificación de sus mecanismos de acción antibiótica, así como los genes de DNA girasa y topoisomesasa IV (Romeu et al., 2012; Lee, et al., 2013; Ruiz et al., 2014; Schwarz et al., 2017). De igual forma, Barrios et al. (2016) encontró la Escherichia coli sensibles a Trimetoprim (98%), Gentamicina (95%) y fosfomicina (88%), Ciprofloxacino (85%), Ceftadizina (79%) y resistente a Nitrofurantoína (85%) provenientes de crías de alpacas sanas y enfermas, resultados que difieren con los resultados reportados en este estudio; por lo tanto, según los resultados encontrados en el estudio los 4 antibacterianos (Enrofloxacina, Amikacina, Novomicina y Ceftriaxona) que resultaron sensibles podría permitir ser específicos en el uso terapéutico de alpacas con y sin enteropatías diarreicas.
5 Conclusiones
Los aislamientos de Salmonella spp. y Escherichia coli de crías de alpacas con y sin cuadros de diarrea mostraron multi-resistencia a los antibióticos más usados del mercado farmacéutico-veterinario, y solo 4 antibióticos resultaron susceptibles. Por lo tanto, se deben realizar estudios comparativos en las zonas altas andinas alpaqueras del Perú para la prevención y diseminación de la resistencia antibacteriana.
Compromisos éticos: El equipo investigador declara que para esta investigación se ha realizado un manejo estricto del bienestar de los animales bajo los protocolos establecidos antes y durante la recolección de las muestras para el estudio.
Confidencialidad de los datos. El equipo investigador manifiesta que se ha tenido un estricto metodológico para la obtención de bases y modelo estadístico adecuado y programa de SPSS v. 20 para el procesamiento de datos.
Consentimiento informado. Para la ejecución de la investigación no se requirió consentimiento informado dado que fue un estudio de laboratorio basado en protocolos sin la manipulación de los animales, pero se tuvieron en cuenta para mayor confiabilidad del estudio.
Fuente de financiamiento: Para la ejecución del estudio no se ha tenido ningún financiamiento instituciona interno ni externo.
Conflictos de interés: Los autores declaramos ningún aprieto de haberes.