Forma sugerida de citar:
Araya, J. E. y Cáceres, R. 2018. Heterópteros míridos depredadores de trialeurodes vaporariorum (westwood), en particular tupiocoris cucurbitaceus (spinola) observado en Chile central. La Granja: Revista de Ciencias de la Vida. Vol. 28(2):6-19.http:
1 Polífaga vs insecto predador en el control biológico de plagas
Algunas características asociadas a los enemigos naturales son el grado de especificidad con la presa, un ciclo de desarrollo relativamente corto en relación a la plaga y una alta capacidad reproductiva, factores que se han considerado importantes para los agentes efectivos de control biológico (Snyder y Ives,2003).
Los depredadores polífagos consumen artrópo- dos de plagas que afectan a los cultivos, pero también a otras especies de artrópodos presentes en estos ambientes, por lo que no han sido considerados relevantes como agentes de control, en comparación con los enemigos naturales más específicos utiliza- dos en el control biológico de plagas (Labbé,2005).
Normalmente los depredadores generales evitan la interacción directa con otros enemigos naturales, sin embargo, estos consumen especies que utilizan recursos similares y, por lo tanto, son competidores potenciales (Polis, Myers y Holt,1989; Polis y Holt,1992; Rosenheim, Wilhoit y Armer,1993; Rosenheim,1998).
Varios estudios han indicado que los depredadores generales pueden trabajar en diversos agroecosistemas (Riechert y Bishop,1990; Settle et al., 1996; Snyder y Ives,2003) y pueden compensar el déficit de depredadores que tienen un rango limita- do de presas o tienden a desaparecer una vez que el recurso se agote.
La liberación programada de enemigos naturales para el control de plagas específicas puede resultar costosa y complicada, por lo que los depredadores polífagos son cada vez más usados en cultivos a largo plazo (Labbé,2005).
Algunos depredadores polífagos se establecen en los cultivos con mayor facilidad que los especialistas y, por lo tanto, ejercen un control de plagas permanente en las poblaciones (Gillespie y Mcgregor,N.d.). Además, dado que estos depredadores pueden consumir especies no relacionadas con las plagas (Albajes y Alomar,1999), se producen de forma natural en muchas áreas, reduciendo la necesidad de importar agentes de control biológico (Khoo, 1992).
2 Zoofitófagos heterópteros
Los depredadores zoofitófagos son omnívoros y pueden alimentarse en más de un nivel trófico (Pimm y Lawton, 1978; Eubanks y Styrsky, 2005). Recientemente, estos depredadores se han estudiado debido a su potencial en el control biológico, puesto que pueden resistir a largos períodos de es- casez de presas, y pueden alimentarse de tejido vegetal así como de artrópodos (Naranjo y Gibson, 1996; Wiedenmann, Legaspi y O’Neil,1996; Brodeur y Boivin,2006; Ingegno, Pansa y Tavella, 2011). Los depredadores zoofitófagos pueden utilizar ambos tipos de alimentos gracias a adaptaciones bioquímicas, morfológicas y fisiológicas, como la producción de enzimas digestivas y compuestos de desintoxicación, o por modificaciones de sus partes bucales que les permiten alimentarse de insectos y plantas (Coll y Guershon,2002; Snyder y Ives,2003; Labbé, 2005).
Los heterópteros míridos varían mucho de acuerdo a su capacidad para alimentarse por medio de plantas o animales. Su evolución es caracterizada por una divergencia entre los carnívoros y los fitófagos (Cohen,1996). La alimentación de las plantas por parte de estos depredadores es una nueva característica, muy diferente de los fitófagos correspondientes a los grupos ancestrales. Se asume que los linajes heterópteros con antepasados fitófagos surgieron ya que tenían una capacidad secundaria de alimentarse debido a la depredación (Sweet,1979). Los zoofitófagos heterópteros tienen la capacidad de explotar ambos recursos alimenticios por “conmutación trófica”, lo que les permite sobrevivir en ausencia de presas (Cohen,1996).
Los zoofitófagos heterópteros pueden alimentarse de plantas de forma ocasional o temporal para sobrevivir y reproducirse. Para algunos depredadores, las plantas proporcionan importantes nutrientes y agua, que en algunas presas son menos abundantes (Coll y Ruberson,1998; Portillo, Alomar y Wäckers,2012). En tales casos, la alimentación de plantas permite mantener poblaciones de depredadores y mejorar algunas características de los ciclos de vida individuales, como la supervivencia, el tiempo de desarrollo, la fecundidad y la longevidad (Cohen y Debolt,1983). Para otros, las plantas son un recurso alimenticio pobre que se utiliza solamente cuando no hay presa disponible (Gillespie y Mcgregor,N.d.). Esta alimentación por parte de plantas sirve para saciarse o para colonizar los cultivos antes de que llegue la presa. La alimentación por plantas es un complemento a los recursosalimenticios de las presas, que es la principal fuentede nutrientes. Y en otro grupo de heterópteros míridoscon digestión oral extra, el material vegetal simplementeproporciona el líquido que necesitan paraalimentarse de la presa y no es una fuente importantede nutrientes. Estos depredadores adquieren lasproteínas, grasas y hemolinfa necesarias de la presa,que utilizan para completar el desarrollo (Labbé,2005). Todas estas estrategias de alimentación puedendiferenciar a los depredadores como controladoresbiológicos adecuados.
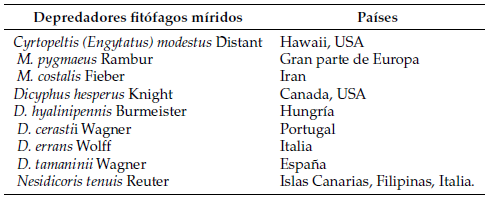
El depredador Macrolophus pygmaeus Rambur puede causar daños a las plantas de tomate cherry. En otros cultivos, se han descrito otros daños en la alimentación de los insectos de ojos grandes de Geocoris, incluso en presencia de presas (Alomar y Albajes,1996). Según Lalonde et al.(1999), cuando se combinan depredadores y cultivos tolerantes adecuadamente seleccionados se puede lograr una supresión efectiva de plagas, y en muchos cultivares de tomate M. pygmaeus estos no causan daños ni en la fruta ni en las plantas. En estos casos, la alimentación de plantas elimina una cantidad mínima de tejido vegetal y a bajos costos. Por lo tanto, el uso de zoofitófagos altamente efectivos en la alimentación de presas se ha vuelto común en gran parte del mundo (Labbé,2005). En la Tabla1 se presentan algunas especies de depredadores fitófagos míridos identificados y estudiados por su alto potencial como agentes de control biológico en los cultivos.
Frankliniell
Tabla 1. Especies de depredadores fitófagos míridos identificados para el control biológico de plagas de cultivos (Tanada y Holdaway,1954; Carnero-Hernández et al.,2000; Carvalho y Afonso,1977; Lucas y Alomar, 2002a; Athanassiou et al.,2003; Agustí y i Ambert,2009)
En un estudio realizado porJakobsen, Enkegaard y Brodsgaard (2004), los adultos de Orius majusculus (Reuter) (Hemiptera, Anthocoridae) atacaron a M. caliginosus en la ausencia y también en la presencia de Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae), mientras que ni las ninfas ni los adultos de M. caliginosus atacaron a O. majusculus. Las ninfas de O. majusculus no consumen M. pygmaeus. Estos resultados sugieren que la presencia de este mírido no afectará el control biológico de F. occidentalis.
Algunos depredadores fitófagos míridos Dicyphinaese utilizan con frecuencia en Europa para elcontrol de plagas debido a su potencial en el control biológico (por ejemplo, las moscas blancas, losáfidos y los trips) (Alomar y Albajes, 1996; Riudavetsy Castañé, 1998; Tedeschi et al.,1999; Hansen, Brodsgaard y Enkegaard, 2003; Alomar, Riudavets y Castañé, 2006). Algunos de ellos también se alimentan de plantas, como Dicyphus tamaninii Wagner y M. pygmaeus y son buenos candidatos para cultivos que toleran bajos niveles de herbívoros (Gillespie y Mcgregor, N.d.).Tedeschi et al.(1999) reportaron que M. pygmaeus se alimenta de T. vaporariorum, F. occidentalis, Aphis gossypii Glover, Myzus persicae (Sulzer), Tetranychus urticae Koch y Spodoptera exigua (Hübner). Lykouressis et al.(2008) agregó a Macrosiphum euphorbiae Thomas y confirmó a M. persicae (Margaritopoulos, Tsitsipis y Perdikis,2003; Sylla et al., 2016). Las estrategias de control que incorporan las especies Macrolophus requieren la ino- culación estacional de cultivos comerciales y la gestión ambiental para preservar los hábitats naturales y aumentar la colonización (Alomar, Goula y Albajes, 2002). D. tamaninii es un depredador eficaz dealta densidad de la mosca blanca en el tomate bajocondiciones de invernadero (Montserrat, Albajesy Castañé, 2000). D. hesperus es un fitófago nativodistribuido en Norteamérica y proporciona un controlde T. vaporariorum y T. urticae en el tomate bajocondiciones de invernadero (McGregor et al., 1999).
Las estrategias de control biológico han consistido tradicionalmente en liberar para luego inocular a los enemigos naturales extranjeros. Sin embargo, las inmigraciones periódicas y en gran medida imprevisibles de las plagas, que típicamente ocurren en la ventilación de los invernaderos en la tempo- rada temprana, tienden a obstaculizar estas estrategias de control. Como resultado, los esfuerzos para controlar la mosca blanca de T. vaporariorum en el invernadero a lo largo de la costa al noreste de España usando Encarsia formosa (Gahan) (Hymenoptera: Aphelinidae) en tomates de primavera sufren invasiones periódicas de la mosca blanca que limitan la efectividad del parasitoide (Albajes y Alomar, 1999). En esta situación en la que rara vez se aplican insecticidas al cultivo, los enemigos naturales nativos, como los depredadores míridos M. pygmaeus y D. tamaninii, también invaden los invernaderos (Castañé et al.,1987; Castañé, Alomar y Riudavets,1997; Castañé et al., 2004). Esta migración de fitófa- gos hacia los invernaderos es común en la región mediterránea y se ha documentado en Italia, Grecia y Francia, y también en zonas con clima atlántico suave, como las Islas Canarias y Portugal (Malausa, Drescher y Franco,1987; Perdikis y Lykouressis, 1996, 1997, 2000, 2004a; Tavella et al.,1997; Carvalho y Afonso,1977). La composición de las especies varía entre regiones, aunque pertenecen principalmente a los géneros Macrolophus, Dicyphus y Nesidiocoris.
Debido a su polifagia, los depredadores fitófagos míridos interactúan con la mosca blanca T. vaporariorum y su parasitoide E. formosa en el tomate bajo condiciones de invernadero. La colonización natural de los invernaderos por M. pygmaeus y D. tamaninii, las dos especies predominantes en la región costera de Barcelona, España, suele causar el establecimiento de poblaciones de depredadores en el cultivo que posteriormente se alimentan de la mosca blanca. No se observó ninguna preferencia por pupas parasitadas en las muestras bajo condiciones de invernadero, mientras que los estudios de laboratorio revelaron una marcada tendencia a evitar las pupas de los parasitoides. En esta área, los programas de IPM para los tomates bajo condiciones de invernadero y otras hortalizas deberían aprovecharla presencia de este complejo depredador y permitirla inmigración y el establecimiento de poblaciones sin afectarlos con insecticidas no selectivos (Castañéet al., 2004).
3 Control biológico de T. vaporario- rum con depredadores fitofagos heterópteros
Goula y Alomar (1994) describieron el uso de depredadores fitófagos míridos en el manejo integrado de plagas de moscas blancas en el tomate, España. Entre los mencionados Miridae Dicyphinae, y describieron las características morfológicas que ayudan a identificarlos, entre los que se encuentran Macrolophus pygmaeus (antes conocido como M. caliginosus Wagner), Cyrtopeltis tenuis Reuter, C. geniculata Fieber, D. tamaninii y D. errans Wolff. Además,Chouinard et al.(2006) estudiaron el mírido Hyaliodes vitripennis y su potencial para el control biológico de ácaros y áfidos en manzanos al este de Norteamérica, incluyendo también poblaciones del ácaro rojo europeo Panonychus ulmi Koch, el ácaro bimaculado T. urticae y los áfidos Pomi DeGeer y A. spiraecola Pagenstecher.
4 Control biológico en Chile de la mosca blanca en el tomate
En Chile, 20000 ha de tomate, el principal vegetal a nivel nacional, se cultivan por año para su consumo fresco e industrial. De esta área, unas 1000 ha se cultivan en invernaderos, especialmente en las regiones IV y V (ODEPA,2008).
Una de las principales plagas del tomate bajo condiciones de invernadero es la mosca blanca T. vaporariorum. Esta plaga polífaga afecta a más de 250 cultivos, y tiene la capacidad de desarrollar resistencia a los pesticidas, por lo que si se requiere un producto químico, este debe ser seleccionado y aplicado cuidadosamente. Esta plaga reduce la superficie foliar, el vigor y el crecimiento de la planta, además favorece el desarrollo de hongos saprofíticos en el follaje y es un vector potencial de enfermedades virales que reducen aún más la calidad y el rendimiento (Johnson et al.,1992). Los productores deben evaluar continuamente su densidad para evitar aumentos de la densidad explosiva, especialmente eninvernaderos, donde la plaga se desarrolla debido a la ausencia de enemigos naturales.
T. vaporariorum es la principal plaga del tomate y otros cultivos en Quillota, Chile central. En el tomate, el costo de los insecticidas alcanza entre el 49 y 89% del costo total del manejo de plagas (Vargas y Alvear,1999).
El control de T. vaporariorum se ve afectado por su alto potencial reproductivo y por la presencia de todas sus etapas en la parte inferior de las hojas, loque ayuda a evitar el contacto con insecticidas. En la actualidad, el control del insecticida se basa en el uso de varios productos que también afectan a los reguladores biológicos tales como E. Formosa, Aphidoletesspp. (Diptera, Cecidomyiidae), Neuroptera ycoccinélidos. En Quillota, los estudios indican queT. vaporariorum ha perdido susceptibilidad a metomilen algunas áreas, probablemente debido a la alta selección ejercida sobre la plaga, usando entre12 a 40 aplicaciones durante la estación. Además, la menor afluencia de poblaciones en los invernaderos protegidos ha reducido la variabilidad genética de la plaga y ha acelerado la resistencia a los insecticidas (Vargas y Alvear, 1999).
En muchos países, incluyendo Chile, las ninfas de T. vaporariorum se crían en el laboratorio y son parasitadas por E. Formosa, para luego ser liberadas para el control biológico de la plaga en el campo o en invernaderos. E. formosa parasita los ninfas 3 y 4 de la mosca blanca, pero el parasitismo sólo se detecta en la etapa de la pupa ennegrecida (Soto et al., 2001). Las plantas ornamentales de Poinsettia eHibiscus se utilizan para desarrollar Bemisia tabaci (Gennadius) y dejar que sea parasitada por E. Formosa.Esta mosca blanca no está presente en Chile, aunque es de gran importancia a nivel mundial para la transmisión de virus en las plantas y por tenerun bio tipo b muy agresivo (la nueva especie B. argentifoliiBellows y Perring según algunos autores).
Desde el 2004 en cada temporada se han observado míridos en plantas de tabaco en un jardín ubicadoen Peñaflor, en la región metropolitana de Santiago,Chile. En el 2007 también se observó este mírido en tomates bajo condiciones de invernadero enla misma zona, consumiendo a adultos y ninfas de T. vaporariorum. Sin embargo, no se han realizado estudios sobre su impacto y biología. T. vaporariorumes una plaga clave del invernadero de tomate, por lo que se ha estudiado para determinar su potencial como agente de control biológico en esta otras plagas. En Chile, Prado (1991) y Koch, Waterhousey Cofré (2000) no presentaron referencias sobre este depredador fitófago mírido.
5 Identificación de un nuevo depre- dador fitófago mírido en Chile
El depredador fitófago en el centro de Chile fue identificado como la especie polífaga Tupiocoris cucurbitaceus (Spinola) (Figura1) (Barriga Tuñon, n/d).

Figura 1. Tupiocoris cucurbitaceus alimentándose con su estilete insertado en un Trialeurodes vaporariorum adulto.
En las Figuras 2 y 3, respectivamente, se presenta una ninfa de Tupiocoris y T. cucurbitaceus alimentándose sobre una larva de la polilla del tomate,Tuta absoluta (Meyrick) (Lepidoptera: Gellechiidae), una presa mencionada por Biondi et al. (2013) en el sur de Francia.
6 Estudios de la biología de Tupio- coris cucurbitaceus
Según Bado, Cerri y Vilella (2005); Del Pino et al.(2009); Lopez, Cagnotti y Andorno (2011); López et al. (2012), T. cucurbitaceus se alimenta con frecuenciade T. vaporariorum en invernaderos libres de pesticidasen Argentina, y puede sobrevivir, desarrollarse y reproducirse normalmente en las plantas de tabaco o tomate. En el estudio llevado a cabo por Orozco Muñoz, Villalba Velásquez y López (2012) este depredador tuvo un periodo de míridos de 24,3  1,5 d para hembras y 23,7
1,5 d para hembras y 23,7 0,6 d para machos en ambos cultivos usando B. tabaci. De acuerdo a Burla et al. (2014), el alto consumo de huevos de T. vaporariorum por parte de T. cucurbitaceus sugiere la necesidad de llevar a cabo nuevos estudios para incluireste depredador en programas de control biológico en invernaderos.
0,6 d para machos en ambos cultivos usando B. tabaci. De acuerdo a Burla et al. (2014), el alto consumo de huevos de T. vaporariorum por parte de T. cucurbitaceus sugiere la necesidad de llevar a cabo nuevos estudios para incluireste depredador en programas de control biológico en invernaderos.
7 Estudios sobre Macrolophus pygmaeus
Macrolophus pygmaeus es un depredador muy polífago que ha demostrado ser eficaz en el contro de muchas plagas en plantas bajo condiciones de invernadero (berenjena, tomate y pepino) especialmente contra la mosca blancas, áfidos y trips. Este se utiliza principalmente en el control biológico contra la mosca blanca T. vaporariorum, especialmente en el tomate; y aunque los cultivos normalmente son tratados con insecticidas, el control biológico es cada vez más importante para controlar esta plaga. Se ha desarrollado un programa de IPM con fitófagos para el tomate con el objetivo de mantener las densidades poblacionales de los depredadores lo suficientemente altas como para conservar a T. vaporariorum y otras poblaciones de plagas con un bajo costo. Los adultos de M. pygmaeus se alimentan de fitófagos míridos de la mosca blanca y pupa, convirtiéndolo en un insecto con efectos positivos en el control biológico de T. vaporariorum (Castañé et al.,2004).
M. caliginosus (= M. pygmaeus) aparece en el sitio web de Fitonova (Donoso y Díaz Tobar, 2011) como disponible contra la mosca blanca del tomate y la polilla del tomate en Chile, pero no se proporcionan detalles. Carpintero y Carvalho (1993); Morrone y Coscarón (2008); Carpintero y De Biase (2011) presentaron unas listas de Miridae en Argentina (ver también Ohashi y Urdampilleta (2003); Logarzo, Williams y Carpintero (2005)).
M. pygmaeus se vende actualmente en Europa para el control de la mosca blanca del tomate bajo condiciones de invernaderos (Malezieux et al.,1995; Schelt et al.,1996; Pasini et al.,1998), y también para el control biológico de la polilla del tomate T. absoluta (Sylla et al.,2016) en los países mediterráneos (Albajes y Alomar,1999; ?; Guenaoui, Bensaad y Ouezzani, 2011; Urbaneja et al.,2012). D. tamaninii es otro depredador fitófago mírido que coloniza fácilmente los invernaderos en estos países. Lucas y Alomar (2002b) no registraron ninguna competición intraespecífica de D. tamaninii con M. pygmaeus.
El M. pygmaeus es atípico entre los míridos, debido a que las hembras aparentemente se aparean una sola vez (Gemeno Marín et al.,2007). Fauvel, Malausa y Kaspar (1987) estudiaron en condiciones de laboratorio las principales características biológicas de M. pygmaeus aprovechando las primeras etapas de la mosca blanca en el invernadero. La incubación de los huevos duró 11,4 d a 25◦C y más de un mes a 15◦C. La incubación de huevos fue de >80% en plantas hospederas en buenas condiciones. El desarrollo juvenil a 25 y 15◦C duró 19 y 58 d, respectivamente alimentándose de jóvenes ninfas de la mosca blanca. El desarrollo todavía se produjo a 10◦C pero no a 40◦C. La longevidad y fecundidad de las hembras alimentadas con huevos de Anagasta kuehniella Zeller alcanzó 232 d y 409 huevos, respectivamente.
En un estudio realizado por Perdikis y Lykouressis (2004 b), la longevidad adulta de M. pygmaeus en berenjenas y tomates fue mayor a 15◦C, y en berenjena y tomate alcanzó 38,72 y 34,20 d para las hembras, y 92,88 y 62,80 d para varones, respectiva- mente.
Bonato, Couton y Fargues (2006) estudiaron las preferencias alimenticias de M. pygmaeus en T. vaporariorumy B. tabaci, y Castañé y Zapata (2005) evaluaron una dieta a base de carne para crianza enM. pygmaeus durante varias generaciones, sin ningún material vegetal y usando rollos de algodón para la ovoposición (véase también Iriarte y Castañé (2001)). Se evaluó el rendimiento de los adultos de la séptima generación en esta dieta tanto en la mosca blanca como en la T. urticae. La efectividad de la depredación en las hembras y ninfas obtenidas fue similar a la de los insectos en la crianza convencional, por lo que este método es una alternativa al método convencional y representa una mejora en la producción de este depredador.
Alomar, Riudavets y Castañé (2006) liberaronentre 3 y 6 adultos de M. pygmaeus por planta,que estaban inicialmente infestados con 10 B. tabaci adultos. La alta tasa de liberación controló a la po- blación de la mosca blanca. Una tasa de liberación más baja en la segunda prueba no tuvo ningún efecto, esto posiblemente debido a la excesiva poda de la planta, que pudo haber afectado el asentamiento de los depredadores. Sin embargo, no se observaron daños en las frutas.
En un estudio realizado por Mohd Rasdi et al. (2009), los adultos de M. pygmaeus se alimentaron con ninfas de T. vaporariorum, y resultaron efectivos para controlar también otras plagas, especialmente áfidos y trips, en berenjena, tomate y pepino bajo condiciones de invernadero.
Algunos fitófagos son parásitos severos, tales como Labops spp. e Irbisia spp. en Agropyron spp. introducidos en el occidente de los Estados Unidos (Araya y Haws,1988,1991). Se ha observado que algunos míridos se alimentan ocasionalmente de plantas y pueden insertar sus estilos en ellos para obtener savia (Wheeler, 2001). Otro ejemplo es Lygus Hesperus (Knight), una plaga fitozoófaga clave que afecta al algodón y que también es un depredador importante en ese cultivo (Hagler y Naranjo, 2005). Esta acción depredadora se conoce en otras especies, como en Dicyphus errans Wolff (Quaglia et al.,1993) y Creontiades pallidus (Rambur) (Urbaneja et al.,2001), pero no han sido consideradas en IPM.
8 Conclusiones
El presente estudio informa acerca de los tres depredadores fitófagos heterópteros de la mosca blanca, Rambur (anteriormente M. caliginosus Wagner), y sobre todo en Tupiocoris cucurbitaceus (Spinola), que atacó a T. vaporariorum en plantas de tabaco y tomate bajo condiciones de invernadero en Chile, en la región metropolitana, Chile central. Se observó cuidadosamente el follaje de las plantas donde se muestreaba el depredador para descartar cualquier daño a las hojas y especialmente a los tomates.
















