Forma sugerida de citar:
Vásconez-Hernández, A., Sandoval-Valencia, P., Puga-Torres, B., Cueva-Jácome, F. 2017.Seroprevalencia de leucosis enzoótica bovina en animales entre 6 a 24 meses en las provinciasde Manabí, Pichincha y Chimborazo - Ecuador. La Granja: Revista de Cienciasde la Vida. Vol. 26(2):131-141. pISSN:1390-3799; eISSN:1390-8596.
1 Introducción
La Leucosis Enzoótica Bovina (LEB) también conocida como Leucosis Viral Bovina (LVB) es una enfermedad infecciosa persistente causada por un retrovirus estrechamente relacionado con el virus T-linfotrópico humano tipo 1 (HTLV-1) (Rodríguez et al., 2011) que ataca al ganado bovino, el cual afecta principalmente a los linfocitos B (Algorta et al., 2014), produciendo un incremento de su porcentaje en circulación, cuya acumulación puede determinar la aparición de neoplasias, pudiendo diseminarse en distintos órganos (Radostits, 2000). Las formas de manifestación que se observan, incluyen, la presencia de tumores o una linfocitosis persistente (aumento sostenido de linfocitos en sangre) (OIE -Organización Mundial de Sanidad Animal-, 2011).
El mayor problema, radica en que un gran porcentaje de los animales infectados se presentan asintomáticos, siendo esta la principal causa de contagio, y por ende se da poco control en la movilización de los bovinos, por lo que es indispensable monitorear la salud de los animales mediante pruebas serológicas (Gatti Assandri, 2008; OIE, 2011), ya que como se demostró en Japón, se pueden producir múltiples invasiones de cepas de LEB genéticamente diferentes (Matsumura et al., 2011). Incluso se ha indicado que el virus de la LEB podría estar asociado al cáncer de mama en humanos, ya que se ha encontrado el virus en personas con dicha enfermedad (Ochoa et al., 2006).
Todas las razas bovinas, en cualquier fase etaria, son susceptibles a enfermar, observándose esta característica con mayor frecuencia en el ganado lechero en comparación al ganado de carne (Giraudo et al., 2010). La forma de contagio más frecuente, es la transmisión horizontal, por contacto con fluidos corporales contaminados y por vía iatrogénica (Gatti Assandri, 2008). Los insectos hematófagos actúan como vectores de la enfermedad, y a pesar de que no es muy habitual la transmisión vertical, intrauterina o calostral (OIE, 2011) podría provocar en un predio infectado un mayor porcentaje de animales enfermos, con las consecuentes pérdidas económicas para el productor. En estudios realizados en Corea en 30 animales enfermos con LEB, se observaron tejidos neoplásicos en los ganglios linfáticos de todos los animales; también se observaron nódulos en intestino (96,4%), corazón (88,9%), estómago (73,1%) y diafragma (62,5%), sugiriendo que se produce metástasis de la enfermedad (Yoon et al., 2005). Por lo tanto, es necesario un mayor control de LEB con la finalidad de monitorear y dar seguimiento a los animales, principalmente en los más jóvenes, ya que representan mayor riesgo para la producción.
En Ecuador es una patología poco conocida entre ganaderos, por lo que a pesar de su importancia sanitaria, no se han difundido ampliamente las medidas de prevención y control, vías de transmisión e información acerca de los efectos que tiene sobre la producción; adicionalmente, existen pocos datos exactos sobre la prevalencia actual de LEB en el país. Se busca cuidar la calidad de producción para ofrecer localmente alimentos inocuos y con las mismas exigencias de los productos de exportación, estableciendo medidas de control contra varias enfermedades que disminuyen la producción y limitan el alcance al mercado internacional. Una de estas enfermedades es la LEB, no solo por su importancia sanitaria sino por las implicaciones económicas, ya que disminuye ostensiblemente la producción lechera y nacimiento de crías sanas y provoca una caída de la inmunidad, haciendo a los animales afectados más propensos a adquirir otras enfermedades (Chamizo Pestana, 2005), provocando además decomisos significativos y alterando la calidad de la carne, lo que perjudica la rentabilidad del ganadero y obstaculiza las posibilidades de exportación (Betancur y Rodas, 2008).
Por estas razones el objetivo de nuestra investigación fue determinar la seroprevalencia de LEB en animales jóvenes de las provincias de Pichincha, Manabí y Chimborazo (las mayores lecheras del Ecuador) para conocer su estatus sanitario con respecto a esta enfermedad y establecer medidas de control sanitario tempranas, generando una línea base de estudio que permita al Ecuador realizar un programa de control y erradicación de la enfermedad por parte de la Agencia Ecuatoriana de Aseguramiento de la Calidad del Agro (AGROCALIDAD).
2 Metodología
2.1 Población de estudio
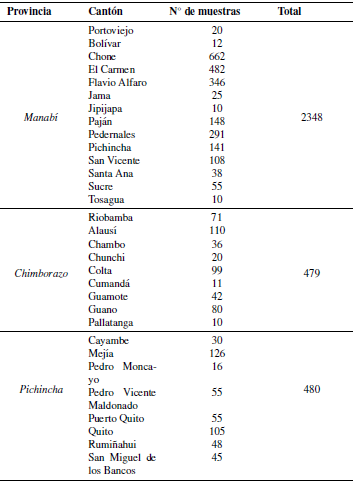
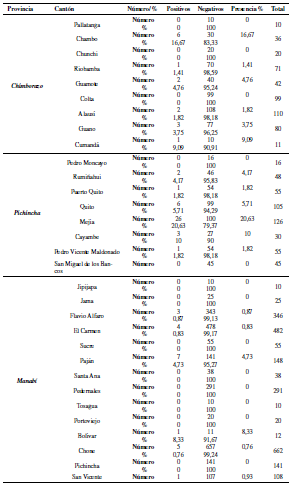
La población estudiada fueron bovinos de entre seis a veinticuatro meses de edad, de tres de las provincias con mayor producción lechera. Se trabajó con 3 307 muestras de suero sanguíneo bovino, obtenidas mediante selección aleatoria estratificada en el Muestreo ecuatoriano de Fiebre Aftosa realizado en el año 2014 (Tabla 1). Del total de muestras, 480 correspondieron a Pichincha (situada al norte del país y en la región interandina); 479 a Chimborazo (centro sur del país y en la región interandina) y 2 348 a Manabí (situada al occidente del país y en la región costa).
2.2 Diseño de la investigación
Estudio descriptivo del hallazgo de LEB en animales jóvenes, manifestada por la presencia de anticuerpos en muestras de suero sanguíneo de dichos animales; por esta razón es un estudio de tipo observacional debido a que las variables en consideración no fueron modificadas, sino que los resultados obtenidos se usaron directamente para su análisis y discusión. Las 3 307 muestras de suero sanguíneo bovino se analizaron con la técnica serológica ELISA indirecto.
2.2.1 Selección de muestras
Con la base de datos del Muestreo Nacional de Fiebre Aftosa, verificamos el código de ingreso de cada muestra, constatando su existencia, procedencia y datos relevantes para la investigación. Se elaboraron los protocolos de trabajo para cada microplaca ELISA, utilizando 40 de las mismas.
2.2.2 Procesamiento de muestras
Se siguieron las instrucciones y recomendaciones del fabricante del kit SVANOVA (2015), tanto para el procesamiento de muestras como para su correcto almacenamiento. Fueron ambientadas (por 20 minutos) las microplacas ELISA, reactivos y muestras. La placa ELISA fue cargada con 100 ul de diluyente en cada uno de los 96 pocillos; depositando 4 ul en los cuatro primeros pocillos, controles positivos y negativos por duplicado y a partir del quinto pocillo las muestras en estudio. Una vez cargadas, el papel adhesivo fue cubierto para evitar contaminación durante la incubación y agitación durante una hora a 37°C. La solución de lavado fue preparada (solución PBS + Tween20) en concentración 1:20. El contenido de los pocillos se lavó (3 veces) con 300 ul de la solución preparada. En cada pocillo colocamos 100 ul de Solución Conjugado, para luego sellar la placa con la misma película adhesiva, dejando incubar la placa en agitación, durante 1 hora a 37°C. Posteriormente realizamos un último lavado, luego de lo cual colocamos 100 ul de Solución sustrato en cada pocillo, que luego de 15 minutos de incubación en oscuridad, reveló la coloración. Para finalizar se añadió 50 ul de solución de Frenado en cada pocillo, para pasar la placa por el Lector de Placas ELISA XChek, el cual es un espectrofotómetro que mide la densidad óptica a 450 nm (longitud de onda).
3 Resultados
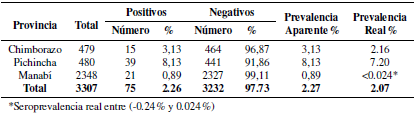
La seroprevalencia aparente total encontrada en las 3 307 muestras de bovinos, entre 6 a 24 meses de edad de las tres provincias de estudio, fue de 2.27%; en cambio la seroprevalencia real, tomando en cuenta los datos de sensibilidad y especificidad del kit (98 - 100%) es de 2.07% (Tabla 2). Se encontró seroprevalencias de 0.89% en Manabí, 3.13% en Chimborazo y 8.13% en Pichincha (Tabla 2).
Tabla 2. Seroprevalencia aparente de LEB en animales jóvenes de las provincias de mayor producción lechera del Ecuador
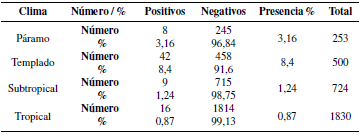
3.1 Presencia de LEB de acuerdo a clima
Con fines didácticos se categorizó de la siguiente manera: Páramo de 2 a 10°C, templado de 11 a 18°C, subtropical de 19 a 23°C y tropical de 24 a 30°C (Tabla 3).
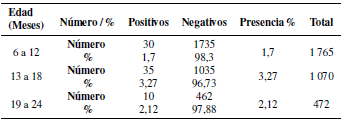
3.2 Presencia de LEB de acuerdo a edad
Para cuantificar el porcentaje de presencia de LEB en animales jóvenes de las provincias de mayor producción lechera se categorizó a los bovinos de 6 a 12 meses, de 13 a 18 y de 19 a 24 meses (Tabla 4).
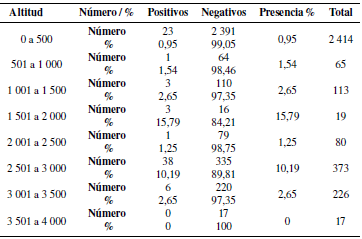
3.3 Presencia de LEB de acuerdo a altitud
Con fines didácticos se categorizó esta variable desde 0 (cero) metros sobre el nivel del mar (msnm) a 500, de 501 a 1000 msnm y de manera sucesiva ascendiendo en grupos de 500 mnsm (Tabla 5).
3.4 Presencia de LEB de acuerdo a propósito del ganado
De acuerdo a la clasificación leche, carne y doble propósito, se encontró que en las provincias estudiadas, el mayor porcentaje de animales positivos a LEB se presenta en animales de leche (4,47%), seguido de un 3,52% en el ganado destinado a carne y 1,02% en bovinos doble propósito (Tabla 6). Tomando en cuenta solo las dos provincias de la Sierra, en 580 animales destinados a producción lechera se encontró un 7.07% de presencia de LEB, en 53 animales correspondientes a ganadería de carne, un 5.66% de animales positivos y un 3.07% en 326 animales muestreados como ganado mixto.
4 Presencia de LEB de acuerdo a las provincias y cantones
Las 3 307 muestras analizadas pertenecen a 268 predios, de los cuales, 100 fueron de Chimborazo, 131 de Manabí y 37 de Pichincha (Tabla 7). En Chimborazo se encontraron 6 predios positivos a LEB (6%), en Manabí 13 (9.92%) y en Pichincha 15 predios positivos (40.54%).
Respecto al sexo de los animales, se encontró que de los 75 animales positivos, 58 fueron hembras (77.33 %) y 17 machos (22.66 %).
En la principal cuenca lechera del Ecuador, el cantón Mejía de la provincia de Pichincha, se encontró un alarmante porcentaje de presencia de LEB (20.63%), posiblemente debido a los sistemas de producción intensivos, que permiten mayor contacto entre animales y humano, mayor estrés y a ineficientes prácticas de bioseguridad, propiciando un mayor contagio de la enfermedad entre animales.
4.1 Análisis estadístico
El análisis estadístico general de chi cuadrado, utilizando un 1% de probabilidad por cada variable, expone que existe una dependencia altamente significativa entre clima, altitud y propósito con la aparición de Leucosis Enzoótica Bovina en animales entre 6 a 24 meses; la variable edad no es determinante para el hallazgo de la enfermedad. Empero, al hacer el mismo análisis por cada provincia, se evidenció que en Chimborazo y Manabí no existe dependencia entre la enfermedad y ninguna de las variables, mientras que en Pichincha se halló una dependencia altamente significativa entre el hallazgo de la enfermedad y las variables clima y altitud (Tabla 8).
5. Discusión
Los resultados indican que no existe una relación significativa entre las variables y el aparecimiento de LEB, pero si una dependencia de la enfermedad con el clima y altitud, ya que se observa una gran diferencia de valores entre la provincia de la costa (Manabí) y la región interandina (Pichincha y Chimborazo), pudiendo indicar una tendencia a presentarse más casos de LEB en ganado lechero. Sin embargo, esta tendencia podría explicarse con las diferencias entre las prácticas de manejo en el ganado lechero y en el de carne, o por el tipo de explotación, ya que se acostumbra criar al ganado de carne en explotaciones extensivas donde no existe mayor contacto y manejo sanitario y nutricional de los animales. Similares resultados fueron reportados por Delgado et al. (2009) donde se manifiesta la elevada relación que existe entre el aparecimiento de LEB y el tipo de explotación, recalcando la trascendencia del factor humano, debido a que las prácticas de manejo intensivas permiten una tasa de contagio mayor, dato que es reafirmado por Bautista et al. (2008) quienes en sus estudios de seroprevalencia en varios departamentos de Colombia, reportan la alta significancia en la asociación con el tipo de explotaciones y la similitud de prácticas ganaderas en animales destinados a producción de leche, en clima frío con hallazgos de prevalencias más altas que en ganado de carne.
En esta investigación, no es perceptible la relación entre animales enfermos y edad, observándose porcentajes muy cercanos, lo que coincide con gran parte de las investigaciones de LEB, ya que las edades en consideración de estudio van desde los tres años en adelante. Puma y Yanza (2013) en su estudio en 3 parroquias del cantón Paute (Azuay-Ecuador) reportan una seroprevalencia del 6.1% de LEB, Bonifaz y Ulcuango (2015) en la Comunidad Santo Domingo 1 de la Parroquia Ayora del Cantón Cayambe (Pichincha-Ecuador) encontró una prevalencia a la infección del 5,6% de un total de 250 muestras, mientras que Torres y Jaramillo (2001), en su trabajo en varias parroquias de Cuenca (Ecuador), reportan seroprevalencias en animales de 4 a 6 años de 20.2%, de 7 a 9 años de 22.22%, de 10 a 12 años 25% y mayores de 12 años una seroprevalencia del 50%, en este estudio observamos un aumento proporcional entre la edad de los animales y la cantidad de enfermos, lo se debe en gran medida a que animales adultos por mayor permanencia en el hato tienen superior probabilidad de contagio, lo cual se menciona también en el estudio de Carrero et al. (2008) en Colombia, donde se tomaron en cuenta animales desde 6 meses de edad, pero con resultados impresionantemente mayores, donde el 54% de animales de 6 meses a 1 años resultaron positivos a LEB, animales de 1 a 2 años 62%, de 2 a 3 años un 75% y mayores de 3 años la seroprevalencia fue del 87%. Así mismo en estudios realizados en 7 prefecturas de Japón (Murakami et al., 2011), la prevalencia general de infección encontrada de LEB fue del 28,6%, de las cuales el ganado lechero (34,7%) fue mayor que en el ganado de engorde (7,9%) y ganado de cría (16,3%). Es interesante mencionar esta investigación, por ser un país fronterizo y representar una potencial amenaza, sea por paso de ganado o posiblemente vectores. En el mismo estudio se concluyó que los vectores (mosquitos y garrapatas) son una importante vía de contagio, pero en Ecuador esta teoría no se sustenta ya que los resultados en clima subtropical y tropical son realmente bajos. También es importante mencionar el estudio de Vallejo (1991) por ser uno de los más extensos, donde se encontró una prevalencia de 14.3% de LEB en haciendas del litoral ecuatoriano (Guayas, El Oro, Manabí, Esmeraldas) pero gran parte de los animales provenían de Costa Rica; sin estos animales, la población de positivos se, mostrándose valores de hasta 5% de prevalencia; esto denota la importancia de un seguimiento y control cuarentenario de los animales que llegan a una Unidad Productiva y el registro respectivo. En esta investigación se encontraron 5 de los 75 animales positivos, que fueron adquiridos, lo cual, si no son examinados a tiempo, representa una amenaza de ser el foco de diseminación del virus en un predio libre o controlado. Nuestros resultados no coinciden con los proporcionados por Algorta et al. (2014), quienes en el sur de Uruguay encontraron una prevalencia entre el 11 y el 75%. Así mismo, en muestras de semen bovino, Ali et al. (2011) encontraron una prevalencia del 20.93% del total de las muestras.
Respecto a los animales positivos, por sexo (hembras 77.33% y machos 22.66%), al comparar este dato con la investigación en Manabí de Zambrano y Burgos (2010) se observa que gran cantidad de terneros (88.30%) y toros (10.64%) reaccionaron positivos a la prueba, y que el 24.52% de terneras y el 66.26% de vacas fueron positivas. Así mismo, se menciona que las vacas en producción significan el mayor porcentaje de animales enfermos y que además son fuente de contagio para animales de menor edad como se evidencia en esta investigación e incluso son fuente de contagio por medio de calostro a terneras con leche de vacas seropositivas; al relacionar con el estudio de Cadavid en Colombia (2012), se expone que se pierde un 5% de la producción anual de vacas positivas y esto representa el doble de lo que estipula la OIE (2.5%) sumado a un 1.3% de descarte.