Introducción
La presencia de antioxidantes en los alimentos es de gran interés debido al efecto beneficioso que tienen para la salud. Numerosos estudios se han realizado para la identificación y caracterización de diferentes compuestos antioxidantes debido a la importancia de estos en la prevención de enfermedades cardiovasculares, inflamatorias y neurológicas; así como también enfermedades cancerígenas y el retardo del envejecimiento (Bravo, 1998; Lichtenthäler & Marx, 2005; Silva, Pompeu, Larondelle, & Rogez, 2007).
Los vegetales y frutas han recibido una atención particular debido a su alta concentración de antioxidantes. En este tipo de alimentos, los compuestos antioxidantes más abundantes son por lo general los polifenoles (Bravo, 1998). Para la purificación de estos compuestos a nivel de laboratorio, se han probado principalmente: cromatografía de fase reversa con Sephadex (Mazza & Velioglu, 1992) o cromatografía iónica (Gil, Tomás-Berberán, Hess-Pierce, Holcroft, & Kader, 2000) y resinas absorbentes, que han sido ampliamente utilizadas para aislamiento, purificación, recuperación y concentración de antocianinas(Chandra, Nair, & Iezzoni, 1993; Liu, Xiao, Chen, Xu, & Wu, 2004; Liu et al., 2007; Scordino, Di Mauro, Passerini, & Maccarone, 2004; Silva, Pompeu, Larondelle, & Rogez, 2007). Sin embargo, no se encontró ningún estudio para la separación de polifenoles utilizando tecnología de membranas. Mediante esta tecnología se podrían separar selectivamente, de acuerdo al tamaño de la molécula, polifenoles de diferente peso molecular (Scott, 1995; Coronel, 2012). Además esta tecnología puede fácilmente aplicarse a nivel industrial para la obtención de diferentes tipos de polifenoles.
El tomate de árbol morado es una fruta originaria de Sudamérica que contiene fitoquímicos como betacarotenos y algunas antocianinas a las cuales se les ha asociado la propiedad de disminuir la concentración de colesterol en sangre y proteger contra el avance de enfermedades degenerativas (Vasco, 2005).
El objetivo de este trabajo es evaluar el uso de tecnología de membranas y de la resina XA 5071 FG para la separación y la concentración de polifenoles y antocianinas del tomate de árbol. La separación y concentración de polifenoles se realizó en las fracciones comestibles así como en la cáscara del tomate de árbol morado, ya que según Vasco (2005) la mayor parte de polifenoles se encuentran en la cáscara de la fruta.
Metodología
Se utilizó tomate de árbol morado gigante maduro, procedente de Baños, provincia de Tungurahua, Ecuador. Las frutas fueron lavadas, peladas, cortadas y se separó de la cáscara (exocarpio), el mesocarpio y la placenta que contiene las semillas. Con el mesocarpio y la placenta se realizaron pulpas sin añadir agua. Las tres fracciones separadas se guardaron a -21 °C.
Se realizó una hidrólisis enzimática de la siguiente manera: las pulpas del mesocarpio y la placenta se descongelaron y dejaron que alcance 30 o 20 °C respectivamente. Las cáscaras se trituraron y se añadió agua en una proporción agua:cáscara 3:1. La hidrólisis en todos los casos se realizó por 30 minutos con el coctel enzimático Rapidaza Vegetable Juice© con las siguientes condiciones de trabajo: (a) pulpa del mesocarpio 30 °C, (b) pulpa de la placenta 20 °C, (c) cáscara 20 °C; en todas las muestras se añadió 1 mL de enzima/kg de muestra. La separación mediante tecnología de membranas de los polifenoles contenidos en el tomate de árbol se realizó usando los siguientes equipos: una unidad piloto de microfiltración tangencial de la sociedad TIA, equipada con una membrana cerámica Membralox de 0,2 µm de diámetro de poro, y una membrana de Rhodia de 10 µm de diámetro de poro, ambas con una superficie de 0,2 m2 y un módulo a escala de laboratorio diseñado por el grupo de investigación y equipado con membranas de Rhodia de 80 cm² de superficie y diámetros de poro entre 0.45 µm y 15 kDa. El proceso de concentración por ósmosis inversa se realizó en el módulo B1 (Aquious-PCI) de 18 membranas tubulares AFC99 de poliamida, con un área filtrante de 0,9 m2.y una retención aparente del 99% de NaCl a 60 bar y 25 ºC
Los jugos hidrolizados fueron procesados en la unidad piloto para microfiltración, y el clarificado obtenido se usó como alimentación para: la micro y ultrafiltración en el módulo de laboratorio, la concentración por ósmosis inversa en el módulo B1 y en los procesos de purificación y concentración utilizando la resina XA 5071 FG.
Las pruebas preliminares se realizaron usando membranas cerámicas con los siguientes tamaños de poro: 10 µm, 0,45 µm, 0,2 µm, 0,1 µm, 300 kDa, 150 kDa, 50 kDa y 15 kDa. A base de estos resultados se realizaron pruebas para la separación de polifenoles del mesocarpio, placenta y cáscara usando las siguientes membranas: 0.2 µm, 0,1 µm, 150 kDa, y 15 kDa. En la micro y ultrafiltración se fijaron las siguientes condiciones de operación: presión de 2.5-3.0 bar, temperatura de 25-30 °C, flujo de recirculación para la unidad piloto de 1000 l.h-1, para el módulo de laboratorio de 1 l.h-1 y para la concentración por ósmosis inversa la presión fue de 52 bar y temperatura de 25 ºC; se utilizó el factor de retención volumétrico (FRV = volumen de la alimentación /volumen de retenido) para medir el rendimiento de los procesos.
Para el proceso de concentración de los polifenoles con resina se utilizó la resina XA 5071 FG que es un polímero adsorbente, no iónico, hidrófobo que permite la adsorción de especies hidrófobas de solventes polares. Se presenta bajo la forma de pequeñas esferas porosas cuyo tamaño promedio es de 0,65 + 0,05 mm con una área específica de 800 m2/g. Las materias primas fueron jugos clarificados de placenta, pulpa y cáscara de tomate de árbol (Solanum betaceum Cav), obtenidos de la microfiltración con una membrana cerámica de tamaño de poro de 0,2 µm. El proceso de concentración se realizó con una columna de vidrio de diámetro interno de 1,5 cm, altura útil 50 cm y una bomba peristáltica. La relación jugo clarificado de placenta: agua para el proceso de concentración fue de 1:1, los otros jugos no se diluyeron. Para cada proceso se realizó una repetición. En la fase de adsorción la columna fue cargada con 40 mL de resina previamente hidratada con agua desgasificada a 40 ºC, se debe cuidar que la resina permanezca sumergida dentro del líquido durante todo el proceso. El volumen V en mL de resina utilizada corresponde a 1BV (Bed Volume). El jugo fue bombeado a temperatura ambiente y pasó a través de la cama de resina con un flujo de 80 mL/h. Con el propósito de eliminar azúcares y ácidos restantes en la resina luego de la adsorción se realizó el lavado con agua fría manteniendo el flujo. La desorpción se realizó con etanol al 70 % y se obtuvieron seis eluatos de 20 mL. Las muestras sometidas a los diferentes análisis fueron los jugos clarificados utilizados como materia prima y la mezcla de los dos eluatos con mayor contenido de polifenoles totales, denominada eluato de mayor concentración.
La medición de pH se realizó utilizando un pHmetro Orion modelo 210A, según la norma ISO 1842 (1991). Para la determinación de acidez titulable se utilizó la norma AOAC 942.15 37.1.37, 2000 y los sólidos solubles totales se determinaron de acuerdo con la norma AOAC 932.12 37.1.15, 2000 (Horwits, 2000). El contenido de fructosa, glucosa y sacarosa se realizó de acuerdo con la Norma chilena, NCh 574 (2007). Las concentraciones de calcio y hierro se determinaron por espectrofotometría de absorción atómica, y la de sodio por emisión atómica, previa digestión por microondas (Abdulla, 1986).
Para determinar el contenido de polifenoles solubles totales se utilizó el método de Folin-Ciocalteu´s (Georgé, Brat, Alter, & Amiot, 2005) con un espectrofotómetro marca Shimadzu modelo UV-160A. La cuantificación de vitamina C, ácido cítrico, ácido tartárico y ácido málico se realizó utilizando el método descrito por Macrae (1988) modificado y validado en los laboratorios del DECAB de la Escuela Politécnica Nacional (Quito). La cuantificación de carotenos se realizó de acuerdo con el método descrito por Pettersson y Jonsson (1990).
La medición de la capacidad antioxidante se realizó con el método de la capacidad de absorbancia de radicales de oxígeno (ORAC). Trolox, fluoresceína y 2,2´-azobis (2-amidinopropano) dihidrocloruro (AAPH) fueron comprados a Aldrich. Los análisis de ORAC se realizaron en un espectrofluorímetro de placas marca TECAN. La longitud de onda de excitación y emisión fueron de 485 nm y 520 nm respectivamente. Las soluciones de AAPH, Fluoresceína y Trolox fueron preparadas con la solución buffer de fosfato de 75 mM (pH 7,4). Como blanco se utilizó la solución buffer de fosfato de 75 mM (pH 7,4) y soluciones de trolox de 0 a 40 μM fueron usadas como estándares. Las muestras fueron diluidas con buffer de fosfato de 75 mM. Se colocó 180 μL de agua en las celdas exteriores de la placa y 160 μL de Fluoresceína y 20 μL de la muestra diluida en las celdas interiores. Las muestras y los estándares fueron analizados por duplicado. Los valores finales fueron calculados usando la regresión de la ecuación entre la concentración de trolox y el área neta bajo la curva del decaimiento de la fluorescencia y fueron expresados como micromoles de Trolox por litro de muestra.
Para el análisis de los compuestos fenólicos se utilizó un HPLC con detector de arreglo de diodos y una columna lichrospher 5 CD2 4,6 x 250 mm; para la elusión de los polifenoles se utilizó la solución A (2 % de ácido fórmico y 98 % de agua) y la solución B (80 % acetonitrilo, 2 % ácido fórmico y 2 % agua) el gradiente de la solucione B fue: los primeros 50 min 3 %; de 50 a 55 min se incrementa del 3 % al 35 %, de los 55 a los 60 min se llega al 50 %, de los 60 a los 62 min se utilizó el 80 % y de los 62 a 65 min el 100 %. El tiempo total de elusión fue 65 min y el flujo fue de 0.5 mL/min.
Resultados
Los resultados de ultrafiltración de las muestras del mesocarpio se presentan en la Figura 1, en todos los ensayos se utilizó la membrana del fabricante Rhodia. Como se puede observar no existe una influencia importante del diámetro de poro de la membrana en el flujo de permeado, debido probablemente a que las muestras utilizadas en el equipo piloto de laboratorio son jugos clarificados, y por lo tanto el colmataje de la membrana es mínimo.
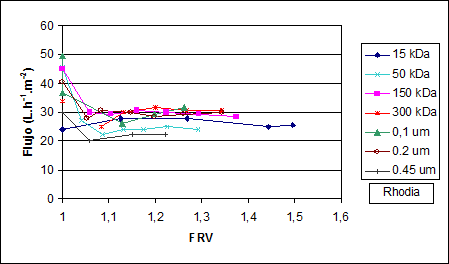
Fig. 1: Variación del flujo y el Factor de retención volumétrico (FRV) en la ultrafiltración del clarificado del mesocarpio (3 bar, 20ºC, equipo de laboratorio)
En la Figura 2, equipo de laboratorio, se observa que los flujos de permeado se incrementan con el tamaño de poro de la membrana, y esto indica que debe existir retención de ciertos compuestos en las membranas de 15 kDa y 150 kDa ya que los flujos obtenidos con estas membranas son los más bajos.
En la filtración para la separación de los polifenoles de la cáscara del tomate de árbol, se encontraron ciertos problemas debido a la formación de espuma. Sin embargo, luego de realizar la primera filtración con la membrana de 0,2 (m, el clarificado obtenido es fácil de manejar. En efecto, se pudo observar que el flujo obtenido al tratar el clarificado en microfiltración con tamaño de poro inferior a 0,2 (m, este era igual o superior que el obtenido con la membrana de 0,2 (m.
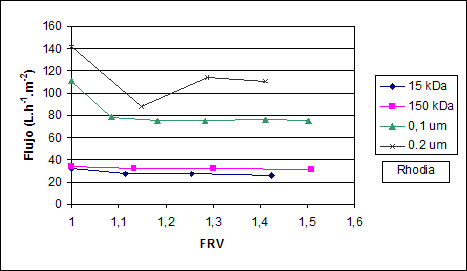
Fig. 2: Variación del flujo y el Factor de retención volumétrico (FRV) en la ultrafiltración del clarificado de la placenta (3 bar, 20 ºC, equipo de laboratorio)
En la Figura 3, se observa que el uso de etanol para extraer polifenoles en la cáscara, presentó ventajas en el proceso de filtración. El flujo de permeado medido en el equipo piloto, fue varias veces superior al tratamiento del jugo que contiene solamente agua.

Fig. 3 Variación del flujo y Factor de retención volumétrico en la microfiltración del jugo de la cáscara con etanol (3 bar, 32 ºC, equipo piloto)
En las Tablas 1y 2 se presenta la caracterización de las muestras de tomate de árbol sometidas a micro y ultrafiltración.
Como podría esperarse, se observa que el pH, los grados Brix y la acidez titulable permanecen constantes en todas las fracciones y en todos los tratamientos. Esto se debe a que las moléculas de los azúcares y ácidos orgánicos, compuestos responsables de dichas propiedades, tienen un tamaño inferior al tamaño del poro de las membranas utilizadas. En efecto se conoce que estas moléculas son solo retenidas por nanofiltración o en ósmosis reversa (Scott, 1995).
Tabla 1 Propiedades de las fracciones obtenidas en la micro y la ultrafiltración de la pulpa del mesocarpio.
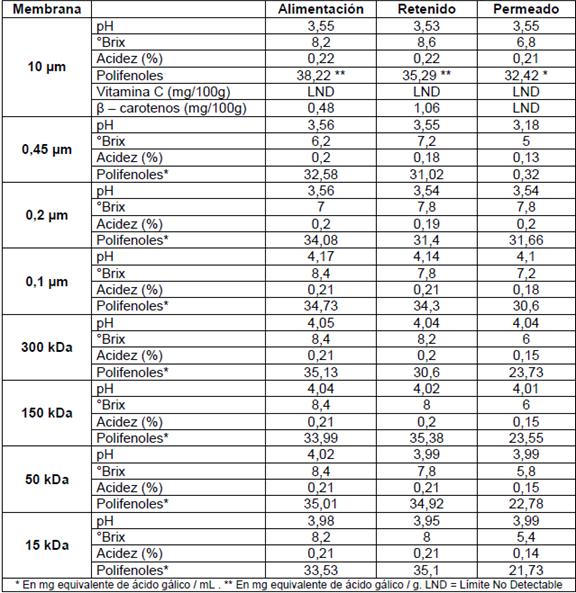
La alimentación de todos los procesos de microfiltración contiene β-carotenos; sin embargo, en el permeado la concentración de estos se encuentran bajo el límite de detección, se puede concluir que los β-carotenos son retenidos por las membranas en la microfiltración tanto a 10 µm como a 0,2µm.
De los resultados presentados en la Tabla 2, se determina que la fracción de tomate de árbol en la que se encuentra la mayor concentración de vitamina C es la placenta ya que en las otras fracciones, cáscara y mesocarpio, los valores de vitamina C se encuentran bajo el límite de detección.
En la Tabla 2 Se observa que las alimentaciones de los diferentes procesos de ultrafiltración para la placenta (0,1 µm, 150 kDa y 15 kDa) tienen vitamina C; sin embargo, en el retenido y el permeado la concentración de vitamina C se encuentra bajo el límite de detección lo que nos indica que el proceso deterioró esta vitamina.
Tabla 2 Propiedades de las fracciones obtenidas en la ultrafiltración de la pulpa de la placenta (piloto de laboratorio).
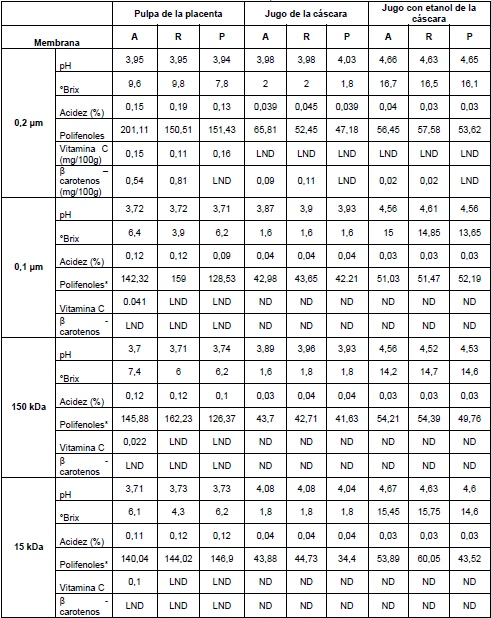
*Concentración de polifenoles totales en mg Ác. Gálico/100 mL. Alimentación (A), retenido (R) y permeado (P).
LND = Límite No Detectable. ND = No determinado.
Se puede observar en Tablas 1y 2 que las membranas de 10 (m a 0,2 (m no producen ningún cambio para todos los jugos en la concentración de polifenoles ya que esta es similar tanto para la alimentación, permeado y retenido. Esto indica que estas membranas no logran retener estos compuestos. Sin embargo, en las membranas de 0,1 (m hasta la de 15 kDa se observa una disminución de la concentración en el permeado. Estos primeros resultados parecen indicar que al utilizar membranas de tamaño de poro inferior a 0,1 (m, se podría separar polifenoles diferentes tamaños moleculares.
Sin embargo, al realizar análisis de las fracciones de la placenta obtenidas del proceso de 15 KDa utilizando HPLC se observó que el perfil de polifenoles es similar. Por lo tanto con las membranas utilizadas no se logró el fraccionamiento de los polifenoles utilizando el tamaño de poro como medio de selección.
La tecnología de membranas es muy versátil y si bien no se pudo modificar la distribución de polifenoles en el permeado y retenido de los procesos de ultrafiltración con membranas de tamaño de poro de hasta 15 KDa; la ósmosis inversa es una alternativa para concentrar los compuestos antioxidantes de interés.
En la concentración de jugo clarificado de placenta de tomate de árbol el flujo de permeado decrece durante el proceso (Figura 4). La concentración de los jugos clarificados se realizó en una configuración por lotes con un flujo inicial de permeado alto que redujo el volumen de la alimentación y concentró rápidamente el jugo incrementando la presión osmótica y reduciendo el flujo de permeado. Un comportamiento semejante fue reportado por Matta et al. (2004) y Marcillo et al. (2007) durante la concentración de jugo de acerola y mora respectivamente (Marcillo et al., 2007; Matta, Moretti, & Cabral, 2004).
El flujo medio del permeado fue de 39 y 42 L.h-1m2 para el jugo clarificado de placenta y cáscara de tomate de árbol, respectivamente. Según Marcillo (2010) el flujo medio del permeado del jugo clarificado de tomate de árbol morado procesado a las mismas condiciones fue de 22,8 L.h-1m2 , esta diferencia puede deberse a que el jugo clarificado utilizado tiene sustancias del mesocarpio que dificultan el paso de permeado a través de la membrana, lo cual no sucede con el jugo clarificado de placenta ni de cáscara. La concentración alcanzada en los procesos no llegó hasta el límite de la presión osmótica debido al sistema de procesamiento por lotes que redujo rápidamente el volumen de alimentación.
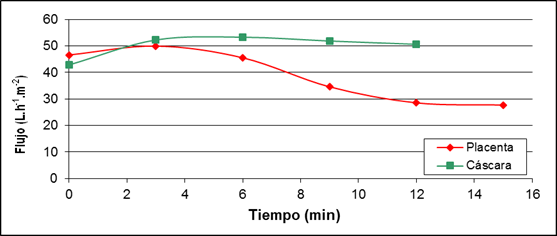
Fig. 4: Comportamiento del flujo de permeado durante el proceso de ósmosis inversa del jugo clarificado de placenta y cáscara de tomate de árbol.
El flujo de permeado se reduce con mayor rapidez para el jugo de placenta que para el jugo de cáscara debido a que el jugo de placenta inicia con mayor cantidad de sólidos solubles por lo que tiene una mayor presión osmótica que se opone al paso del permeado. Sin embargo, no se alcanza el límite de la presión osmótica que impediría el paso del permeado obteniendo flujos cercanos a cero debido al modo de operación por lotes, con valores de flujo de permeado altos. El factor de concentración volumétrica para la placenta fue de 2,0 y para la cáscara de 2,2
El contenido de sólidos solubles (ºBrix) se incrementa durante el proceso de concentración de los jugos clarificados desde un valor de 5,2 y 2 ºBrix hasta alcanzar 13,6 y 4,8 ºBrix en los jugos encentrados de placenta y cáscara respectivamente, obteniéndose las curvas típicas del proceso (Figura 5). Los factores de concentración obtenidos fueron 2,6 y 2,5 veces para placenta y cáscara son semejantes al obtenido por Marcillo (2010) para el jugo de tomate de árbol morado que fue de 2,8 (Marcillo et al., 2007).

Fig. 5: Variación de los sólidos solubles durante la concentración por ósmosis inversa de jugo clarificado de placenta y cáscara de tomate de árbol.
En la Tabla 3 se observa que la mayor parte de las moléculas de los jugos clarificados fueron retenidas por la membrana, la concentración de los polifenoles del jugo clarificado de placenta se incrementa en un 54 %, mientras que la concentración de antocianinas y la capacidad antioxidante lo hacen en un 160 % y 143 % respectivamente, estos resultados indican que la capacidad antioxidante del jugo de placenta se debe en gran medida a las antocianinas contenidas en el mismo.
En el permeado no se detectaron polifenoles ni presentó capacidad antioxidante, esto indicaría que estas sustancias se retienen en un 100 %. El factor de concentración para los ácidos orgánicos y los azúcares fue de 4,6 y 3,4 veces respectivamente. Resultados similares fueron obtenidos por Marcillo (2010) en la concentración por ósmosis inversa de jugo de tomate de árbol morado, naranjilla y mora (Marcillo, 2010).
Para el jugo clarificado de cáscara de tomate de árbol gigante se puede observar que el factor de concentración de polifenoles fue de 2,4; al igual que el factor de la capacidad antioxidante, por lo cual podemos deducir que tienen una relación proporcional, ya que en permeado no se detectaron estos compuestos ni presentó capacidad antioxidante. Marcillo (2010) reportó resultados similares a los obtenidos en este estudio para los demás compuestos concentrados (Marcillo, 2010).
Tabla 3 Caracterización de jugos clarificados y concentrados por ósmosis inversa de placenta y cáscara de tomate de árbol morado

LND: Límite no detectable. ND: No determinado.
En la concentración de los polifenoles utilizando la resina XA 5071 FG, tanto para el mesocarpio, placenta y cáscara en segundo eluato se obtuvo la mayor concentración de polifenoles. Como se puede observar en la Figura 6 la fracción dos concentró el 42 % de los polifenoles de la pulpa; mientras que para la placenta esta fracción retuvo el 56 % y 60 % de polifenoles de la cáscara.
Los análisis se realizaron en mezcla de los eluatos dos y tres, ya que contienen el mayor porcentaje de polifenoles y se le llamó eluato de mayor concentración.
La capacidad antioxidante medida según el método ORAC de los eluatos de mayor concentración tanto de la placenta como de la cáscara tienen valores similares a los reportados por Ou (2001) para jugo de arándano y uva de 34659 y 31441µM equivalentes de trolox /L de muestra, respectivamente (Ou, Hampsch-Woodill, & Prior, 2001).
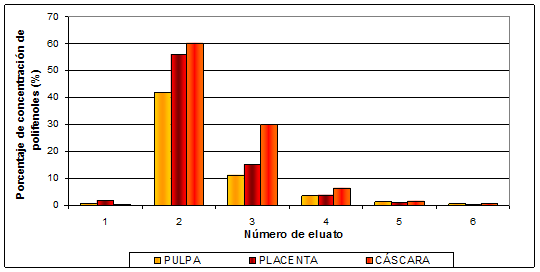
Fig. 6: Evolución del porcentaje de concentración de la cantidad de polifenoles por orden creciente de las fracciones eluidas sobre la resina XA 5071 FG.
Los resultados de la Tabla 4 muestran que en todos los casos, el contenido de polifenoles del eluato de mayor concentración es mucho más alto que el contenido de los jugos clarificados, así, para el mesocarpio es 2,7 veces mayor que en el jugo clarificado, mientras que para la placenta y la cáscara el contenido es mayor en 4 y 4,5 veces respectivamente.
Los resultados de los cromatogramas de las muestras estudiadas se expresan como ácido clorogénico para la longitud de onda de 320 nm mientras que para la longitud de onda de 520 nm se expresan como cianidina-3-glucósido. La concentración de polifenoles determinados como ácido clorogénico es mayor en el eluato de mayor concentración que en los jugos clarificados. Para el mesocarpio la concentración se duplicó, para la cáscara se triplicó, mientras que para la placenta el eluato de mayor concentración contiene 16 veces la cantidad de polifenoles que la contenida en el jugo clarificado. El eluato de mayor concentración de la placenta contiene el doble de la concentración de antocianinas como cianidina-3-glucósido, que el jugo clarificado mientras que para la cáscara y pulpa el contenido de antocianinas no fue detectable.
Los eluatos de mayor concentración presentan mayor capacidad antioxidante que los jugos clarificados. Para el mesocarpio la capacidad antioxidante se intensifica en 3,7 veces, mientras que para la placenta la capacidad antioxidante se cuadruplica y para la cáscara la capacidad antioxidante en 5,5 veces.
En el proceso de concentración del jugo clarificado de placenta utilizando resina el contenido de polifenoles totales y la capacidad antioxidante se cuadruplicaron, el contenido de antocianinas se incrementó en 1,8 veces; mientras que en el proceso de ósmosis inversa los factores de concentración son inferiores. Así, el contenido de polifenoles totales y capacidad antioxidante se incrementó en 1,5 y 2,5 veces respectivamente y el aumento del contenido de antocianinas fue de 2,6 veces. Los factores de concentración del jugo clarificado de cáscara siguieron la misma tendencia; la concentración de polifenoles totales alcanza un factor de 4,5 y la capacidad antioxidante de 5,5; valores superiores a los obtenidos con ósmosis inversa que fueron de 2,5.
Tabla 4 Caracterización del jugo clarificado y el eluato de mayor concentración de las fracciones de tomate de árbol en el proceso concentración utilizando la resina XA 5071 FG
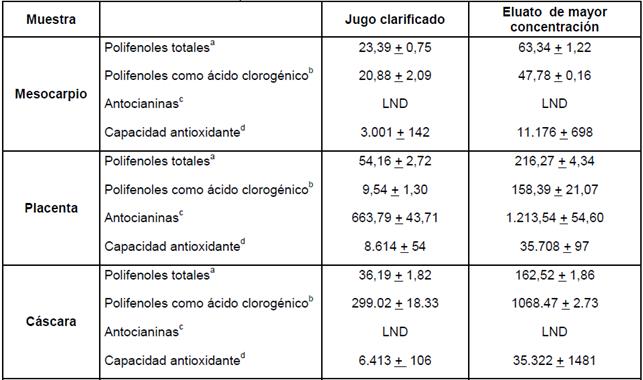
a Expresado en equivalente de ácido gálico mg /100g de muestra, media + desviación estándar, n= 2, tres determinaciones; b expresado en mg /L de muestra, media + desviación estándar , n= 2, una determinación; cexpresado en mg /L de muestra, media + desviación estándar , n= 2, una determinación; d Expresado en equivalente de trolox µM/L de muestra, media + desviación estándar , n= 2, dos determinaciones; LND: Límite No Detectable.
4. Conclusiones y Recomendaciones
La utilización de la resina XA 5071 FG permitió obtener los mejores resultados para concentrar polifenoles de jugos clarificados de mesocarpio, placenta y cáscara de tomate de árbol morado. Así, la concentración de polifenoles y capacidad antioxidante se incrementaron en 4,5 y 5,5 veces respectivamente para la cáscara y en cuatro veces para la placenta; estos factores son superiores a los obtenidos en ósmosis inversa.
La ósmosis inversa permitió concentrar los compuestos antioxidantes de interés pero debido al modo de operación, no se alcanzó el límite de la presión osmótica que impediría el paso del permeado obteniendo flujos cercanos a cero y la concentración máxima de los compuestos de interés.














