Introducción
La enfermedad cerebrovascular (ECV) constituye un problema de salud mundial, encontrándose entre las primeras causas de muerte y discapacidad. En el 2019 se reportaron en Latinoamérica y el Caribe, 708.355 casos (1), y en Cuba, 9891 defunciones por esta causa (2). Una de las patologías de ECV es la trombosis venosa cerebral (TVC), que a pesar de ser infrecuente puede resultar altamente letal.
El cerebro cuenta con dos sistemas para su drenaje venoso, uno superficial y otro profundo que drena hacia los Senos Venosos Durales (SVD): sagital superior (SSS), sagital inferior (SSI), laterales (SL), cavernoso y seno recto (SR) (3).
La TVC es un trastorno trombótico que produce oclusión de uno o más SVD, a menudo en combinación con trombosis de venas corticales. Las venas cerebrales no acompañan las divisiones del territorio arterial, carecen de válvulas y de las capas típicas de las paredes de los vasos en su recorrido, lo que permite dilatación y movimiento del flujo sanguíneo en cualquier dirección en caso de obstrucción (4).
La primera descripción de esta entidad, es atribuida al médico francés M. Ribes, que en 1825 reportó un paciente con cefalea intensa, delirio y convulsiones, confirmándolo patológicamente como secundario a trombosis del seno longitudinal superior y senos laterales (3)(5).
Se estima una incidencia anual de 3 a 4 casos de TVC por millón de habitantes, afecta mayormente a mujeres en edad fértil, siendo 3 veces más común en este sexo, probablemente debido a factores de riesgo (FR) específicos de género, como el uso de Anticonceptivos Hormonales Orales (AHO), embarazo, puerperio y terapia de reemplazo hormonal (4)(5)(6)(7).
La incidencia real de TVC en Cuba se desconoce, son pocos los casos expuestos en la literatura (existiendo predominio de las afectaciones en el sistema de drenaje superficial) pero se supone un comportamiento similar al descrito mundialmente, representando el 0.5 % de todas las ECV (5).
Ante tal contexto se propone como objetivo: presentar un caso infrecuente de Trombosis del Sistema Venoso Cerebral Profundo, asociado a infarto venoso, secundario al uso prolongado de AHO.
Presentación del caso
Paciente femenina de 28 años, psicóloga de profesión, con ligero sobrepeso y antecedentes de uso de AHO durante 5 años consecutivos, sin otras comorbilidades asociadas. Acude al servicio de urgencias del Hospital “Arnaldo Milián Castro” con cuadro clínico de cefalea holocefálica opresiva, de curso progresivo, acompañada de vómitos y diplopía, de 6 días de evolución, refractaria a tratamiento. En el examen físico se aprecia consciente con tendencia a la obnubilación, hipobulia, bradilalia, bradipsiquia, paresia del VI par craneal (izquierdo) y signo de Babinski bilateral.
Es valorada por el Servido de Neurología del centro. Se realiza fondo de ojo (FO) que muestra elevación de ambas papilas ópticas con borramiento de los bordes, pulso venoso ausente e hiperemia papilar, presencia de hemorragia en llamas y exudado algodonoso, todas ellas características típicas de un papiledema desarrollado bilateral (Figura 1).
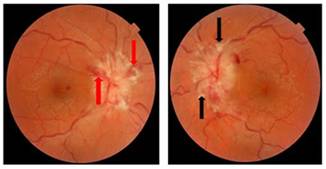
Figura 1 Fondo de ojo. Se observa elevación de la papila óptica, con borramiento de los bordes, pulso venoso ausente e hiperemia papilar. Presencia de hemorragia en llamas (flecha roja) y exudado algodonoso (flecha negra).
Se indica Tomografía Axial Computarizada (TAC) de cráneo no contrastada que evidencia hiperdensidad a nivel de las venas cerebrales internas, vena de Galeno y seno recto (ver Figura 2); que sugiere la presencia de trombos intraluminares (signo directo), así como hipodensidad y pérdida de la relación sustancia gris/blanca a nivel de los núcleos de la base, bilateralmente, en relación con edema cerebral focal secundario a infarto en el territorio venoso profundo (signos indirectos). Ante la presencia de signos directos e indirectos de Trombosis del Sistema Venoso Profundo (TSVP) complicada con un infarto venoso, se decide su ingreso en unidad de ICTUS bajo estrecha vigilancia neurológica. (Figura 2)
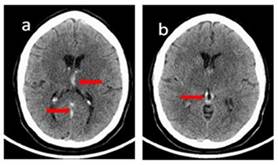
Figura 2 Tomografía Axial Computarizada no contrastada. a Se observan trombos intraluminares en venas cerebrales internas y seno recto (signo directo). b Se observa trombo intraluminar a nivel de la vena de Galeno (signo directo). Se evidencia pérdida de la relación sustancia gris/blanca a nivel de los núcleos de la base, bilateralmente, en relación con edema cerebral focal secundario a infarto en el territorio venoso profundo (signos indirectos).
Se inicia anticoagulación con heparina de bajo peso molecular (HBPM: Fraxiheparina), 1 vial por vía subcutánea (SC) cada 12 horas, la cual se mantuvo durante 10 días. Además, se emplean medidas antiedema cerebral con diuréticos: osmótico (Manitol: 1.5g/kg, por vía endovenosa), y del asa (Furosemida: 40mg/día por vía endovenosa); y analgesia (Espasmoforte: 1 ámpula vía endovenosa cada 8 horas, ámpulas de 50 mg camilofilina y 1.25 g metamizol sódico en 5 ml). A las 24 horas se aprecia una notable mejoría sintomática.
En sala se solicita una Resonancia Magnética Nuclear (RMN) con secuencias T2-FLAIR, Difusión y secuencias vasculares (TOF, Angio-Resonancia) que revela extensa área que se comporta hiperintensa en T2-FLAIR y restringe ligeramente en difusión, a nivel de los núcleos de la base y el tálamo de manera bilateral, compatible con edema cerebral focal secundario a infarto en el territorio venoso profundo (signos indirectos). Además, ausencia de flujo venoso a nivel de Seno recto, Vena de Galeno y Venas Cerebrales Internas en la Angio-Resonancia con Secuencias TOF (en 2 dimensiones); lo cual confirma el diagnóstico de TSVP, asociada a infarto en el territorio venoso correspondiente (Figura 3).
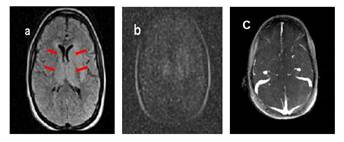
Figura 3 Resonancia Magnética Nuclear. a T2-FLAIR: Se observa hiperintensidad que involucra núcleos de la base y tálamo, bilateralmente, en relación con infarto en el territorio venoso profundo. b Difusión: Ligera restricción a la difusión a nivel de núcleos de la base y tálamo bilateralmente (signos indirectos). c Angio-Resonancia con Secuencias TOF (2D): Ausencia de flujo venoso a nivel de Seno recto, Vena de Galeno y Venas Cerebrales Internas.
Además se indican otros exámenes complementarios para determinar posibles causas relacionadas, resultando todos anodinos a excepción del dímero D (Glicemia: 5.6 mmol/l, Colesterol: 4.2 mmol/l, Triglicéridos: 1.4 mmol/l, Dímero D: 597 ug/l, Tiempo de Sangramiento: 3 minutos, Tiempo de coagulación: 9 minutos, Tiempo de Protrombina (TP): 14 segundos, Tiempo Parcial de Tromboplastina (TPT): 35 segundos, Conteo de plaquetas: 200/109/l, Razón Internacional Normalizada al ingreso (INR): 1.2, C3: 1.1 g/l, C4: 0.2 g/l, IgA: 2.5 g/l, IgG: 9.8 g/l, IgM: 0.9 g/l, IgE: 120 kU/l, Factor Reumatoideo: 10 U/l, Proteína C reactiva: 3 mg/l, ANCA, ANA, Anticoagulante Lúpico, Anticuerpos Anticardiolipinas, Anticuerpos Anti-Beta2-glicoproteina I (ABETA2-GPI), VIH: negativos, Anticuerpos anti Hepatitis C, Antígeno de superficie de Hepatitis B, VDRL: no reactivas.
La paciente estuvo ingresada durante 21 días. Al alta hospitalaria se indicó anticoagulación con dicumarínico: Warfarina 4 mg/día en dosis única (tableta de 2 mg) por vía oral, durante 3 meses, con el objetivo de alcanzar INR entre 2-3. Evolucionó favorablemente, se mantuvo anticoagulada en el rango óptimo deseado durante 3 meses, y el agente causal (AHO) fue suspendido. Los exámenes para descartar colagenopatías se realizaron en el momento del ingreso, fueron repetidos a los 3 y a los 6 meses después de suprimida la anticoagulación, resultando negativos. Hasta la fecha (3 años después con seguimiento en consultas) no ha presentado recurrencias del evento trombótico, lo que le ha permitido reincorporarse y mantenerse vinculada a las actividades laborales y de la vida diaria.
Discusión
El drenaje venoso cerebral puede ser dividido en SVD, Venas corticales superficiales (VCS) y Venas cerebrales profundas (VCP). Lo SVD reciben el drenaje venoso de los hemisferios cerebrales, VCS, diploicas, meníngeas y venas emisarias, y se dividen en dos grupos: Posterosuperior (SSS, SSI, SR, prensa de Herófilo, SL y bulbos yugulares) y Anteroinferior (seno petroso superior e inferior, seno cavernoso, plexo venoso del clivus y el seno esfenoparietal). Las VCS drenan la sangre venosa de la corteza cerebral y una porción de la sustancia blanca subyacente, comprenden la vena anastomótica superior (de Trolard) y la vena anastomótica inferior (de Labbé). Las VCP drenan los ganglios basales y sustancia blanca profunda, y está formado por dos niveles: sistema venoso transcerebral y por las venas subependimarias, cerebrales internas, vena basal de Rosenthal y vena de Galeno (3)(4).
La patogénesis de la TVC es compleja y multifactorial. Existen dos mecanismos fisiopatológicos: trombosis de senos cerebrales principales y trombosis de venas corticales. La oclusión del primero bloquea el transporte del líquido cefalorraquídeo, disminuye su absorción y consecuentemente produce HE. La oclusión de venas corticales obliga a la sangre venosa a retornar a pequeños vasos y capilares, incrementándose las presiones a este nivel. Esto, en combinación con el flujo de retorno provocan una ruptura de la barrera hematoencefálica y disminución de la perfusión, originando isquemia cerebral focal, edema citotóxico o hemorragia intracerebral (4).
Vaca Villanueva M, y col. (4) clasifican los FR en temporales y permanentes. Los temporales contemplan los género-específicos (más común en mujeres), tratamiento quimioterápico y otras condiciones transitorias que afectan la región de cabeza y cuello. Los permanentes incluyen: estados protrombóticos hereditarios, malignidades, y desórdenes mieloproliferativos. En esta paciente, fueron descartados los Trastornos del Colágeno (reconocidas causas de trombosis), resultando negativos los complementarios correspondientes.
El uso prolongado AHO se ha descrito como una factor importante en la patogénesis de esta entidad. Estos modifican la hemostasia por acción hormonal directa sobre la síntesis de proteínas en el hepatocito o, por acción intermediaria de sustancias como SHBG (sex hormone binding globulin) o glucosil-ceramida. Estas modificaciones consisten básicamente en: elevación de factores prohemostáticos (factor von Willebrand, factores II, VII, VIII y X, y fibrinógeno), un descenso cuantitativo de anticoagulantes naturales (proteína S libre, inhibidor de la vía del factor tisular o TFPI-libre, antitrombina) o un defecto funcional de los mismos (resistencia adquirida a la acción de la proteína C). El resultado global es un estado procoagulante adquirido (8).
La forma de presentación clínica puede ser variable, lo que ocasionalmente dificulta el diagnóstico, sin embargo, diversos autores afirman que las manifestaciones más comúnmente encontradas en el curso de TVC, son aquellas derivadas de HE aislada (cefalea, papiledema y alteraciones visuales), déficits focales, convulsiones, y signos de encefalopatía (estupor, coma) (9).
El diagnóstico sospechado clínicamente debe confirmarse con imágenes no invasivas. Liaño Esteso DG, y col. (10) describen signos radiológicos directos e indirectos, indicativos de TVC en TAC y en RMN, tanto en secuencias simples como vasculares, que incluyen la visualización directa del trombo, la repercusión de éste sobre el parénquima susceptible de drenaje, y el desarrollo de colateralidad venosa. La relación entre manifestaciones clínicas y hallazgos en neuroimágenes permiten aclarar el diagnóstico y diferenciarlo de gran variedad de entidades vasculares que pueden cursar con lesión talámica bilateral como el Síndrome de la arteria de Percherón, Enfermedad de Behςet, entre otros (3).
Celorrio CSY, y col. (5) proponen coadyuvar el diagnóstico con biometría hemática, perfil bioquímico, TP, TPT, DD, etc. El DD (producto de degradación de la fibrina) puede ser predictor de TVC aguda extensa cuando muestra elevación por encima de 500 ug/l con una sensibilidad de 93.9 % y especificidad de 89.7 % (5). En concordancia con la literatura, en la paciente se detectaron cifras aumentadas del DD (597 ug/l).
El tratamiento, debe centrarse inicialmente en identificar y abordar complicaciones potencialmente mortales, incluyendo la HE, convulsiones y el coma (6).
Es válido aclarar que, aunque las medidas antiedema cerebral con diuréticos (osmóticos y del asa), no cuentan con un soporte claro en la medicina basada en la evidencia, la paciente tuvo una respuesta favorable con la utilización de manitol y furosemida.
La anticoagulación ha sido un tema debatido, debido al potencial de transformación hemorrágica de los infartos cerebrales antes de administrarla. Tadi P, y col. (6) recomiendan un esquema con HBPM administrada por vía SC como puente a la anticoagulación oral (con antagonista de vitamina K), extendiendo esta última de 3 a 6 meses en pacientes con TVC provocada y de 6 a 12 meses en aquellos con TVC no provocada. El objetivo es alcanzar un INR de 2 a 3.
Coincidiendo con lo reportado, en nuestra paciente, considerando que los beneficios superaban a los riesgos, se optó por la anticoagulación con HBPM durante 10 días. Al egreso hospitalario se indicó Warfarina, durante 3 meses, se dio seguimiento por INR y tuvo una respuesta favorable. Se suspendió el conocido agente causal (AHO). Algunos autores señalan evolución tórpida en pacientes con afectación del sistema venoso profundo intracraneal (mayor tendencia a dejar secuelas neurológicas permanentes), así como en los que en el TAC de urgencias se identifican cambios hemorrágicos (3). Nuestra paciente, a pesar de la extensión del evento trombótico, mostró una evolución satisfactoria debido, en gran parte al diagnóstico temprano del mismo.














