Introducción
El cerebro, tiene un patrón único de circulación sanguínea que está abastecido directamente por sangre de la aorta, formando un intrincado sistema de arterias (Polígono de Willis) que perfunden todo el tejido cerebral, llevando cerca del 15% del total de la fracción de eyección cardíaca hacia el cerebro(1). El tejido cerebral representa menos del 2% del total del peso corporal (1.3 - 1.5 kg), sin embargo consume cerca del 20% del oxígeno disponible en el cuerpo(2). El cerebro, al ser el órgano que controla todas las funciones corporales debe tener un sistema de regulación muy riguroso, abasteciéndose de oxígeno continuamente en respuesta a la demanda local inducida por la actividad metabólica, previniendo de esta forma la hipoxia neuronal inclusive durante situaciones de hipovolemia(3). La elevada demanda metabólica del cerebro en condiciones normales requiere un flujo de sangre de alrededor de 45-50 ml 100g-1 min-1 en un rango que va desde 20ml 100g-1 min-1 en la sustancia blanca hasta 70 ml 100g-1 en la sustancia gris(4) (5) (6) (7) (8).
En circunstancias normales, cuando el flujo sanguíneo cerebral desciende a niveles menores de 18-20 ml 100g-1 min-1, la función eléctrica de las células nerviosas comienza a fallar, despertando los mecanismos intrínsecos de incremento en el flujo sanguíneo cerebral que se encuentra mediado por una vasodilatación reactiva altamente eficaz(9) (10).
Dentro de los factores fisiológicos que pueden alterar el flujo sanguíneo del cerebro tenemos a la temperatura, la presión arterial, la presión de perfusión cerebral, la presión parcial de Oxígeno arterial (PaO2), la presión parcial de dióxido de carbono (PaCO2), vasodilatadores como el óxido nítrico (NO), vasoconstrictores como la adrenalina, la viscosidad sanguínea y la actividad simpática y parasimpática del sistema nervioso en general (11) (12) (13).
Autorregulación Cerebral
La autorregulación cerebral es un proceso de alta reactividad vascular producido en el cerebro, el mismo que permite el abastecimiento sanguíneo a pesar de los distintos cambios en la presión de perfusión cerebral(14). La autorregulación cerebral es un mecanismo neuroprotector que ayuda a mantener el flujo de sangre del cerebro cuando existen cambios importantes en el tejido cerebral que requieran de una compensación inmediata. A pesar de que se han descrito múltiples mecanismos miogénicos, neurogénicos y metabólicos, el mecanismo exacto para controlar la respuesta de la autorregulación cerebral no se ha descrito en su totalidad(15).
La tendencia actual es considerar al tono muscular como el responsable absoluto de los cambios reflejos en el musculo liso capilar debido a cambios en la presión transmural, asegurando de esta forma un flujo sanguíneo cerebral adecuado a pesar de las caídas significativas de la presión de perfusión cerebral(16) (17) (18) (19) (20) (21) (22).
Presión de Perfusión Cerebral
La presión de perfusión cerebral (PPC) se define como la diferencia entre la presión arterial media (PAM) y la presión intracraneal (PIC) o la presión venosa central de la yugular, cualquiera que sea la mayor de ellas. En circunstancias normales va entre 60 y 150 mmHg y la PIC alrededor de 10mmHg. Estas características le vuelven al cerebro un órgano resistente a cambios importantes de la presión arterial, siendo mayoritariamente indemne a cambios que van por debajo los 60 mmHg (23) (24). Por otro lado, los cambios bruscos de presión arterial que van por fuera de los limites de la autorregulación, pueden causar un incremento de la perfusión cerebral, aunque incrementos de la PIC disminuirán la presión de perfusión cerebral (Figura 1).
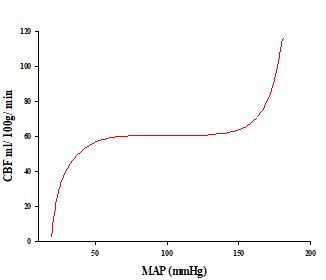
Figura 1: Representación esquemática de la autorregulación del flujo sanguíneo del cerebro, elaborado por el Autor. CBF= Cerebral Blood Flow MAP= Mean Arterial Pressure.
Este gráfico representa la autorregulación del flujo cerebral durante los cambios en la presión arterial media. Este flujo se reduce en condiciones de hipotensión extrema y se incrementa cuando existe una hipertensión severa, siempre que la presión ejercida para mover la sangre hacia el cerebro sea menor o mayor respectivamente.
En condiciones patológicas, cuando la presión de perfusión hacia el cerebro es disminuida (hipotensión severa o trauma cerebral) el flujo cerebral cae inicialmente, a los pocos minutos regresa a los niveles normales(25). Los factores que provocan este incremento local del flujo sanguíneo cerebral están regulados por factores metabólicos, miogénicos y endoteliales, produciendo vasodilatación a pesar de la reducción de las resistencias vasculares periféricas (26) (27)(28).
Uno de los análisis mas importantes sobre el tema viene por parte de Lang y su grupo en el año 2003(20). Lang et al demostró que la aparente relación de autorregulación entre la presión de perfusión cerebral y la PtO2 tienen un rol muy importante para la regulación de la vasodilatación cerebral, probablemente debido al incremento de la adenosina(29) (30) (31), así como de otros metabolitos endoteliales(32) (33) (34) (35).
En los pacientes que han tenido algún tipo de daño o trauma cerebral, valores inferiores a 70 mmHg de presión de perfusión cerebral se asocian con un peor pronóstico en comparación con pacientes que tienen una presión de perfusión cerebral mayor(36) (37) (38) (39). Durante la hipotensión moderada, a pesar de la estimulación de los baroreceptores periféricos, excelentes auto reguladores, el flujo de sangre hacia el cerebro no disminuye significativamente hasta que la presión arterial media sea reducida a niveles críticos (< a 60 mmHg) y los mecanismos auto-reguladores comiencen a fallar(19) (40).
El equilibrio adecuado entre la perfusión cerebral, presión arterial media y la presión intracraneal asegura un suministro adecuado de oxígeno a los tejidos hasta que se llegue a un límite crítico definido como sería uno menor a 50 mmHg(36) (37) (38) (39) (41).
Factores que afectan el flujo cerebral
El flujo sanguíneo cerebral (FSC) es heterogéneo y dinámico, muchos factores locales se encuentran involucrados en la regulación y autorregulación de este. La demanda de sustratos que requiere el cerebro, en especial el oxígeno y la glucosa debe ser siempre abastecida, ya que el cerebro es virtualmente un tejido aerobio obligado. Esta dependencia hace que muchos factores coexistan para asegurar una adecuada oferta de nutrientes, principalmente son factores químicos (metabólicos), miogénicos y neurogénicos(42) (43) (44) (45) (46) (47).
Tasa Metabólica del cerebro
Un incremento en la tasa metabólica del cerebro (TMC) está asociada con cambios en el flujo sanguíneo cerebral local (FSC) en relación a la demanda de oxigeno(6) (48) (49) (50). A pesar de que existe mucha evidencia sobre los mecanismos existentes de regulación cerebral y su relación con el metabolismo neuronal, la relación directa entre el flujo cerebral y el consumo de oxigeno aun no han sido bien definidos. En un esfuerzo por resumir la evidencia más representativa disponible sobre el metabolismo celular del cerebro sugiere que los productos químicos locales cerebrales que son liberados en respuesta al incremento de la actividad neuronal son los que están involucrados en la regulación del tono vascular local y por ende el abastecimiento absoluto de sangre oxigenada(40) (51) (44). Los factores principales involucrados en la regulación local del FSC son el potasio (K+), el hidrógeno (H+), el lactato, la adenosina, el adenosin-trifosfato (ATP) y la gran parte de los factores endoteliales producidos en respuesta a varios estímulos entre los que se incluyen al tromboxano A2, la endotelina, los factores de relajación derivados del endotelio y NO (9) (40) (46).
La temperatura y su relación con el Flujo Sanguíneo Cerebral
Uno de los factores mejor conocidos y estudiados sobre la regulación del flujo sanguíneo cerebral es la temperatura tisular. Los efectos de la temperatura del cuerpo sobre el FSC cambian la demanda metabólica del tejido cerebral. La tasa metabólica del cerebro disminuye significativamente cuando cae la temperatura cerebral (52) (53) (54) (55) (56) (57) (58) (59). La hipotermia disminuye la tasa de uso de energía asociada con el mantenimiento de la integridad celular tanto en la función electrofisiológica como con el componente basal(60) (61) (62). Los efectos de la hipotermia moderada en la oxigenación del cerebro han sido utilizados como un mecanismo protector contra la hipoxia severa o el daño neurológico en varios tipos de pacientes entre los cuales están aquellos con trauma cráneo encefálico, ahogamiento, cirugías prolongadas, entre otros (53) (55) (56) (63) (62).
En contraposición a la baja de temperatura, la hipertermia tiene un efecto contrario en el FSC cuando la temperatura cerebral se mantiene entre los 37° C y 42° C (57) (64) (65). El gasto metabólico de las células neuronales aumenta, incrementando la demanda de oxigeno y glucosa, disminuyendo la oxigenación tisular de oxígeno (PtO2)(66).
La presión parcial de oxígeno arterial y su relación con el Flujo Sanguíneo Cerebral
Cuando el oxígeno disminuye en su vía desde la atmósfera hasta la mitocondria gracias a un gradiente de presión bien conocido, el oxígeno y la presión que le ayuda a atravesar las distintas barreras van perdiendo fuerza, desde 104 mmHg en los alveolos pulmonares, hasta 1 mmHg en la mitocondria(67) (68). Cuando la presión de oxígeno en sangre arterial es mayor a los 60 mmHg (presión parcial de oxígeno arterial, PaO2) tiene muy poca influencia sobre el FSC, sin embargo, cuando la PaO2 llega a valores inferiores a 60 mmHg, se puede observar de manera significativa una respuesta marcada en el flujo sanguíneo cerebral, aumentando el diámetro vascular y de esta forma la oxigenación tisular compensatoria(69) (70) (71). Cuando la PaO2 es reducida de manera severa a 25 mmHg o menos, hay un incremento del FSC muy marcado, aunque este nunca supera el estímulo ocasionado por el aumento de la presión parcial del dióxido de carbono PaCO2(11).
Dentro de los estímulos principales que ocasionan un aumento de la vasodilatación cerebral tenemos a la hipoxia, la hipercapnia y la acidosis. A pesar de conocer los mecanismos mediadores de la vasodilatación cerebral durante la hipoxia, su regulación exógena no se conoce en su totalidad, sin embargo, se hipotetiza que esta reactividad vascular nace también de estímulos neurogénicos iniciados por quimiorreceptores centrales y periféricos al igual que sustancias humorales como el NO, la adenosina, los canales de potasio, la sustancia P y las prostaglandinas(70) (72) (73).
Presión arterial de dióxido de carbono (PaCO 2 ) y su relación con el Flujo Sanguíneo Cerebral
La presión parcial arterial de dióxido de carbono (PaCO2) probablemente es el estímulo más sensible y fuerte a nivel cerebral que regula el flujo sanguíneo cerebral (FSC). El dióxido de carbono (CO2) es un vasodilatador potente que incrementa el FSC en estados de hipercapnia y reduce el flujo sanguíneo del cerebro en estados de hipocapnia(74).
Durante la exposición a la altura, los quimiorreceptores centrales y periféricos son estimulados por la reducción de la PaO2, generando una hiperventilación marcada como respuesta a la hipoxia sistémica. La hiperventilación consecuente causa una disminución en la PaCO2. Por lo tanto, la regulación del FSC esta mediada por el balance entre una baja PaO2 (estímulo vasodilatador) y una baja PaCO2 (estímulo vasoconstrictor) causados ambos por la hiperventilación(75). Durante la hipercapnia el FSC incrementa en 4% aproximadamente por cada 1 mmHg que aumenta de PaCO2 (hasta 10-20 mmHg sobre el rango normal), mientras que en la hipocapnia, el FSC disminuye en 2% aproximadamente por cada 1 mmHg que cae de la PaCO2(76).
Respuesta a la hipoxia por parte del Flujo Sanguíneo Cerebral
El mecanismo por el cual el FSC se ajusta a la hipoxia, especialmente a la hipoxia hipobárica es complejo y depende de la gravedad de la hipoxia, así como de la sensibilidad propia del tejido cerebral a cambios en la PaO2 y PaCO2(70).
Un análisis muy acertado sobre el tema fue publicado hace más de 10 años por Brugniaux et al(70). El y su grupo analizaron cuáles eran los cambios presentados durante la exposición a la altura en relación con la circulación cerebral y por una baja PaO2 y una baja PCO2(70).
La magnitud de los cambios en el FSC durante la hipoxia está relacionado en parte debido a estos mecanismos compensatorios:
1. respuesta hipóxica ventilatoria (HVR)
2. respuesta hipercápnica ventilatoria (HCVR)
3. vasodilatación cerebral post hipoxia
4. vasoconstricción debido a la hiperventilación y la consiguiente hipocapnia (70).
Después de varios minutos e inclusive horas post-hipoxia, el FSC incrementa al doble a pesar de la hipocapnia continua que se puede presentar(77) (78) (7). En este sentido, es importante entender la dinámica entre el FCS y la hipoxia aguda como desencadenante de hiperactividad cerebral compensatoria.
Flujo Sanguíneo cerebral en respuesta a la hipoxia crónica
Unas semanas después de la exposición prolongada a la hipoxia, el flujo sanguíneo cerebral comienza su retorno hacia los niveles basales, dejando a otros mecanismos con la función compensatoria de mejorar la oxigenación cerebral(79) (80) (81). Uno de estos mecanismos es el de la aclimatación post-hipoxia, proceso que ocurre en respuesta a los niveles bajos de PaO2 y que incluye principalmente a la poliglobulia compensatoria y al aumento del número de vasos sanguíneos, proceso conocido como angiogénesis(66) (82). La eritropoyesis, mecanismo fisiológico que incentiva la producción de más glóbulos rojos en el plasma y que se da en respuesta a la hipoxia ventilatoria crónica(83) (84) se evidencia principalmente entre los 10 y 14 días post exposición. Por otro lado, el re-modelamiento capilar, mecanismo de aclimatación más efectivo, aparece entre los 28 a 30 días y es caracterizado por la reducción de la distancia intercapilar y la formación de nuevos vasos sanguíneos(66) (85) (86) 87 (88) 89. Todos estos cambios fisiológicos y estructurales, en conjunto mejoran la disponibilidad y entrega de oxígeno a los tejidos, sin embargo, esto no quiere decir que la PaO2 ha regresado a niveles normales después de la aclimatación, sino inclusive a niveles mayores a los basales (66) (89) (90).
Presión parcial de oxígeno cerebral (PtO 2 )
La presión parcial de oxígeno del tejido (PtO2), brinda información sobre la calidad de la oxigenación de las células neuronales, la oferta y la demanda, así como el balance final entre la entrega de oxígeno y el consumo de oxígeno por parte del cerebro. La PtO2 del cerebro indica cual es la disponibilidad del oxígeno disuelto en el fluido intersticial a lo largo del gradiente de difusión entre capilares y mitocondrias neuronales (Tabla 1) (75).
Tabla 1: Medidas de PtO2 cerebral durante varias FiO2. Esta tabla, muestra el resultado de diferentes estudios (promedio ±D.S. o ES*) donde la PtO2 cerebral fue medida en diferentes especies y en diferentes condiciones.
| PtO 2 Cerebral | FiO 2 | Metodo y Especie animal | Notas/ anestesico | Referencia |
| 14.4±2.5* 13.7±3 * | 0.21 | RPE en ratas Wistar | isoflurano 0.8-1.0% halothano 0.7-0.8% | Hou, 2005 |
| 6.7±1.9* 13.9±3* 16.0±4.5* 22.6±1.1* 44.6±5.1 * | 0.33 | RPE en ratas | Ketamino/xilozina pentobarbital urethano/chloralosa halothano 1.5% isoflurano 2.2% | Swartz, 2003 |
| 26.7±7 29.6±8 19±7.8 | 0.26 | REP en ratas | isoflurano 1.1% ketamina ketamina/xilozina | Lei, 2001 |
| 26.0±4.8 14.8.0±5.2 | 0.28 | Oxylite en ratas | Grupo de control Después de 10 min hiperventilación 2% isoflurano | Nwaigwe, 2000 |
| 27.1.0±7.5 49.0±11 | 0.21 | RPE en ratas | Despiertos, antes de aclimatación después vivieron 4 días a 10% O2 | Dunn, 2000 |
| 15.1±1.8* 8.8±0.4* 6.8±0.3 * | 0.30 0.15 0.10 | RPE en ratas | ketamina/xilozina | Rolett, 2000 |
| 30±8 | 0.30 | Electrodo de platino en cuy | Trozos cerebrales | Bingmann, 1982 |
| 20.6±10 | 0.30 | Sensores de oro O2 en ratas | Metzger, 1977 | |
| 14.4±1.6 9.6±1.1 | 0.21 0.10 | Electrodo polarográfico en ratas | rata | Weiss, 1976 |
| 21.2±2.0* | 0.21 | Electrodo polarográfico en ardilla | Eutermia | Ma, 2008 |
| 28.3 ± 1.1 5.2 ± 0.4 | 0.21 0.08 | Electrodo polarográfico en ardilla | despierta | Ma, 2009 |
| 16.07±0.9 22.5±0.9 | 0.08 0.21 | Oxylite en ratas | Despierta sin anestesia | Ortiz-Prado, 2010 |
Desde que la tecnología nos ha permitido medir la PtO2 en unidades absolutas, hemos podido medir con gran utilidad para las neurociencias el nivel de oxigenación de la corteza cerebral(66). Los estudios de la PtO2 cerebral se han llevado a cabo en el cerebro, especialmente durante cirugías y para medir la oxigenación durante lesiones traumáticas(91) (92). Adicionalmente, la PtO2 se ha utilizado para observar el efecto de la alteración en la oxigenación utilizando como variables a la hemoglobina P50, el hematocrito, la angiogénesis, la densidad vascular, las alteraciones en la tasa metabólica cerebral y la adaptabilidad a la hipoxia aguda o crónica(90) (93) (94) (95). Desde una perspectiva clínica se conoce que un suplemento adecuado de oxígeno es vital para la supervivencia celular en el cerebro. La medida de la PtO2 del cerebro indica una medida cuantificable de la oxigenación lo cual está relacionado con la facilidad de supervivencia celular cerebral(91) (92).
De acuerdo con la literatura, la definición de PtO2 cerebral crítica varía según el método utilizado(96). A pesar de que es difícil establecer un valor crítico, algunos estudios demuestran que los valores de PtO2 debajo de 10 mmHg están asociados con un mal pronóstico(97). La determinación del valor crítico es sumamente importante para la supervivencia y conservación del cerebro(91) (98) (99), estipulándose un rango de la PtO2 cerebral promedio que va desde los 20 a 30mmHg (4)(66)(91) (95) (97) (100).
El efecto de la anestesia sobre la oxigenación cerebral
La anestesia es un factor que afecta la oxigenación cerebral al momento de medir la PtO2(66). Explorando los efectos de la anestesia sobre la oxigenación cerebral nos encontramos con varios análisis que muestran el efecto global de este tipo de fármacos sobre la PtO2(101) (102) (103) (104) (105) (106) (107) (108) (109). Los efectos de la anestesia o de algún agente sedante es variable y depende del tipo de fármaco usado así como la dosis administrada. Los efectos de la anestesia sobre la PtO2 del cerebro son complejos ya que no solamente afecta al flujo sanguíneo cerebral, sino también a la función pulmonar general y la ventilación, resaltando que la tasa metabólica del cerebro también aumenta(110) (111) (112) (113).
La mayoría de los estudios han utilizado anestésicos volátiles y la descripción de sus efectos en la PtO2 del cerebro son extensos. De acuerdo con la literatura, la oxigenación cerebral mejora durante la anestesia con gases volátiles (113) (114) (115), mientras que disminuye al utilizar agentes inyectables como el pentobarbital o la ketamina-xilazina(116).
Hoffman et al., han reportado que varios agentes anestésicos volátiles como el desfluorano y el isoflurano mejoran la oxigenación cerebral, e hipotéticamente protegen el tejido cerebral durante el periodo trans-quirúrgico (113) (114) (117). Los efectos de otros agentes en especial aquellos de presentación inyectable, han demostrado que pueden reducir la PtO2 cerebral. Por ejemplo, Hou et al., en 2003 reportó que 87/17 mg/kg de ketamina-xilazina inyectable redujo el FSC entre el 50 al 65% después de iniciar la anestesia, y de esta manera, redujo la PtO2 cerebral(116).
Conclusiones
El flujo sanguíneo cerebral es altamente dependiente de factores tanto internos como externos. Mantener una oxigenación cerebral adecuada es fundamental para garantizar el correcto funcionamiento del cerebro y mantener la homeostasis neuronal. La oxigenación cerebral altamente dependiente de factores como la hipoxia, el metabolismo cerebral, el flujo sanguíneo cerebral y el uso de anestésicos, dificulta generalizar cuáles son los valores definitivos de perfusión tisular neuronal.
Por otro lado, existen varias formas de evidenciar si la perfusión cerebral es adecuada, teniendo a nuestra disposición métodos directos e indirectos para medir la presión parcial de oxígeno cerebral así como el consumo propio de oxígeno.
La gran mayoría de los estudios revisados demuestran que el flujo sanguíneo cerebral, altamente dependiente de la demanda metabólica del cerebro es en promedio 45-50 ml/100g-1/ min-1 con un rango que va desde 20ml/100g-1/min-1en la sustancia blanca hasta 70 ml 100g-1 en la sustancia gris. Este flujo sanguíneo cerebral causa que la presión parcial de oxígeno cerebral (PtO2) tenga un rango entre 20 a 30 mmHg en condiciones normales con una FiO2 de 21%.
Finalmente podemos decir que la presión parcial de oxígeno es altamente dependiente de la anestesia, la temperatura y especialmente de la aclimatación a la hipoxia que los sujetos puedan tener.














