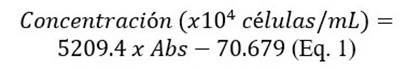Introducción
La producción industrial presenta una tendencia constante a incrementarse en países desarrollados, como en países en vías de desarrollo sin considerar en la mayoría de los casos las repercusiones ambientales, lo que incide directamente sobre la demanda energética y la necesidad de agua en varios sectores, incluyendo la agricultura, el transporte, sectores comerciales y domésticos (Sarin, A., 2012). La demanda actual de energía es cubierta mayoritariamente por fuentes convencionales contaminantes como por ejemplo el consumo de gas natural y la energía hidroeléctrica que con frecuencia conllevan la emisión de gases de efecto invernadero a la atmosfera, dando lugar a la degradación atmosférica y a una alteración del ambiente (Perera, F., 2018; Elegbede, I., et al. 2017).
Las microalgas son organismos unicelulares que actúan como productores primarios cruciales en todo el mundo, que se encuentran típicamente en ambientes marinos y de agua dulce. La mayoría de ellos pueden vivir foto-autotróficamente, reproducirse rápidamente y acumular biomasa en un período corto de manera eficiente (Zhi-Cong, L., Ming-Hua, L., 2019).
Existe interés por encontrar soluciones sostenibles frente a los conflictos ambientales a los que en la actualidad el planeta se ve inmerso (Sandoval, M., 2013). Cuando estos conflictos requieren una atención inmediata, se generan atractivas propuestas con microalgas en los que se combinan el potencial de cosechar coproductos valiosos de forma concomitante, como biopolímeros, proteínas y alimentos para animales con el compuesto activo de las microalgas que a menudo se promocionan como el "oro verde" de la biotecnología (Cooney, M., Young, G., Nagle, N., 2011).
En los países en desarrollo, no existen un número significativo de proyectos que busquen optimizar sus procesos y abaratar costos (Khan, M.I., J.H. Shin, and J.D. Kim, 2018; Shiho, M., et al., 2012). Existen varios cuellos de botella primarios en las tecnologías actuales, incluida la baja eficiencia de conversión de biomasa, la bioinvasión del entorno externo, las fuentes de nutrientes limitadas o costosas y la gran cantidad de energía y capital para la cosecha, y el estancamiento de su progresión industrial (Yimin, C., Changan, X., 2017).
La combinación de la producción de biocombustible con el tratamiento ambiental hace que las microalgas sean una materia prima más viable (Yimin, C., Changan, X., 2017) por su capacidad de acumular niveles muy altos de lípidos, lo que genera interés en el aprovechamiento de proteínas y alimentos. (Borowitzka, M.A. y N.R. Moheimani, 2012; Perera, F., 2018, et al., 2017).
En Ecuador, y dentro del contexto de la producción de biomasa algal hay esfuerzos iniciales para su uso, aprovechamiento (Puente Insuasti, E.H., 2019; Li, M., Hu, D., y Liu, H., 2014; Herdoíza, J.A., 2017; Patiño, M., 2016) y sus aplicaciones en las diferentes industrias. Uno de los varios casos relacionados, es el tratamiento de aguas residuales para remoción de nutrientes con microalgas nativas ecuatorianas (Benítez, M., et al., 2018), investigación que relaciona una de las aplicaciones de este estudio.
El reto de las instituciones a nivel superior y centros de transferencia tecnológica es desarrollar proyectos que permitan el aprovechamiento de sistemas biológicos, generen recursos para la población y desarrollen nuevas líneas de investigación, por cuanto se vuelve imprescindible este tipo de investigaciones.
Materiales y métodos
La investigación se realizó en el laboratorio de Biotecnología de la Escuela Superior Politécnica de Chimborazo. Los taxones que se utilizaron fueron Scenedesmus sp. y Chlorella vulgaris, que fueron obtenidas de La Pontificia Universidad Católica del Ecuador Sede Ibarra (PUCE-SI) y de la Universidad de Cuenca. Las microalgas fueron mantenidas con las condiciones adecuadas para su desarrollo y mantenimiento. En ese sentido, se utilizó luz artificial proveniente de lámparas fluorescentes, mismas que estaban distribuidas frente a frente, cuyo valor promedio de intensidad lumínica es igual 841.91 Lx (Chicaiza C., et al 2017), en fotoperíodos de 12 horas de luz y 12 horas de oscuridad, mantenidas en Erlenmeyer de 250 mL, con un medio de cultivo basado en un fertilizante comercial, Nitrofoska foliar al 5% (m/v). La inyección de aire se realizó por 5 min, bombeando de forma continua con una pipeta Pasteur al interior del medio de cultivo, este procedimiento se llevó a cabo desde la incorporación de las muestras al laboratorio de biotecnología hasta la realización de la tesis.
Posterior al mantenimiento señalado, se llevó a cabo el cultivo de los dos taxones bajo los siguientes lineamientos: todos los materiales fueron esterilizados en una autoclave TUTTNAUER 2340E a 120 °C, 15 psi, 30 minutos, previo a cada ensayo. Además, el medio de cultivo utilizado fue Blue Green Medium (BG11), se preparó una solución patrón, a partir de la cual se realizó una dilución al 10% (v/v); para el primer lote de producción, se cambió la concentración de una de las sales más representativas, NaNO3 en el medio de cultivo, con el fin de identificar la dosis óptima de producción, los valores de NaNO3 (g/L) correspondieron a 1.5, 2.0, 2.5. Posteriormente, se utilizó el valor óptimo encontrado, correspondiente a 2.0 g/L en el segundo lote. Se inoculó 5mL de cada taxón en los 3 primeros cilindros se utilizó C. vulgaris y en los 3 restantes se empleó Scenedesmus, con el uso de 6 Erlenmeyer de 500 mL. Cabe señalar que, se realizó un ajuste de pH en el rango entre 7.5 y 8.5 con NaOH al 20 % (m/v) y HCl 2.0 N, el control de pH y temperatura se llevó a cabo de manera diaria, mientras duró el experimento. Este proceso fue llevado a cabo bajo las medidas de bioseguridad del laboratorio para evitar contaminación.
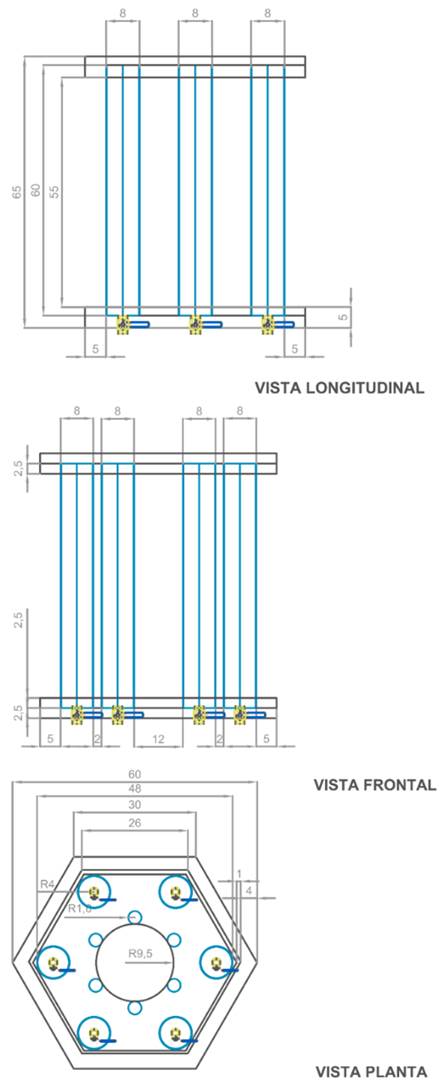
El fotobiorreactor utilizado tiene una capacidad máxima de 15 L; consta de una base hexagonal, con espejos en su interior para optimizar la concentración lumínica. La parte superior tiene un sistema eléctrico en paralelo de las lámparas LED de 8000 lm de acuerdo con las especificaciones de los fabricantes, un termómetro, un sistema de aireación continua, y un pH-metro (figura 1).
Para determinar la intensidad lumínica, dentro de los cilindros, se usó el sensor-Unit Weather Cobra 4 Weather, con el cual se realizaron tres mediciones y se obtuvo un valor promedio. Se realizaron controles cada 24 horas del crecimiento de las microalgas mediante la medición de absorbancia en el espectrofotómetro UV HEλIOS βV.60 a una longitud de onda 750 nm, para cada análisis se empleó 10 mL de muestra; se utilizó la ecuación (Eq.1), desarrollada por los investigadores del laboratorio de Biología de la PUCE-SI (R2=0.98), para convertir a número de células por mL a partir de la absorbancia.
Los productos resultantes fueron colocados en recipientes plásticos, con un volumen de 20 L. Los 3 primeros cilindros de Chlorella vulgaris se ubicaron en un recipiente y el contenido de los 3 restantes cilindros, correspondientes a Scenedesmus se pasó a otro recipiente de la misma capacidad. La biomasa húmeda se centrifugó a 840 rpm por 6 min, desechándose el sobrenadante y conservando en refrigeración el pellet, como se indica en la Figura 2.
Posteriormente, se liofilizaron las muestras con el equipo THERMO -MICRO MODULYO por 4 horas. Adicional a ello, se llevaron las muestras a un espectrofotómetro infrarrojo JASCO FT-IR 4100 para determinar los grupos funcionales más representativos.
Discusión y resultados
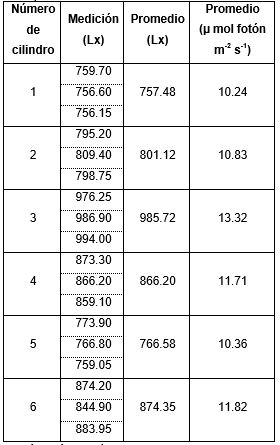
La intensidad lumínica medidas en los seis cilindros se registran en la Tabla 1.
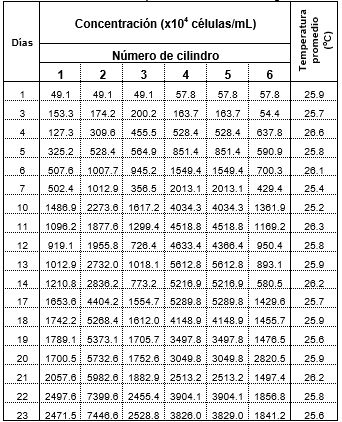
La Tabla 2 indica la producción de microalgas y una variación mínima de temperatura, cuya media fue de 27.08 °C. En los cilindros con una concentración igual a 2 g/L de NaNO3, la densidad algal al final del proceso fue de 7446.49x104 células/mL y 3825.95x104 células/mL para C. vulgaris y Scenedesmus, respectivamente. Estos son los valores más representativos en comparación a las otras variaciones del medio de cultivo en este estudio.
La curva de crecimiento se desarrolló con normalidad, que se válida con estudios de otros autores (Chacón et al, 2004; Nanduca et al, 2015). Se distingue la fase de latencia hasta la primera semana, mientras que la fase exponencial alcanza el décimo séptimo día, posterior a ello se presentó la fase estacionaria del cultivo. Ren et al (2017) propone en un estudio similar, sobre el cultivo de Chlorella vulgaris en un fotobiorreactor, un tiempo de cosecha máximo de 34 días, es decir durante la fase estacionaria, porque si se excede esta etapa, la cantidad de biomasa disminuye, ante las limitaciones de sustrato y pueden dejar de ser eficientes en la remoción de ciertos contaminantes en aguas residuales o incluso la producción de lípidos, vinculado a la producción de biocombustibles (Cobos et al, 2014).
El segundo lote de producción, basados en las concentraciones óptimas del primer lote se muestra en la Tabla 3, donde se mantuvo una temperatura promedio de 27.08 °C. Además, los datos indican un patrón regular hasta el día 12, con una fase de crecimiento hasta el día 5; después, la curva presenta la fase de declive o muerte celular en las seis unidades de análisis debido a un incremento del pH en la mayoría de las unidades, excepto en el cilindro 5, donde el crecimiento es exponencial y sobresale hasta el final.
La Tabla 2 presenta los 6 cultivos de los dos taxones, en los cilindros 1-3 se cultivó Chorlella vulgaris, y en los cilindros 4-6, Scendesmus sp. En el segundo y quinto cilindro, las concentraciones NaNO3 fueron las más adecuadas para el crecimiento de los dos géneros, que presentó una tendencia exponencial en los días 12-13, posteriormente la densidad algal se mantuvo estable. Mientras que en los restantes cilindros (1, 3, 4 y 6), la tendencia de crecimiento se requirió más tiempo para su desarrollo.
Se obtuvo un resultado de biomasa liofilizada de 6.59 g y 9.74 g para C. vulgaris y Scenedesmus, respectivamente, como se indica en la Figura 3. Existió una relación de aproximadamente 150% más de Scenedesmus en comparación a C. vulgaris en las 3 semanas, relación que es similar a la obtenida por (Chacón, 2004).
Una de las limitaciones del estudio fue que, las muestras tomadas en la medición de absorbancia afectaron el volumen final al no poder reincorporarse, dando un volumen igual a 1.08 L.
En relación de la biomasa seca con el volumen de cultivo, para C. vulgaris, la producción equivaldría a 1.02 g/L. Mientras que para el cultivo de Scenedesmus se alcanzó una producción de 1.52 g/L, que equivale a 72.20 mg/L.d-1 La cantidad biomasa obtenida es similar a la obtenida en otros trabajos de investigación basados en el cultivo de los mismos géneros de microalgas (Chun-Yen et al, 2015) incluso mayor en que otros trabajos, donde se reporta un rendimiento de biomasa de 0.52 g/L para el tratamiento de aguas residuales (Kee-Lam, M., Keat-Teong., L., 2014).

Fuente: Autoría propia.
Fig. 3 Liofilización de las muestras: Scenedesmus (izquierda) y Chlorella vulgaris (derecha).
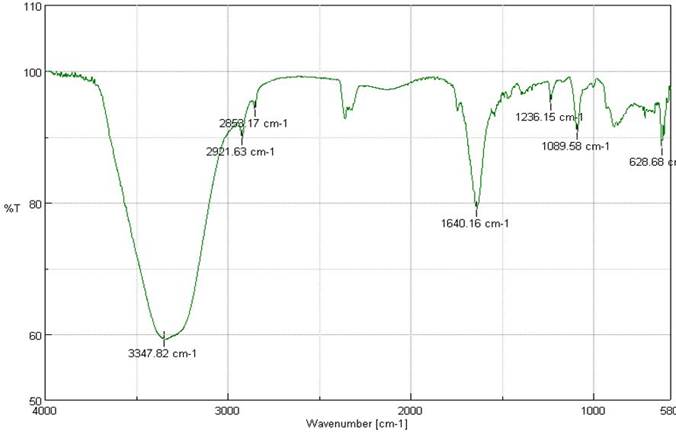
Enfocado a la identificación de estos dos géneros. En este sentido, los picos asignados a 1637 cm-1 y 1640 cm-1 corresponden al espectro de proteínas Chlorella vulgaris y Scenedesmus, bandas que se debieron esencialmente a la vibración de estiramiento (stretching vibration) de C=O al igual que la combinación de vibraciones de flexión N-H y de estiramiento C-N en complejos de amida, respectivamente (Özer., et al., 2012). De igual manera, para el espectro de los lípidos se tienen los picos 2925 cm-1 y 2921 cm-1 para Chlorella vulgaris y Scenedesmus, respectivamente (Figuras 4 y 5).
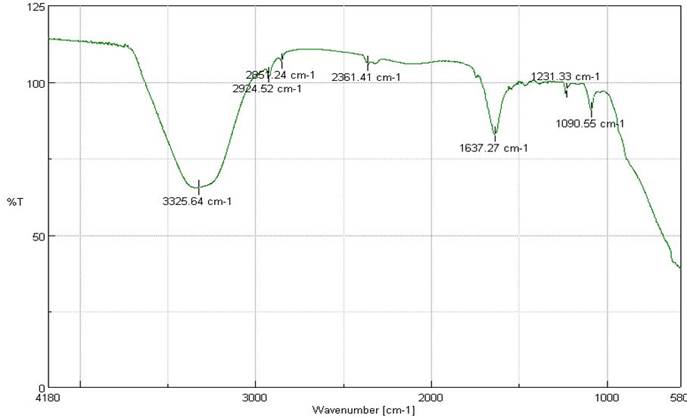
Fuente: Autoría prop
Fig. 4 Identificación de grupos funcionales por Espectroscopía Infrarroja para Chlorella vulgaris.












 uBio
uBio