INTRODUCCIÓN
La lignocelulosa es el principal y más abundante componente de la biomasa renovable producida por la fotosíntesis. Los tres principales componentes que la constituyen son celulosa, hemicelulosa y lignina. Entre ellas, las hemicelulosas están compuestas de complejas mezclas de xilano, xiloglucano, glucomanano, arabinogalactano y otros heteropolímeros [1], [2].
El xilano es el segundo polisacárido más abundante en la naturaleza, representando aproximadamente un tercio del carbono orgánico renovable de la Tierra. La hidrólisis de sus enlaces β-1,4, se lleva a cabo con la enzima xilanasa (endo-1,4- β -D-xilanohidrolasa; EC 3.2.1.8), conduciendo a productos tales como xilosa y xilobiosa [3], [4].
En la actualidad el uso de las xilanasas a escala industrial tiene un campo muy amplio de aplicación. Entre estos se encuentra el blanqueo de la pulpa en la industria papelera, clarificación de jugos, bioconversión de residuos lignocelulósicos y desechos agrícolas en productos fermentables, mejoramiento de la consistencia de la cerveza y digestibilidad de alimentos balanceados [5].
Entre las aplicaciones citadas se destaca el uso de xilanasas como sustituto de compuestos clorados para el blanqueo de pulpa Kraft en la producción de papel, en un proceso llamado biobleaching. El proceso tradicional ha generado grandes cantidades de aguas residuales cargadas de compuestos organoclorados, de características tóxicas, mutagénicas y resistentes a la biodegradación, además de ser una de las mayores fuentes de contaminación ambiental a nivel industrial [6].
Además, existen investigaciones enfocadas en la producción de biocombustibles de segunda generación, los cuales son los principales productos de la bioconversión de materiales lignocelulósicos. Entre ellos “el etanol es el combustible renovable más importante en términos de volumen y valor de mercado” [7].
El uso de xilanasas en la producción de etanol de segunda generación puede incrementar su efectividad, al aprovechar la hemicelulosa, convirtiéndola en xilosa, la cual es un azúcar fermentable. Además, la producción de xilanasa con xilano purificado como sustrato no es viable desde el punto de vista económico por su elevado costo.
En este contexto el presente estudio se enfoca en la optimización de la producción de xilanasa a partir de una cepa bacteriana aislada por el personal del laboratorio para enzimas, bioproductos y biorremediación de la universidad de Lakehead. Seguido de la evaluación de la efectividad de diversos subproductos agroindustriales lignocelulósicos de bajo costo ricos en hemicelulosa, como sustratos para el cultivo de la cepa Bacillus sp. K1 y la consecuente producción de xilanasa bacteriana, basado en la tesis de grado [8].
METODOLOGIA
Cepa bacteriana y su activación
De acuerdo con Prasad & Qin [9] la bacteria Bacillus sp. K1 fue aislada en las premisas de la Universidad de Lakehead; a partir de una muestra de madera en estado de putrefacción, se identificó como productora de celulasa por Prasad & Qin y se preservó en refrigeración a -83 °C. La cepa se encuentra registrada en el base de datos del banco de genes NCBI (N° de acceso KP987117).
Una muestra de la cepa congelada fue cultivada en una caja Petri con medio de cultivo Luria-Bertani y colocada en una incubadora a 37 ºC por 24 h. Para la activación de la bacteria a utilizarse en el estudio, se empleó 50 mL de medio de cultivo Luria-Bertani en un matraz, para luego ser incubado por 15 h a 37 ºC y 200 rpm de velocidad de agitación.
Cultivo de la cepa bacteriana
La bacteria activada se cultivó al 1% de inóculo en 20mL de medio MSM para verificar la producción de xilanasa y crecimiento bacteriano en función del tiempo. El medio utilizado consistió en: xilano purificado 1%, nitrato de sodio 0,1 g, NaNO3 0,1%, K2HPO4 0,1%, KCl 0,1%, MgSO4 0,05%, extracto de levadura 0,05%. Las condiciones de fermentación fueron pH 7, 37 ºC y 200 rpm de agitación por 144 h. Las muestras fueron tomadas cada 12 h y preservadas a -4°C.
Densidad óptica y medición de la actividad enzimática
Medición de la densidad óptica
El uso de la espectrofotometría para medir la densidad óptica a 600 nm (OD600) de un cultivo bacteriano con la finalidad monitorear el crecimiento ha sido una técnica usual en microbiología [10]. Las muestras tomadas cada 12 h se descongelaron lentamente en hielo y se midió su densidad óptica en un espectrofotómetro La densidad óptica de varias muestras se midió en un espectrofotómetro de microplacas Epoch™ fabricado por BioTek Instruments [11]. Con el uso del promedio de estas mediciones se trazó la curva de crecimiento bacteriano.
Extracción de la enzima cruda
Las muestras se centrifugaron a 12000 rpm durante 3 min. El sobrenadante claro (extracto crudo) se utilizó para el ensayo enzimático.
Ensayo de actividad enzimática para xilanasa
La producción de xilanasa se verificó con la medición de su actividad enzimática. Este método se fundamenta en cuantificar la liberación de xilosa, con el uso del reactivo, ácido 3,5-dinitrosalicílico (DNS) [12]. El reactivo usado es de marca Sigma Aldrich N° producto D0550).
Este método requiere la construcción previa de una curva de calibración con xilosa, reactivo de marca Sigma Aldrich (N° producto X-0200000). La longitud de onda utilizada fue de 540 nm. La curva de calibración se desarrolló con diferentes soluciones de xilosa con una concentración en el rango de 0 a 800 μg/mL. Los experimentos se realizaron por triplicado y la curva se construyó mediante la técnica de regresión lineal.
La mezcla de reacción contenía 20 μL de solución de xilano purificado de espelta y avena, marca Sigma Aldrich (N° producto X-0627) al 1% (preparada en tampón citrato 0,05 M de pH 5,3) como sustrato, se incubaron 10 μL de extracto enzimático diluido y tampón citrato (0,05 M, pH 5,3) a 50 ºC durante 30 min y luego la reacción se terminó mediante la adición de 60 μL de reactivo DNS.
Se ejecutó un control simultáneo que contenía todos los reactivos, y la reacción se terminó antes de la adición del extracto de enzima. Las muestras se colocaron un baño de agua hirviendo por 10 min, se enfriaron a temperatura ambiente y se diluyeron a 300 μL con agua destilada. La absorbancia de las muestras se determinó en un espectrofotómetro a 540 nm [13].
La unidad de actividad de xilanasa se definió como la cantidad de enzima que cataliza la liberación de 1 μmol de azúcar reductor equivalente a xilosa por litro minuto en las condiciones de ensayo especificadas [12].
Los promedios de absorbancia obtenidos en cada ensayo fueron convertidos en concentración de xilosa (µg/mL) con el uso de la curva de calibración previamente realizada. La concentración de xilosa será transformada en unidad de actividad enzimática mediante la siguiente ecuación:
Donde V r , V e , t inc y M son constantes. V r es el volumen total de reacción (0,03 mL), V e es el volumen del extracto enzimático (0,01 mL), t inc es el tiempo de incubación (30 min) y M es el peso molecular de xilosa (150 µg/ μmol). 𝐴𝑐 𝑥 es la actividad de xilanasa (μmol xilosa/ Lmin) y 𝑋 es la Concentración de xilosa (µg/mL reacción).
Optimización de las condiciones de fermentación
Optimización del pH
Se compararon diferentes pH en un rango de 3 a 9 en las condiciones de cultivo en un matraz para verificar la actividad enzimática óptima. Cada muestra se analizó a las 36 h, cuando la actividad de xilanasa era más alta, en base a los ensayos anteriores.
Optimización del medio de fermentación
Optimización de la fuente de carbono
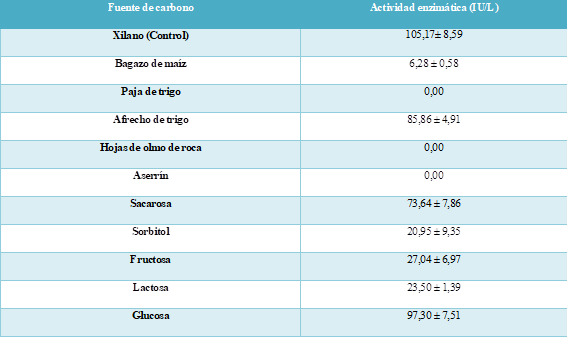
Se estudió el reemplazo del xilano purificado con diferentes residuos: afrecho de trigo, paja de trigo, aserrín, bagazo de maíz y hojas de olmo de roca (Ulmus thomasii Sarg.) como fuente de carbono principal; y azúcares purificadas como: lactosa, sacarosa, D-sorbitol, D- Fructosa, D- Glucosa como fuente suplementaria, en una concentración de 1%. Finalmente, se probó con diferentes concentraciones del residuo lignocelulósico optimizado en un rango de 0,5% a 5%., suplementando el medio de cultivo con 0,5% del azúcar purificado que demostró incrementar la actividad enzimática en mayor proporción.
Optimización de la fuente de nitrógeno
Las fuentes orgánicas de nitrógeno comparadas fueron: extracto de levadura, peptona, úrea, extracto de malta y triptona. A su vez las fuentes inorgánicas fueron: sulfato de amonio, nitrato de potasio, cloruro de amonio, nitrato de sodio y nitrato de amonio. Este experimento mantuvo las condiciones de cultivo previamente optimizadas con 1% de fuente de nitrógeno. Finalmente, se probó con diferentes concentraciones de la fuente inorgánica de nitrógeno optimizada en un rango de 0,5% a 4%.
Relación entre la concentración fuente de nitrógeno/ carbono.
Se utilizó la relación ya optimizada entre la fuente de carbono y nitrógeno inorgánica para ensayar diferentes relaciones de concentración con la fuente orgánica de nitrógeno (8:1:1, 8:1:2, 8:1:4, 8:1:5, 8:1:6 y 8:1:8) en la preparación del medio de cultivo para optimizar la actividad enzimática.
Efecto de iones metálicos y surfactantes
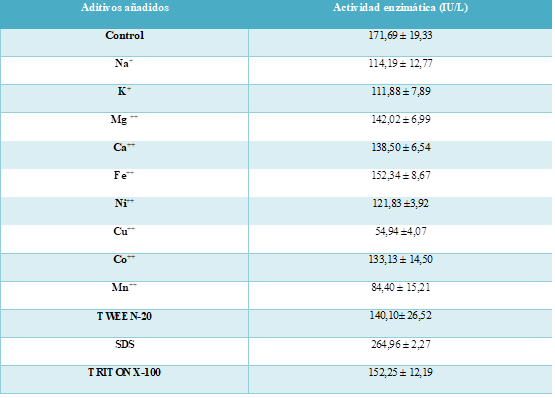
Se ensayaron diferentes iones metálicos (sodio, potasio, magnesio, calcio, ferroso y niqueloso) con una concentración 1 mM y surfactantes (Polisorbato-20, dodecil sulfato de sodio y Triton X-100) con concentración 0,1% en el medio de cultivo y se determinó su efecto en la actividad de la enzima xilanasa se comparó manteniendo las condiciones previamente optimizadas.
RESULTADOS Y DISCUSIÓN
Los resultados (Fig.1) verifican la producción de xilanasa bacteriana. Tras 36 h de fermentación se produjo el pico más alto de densidad óptica y actividad enzimática equivalente a 106,05±8,05 μmol xilosa/ Lmin, es decir que tanto el crecimiento bacteriano como la producción de enzimas, utilizando como sustrato xilano purificado, fueron optimizados.
Las condiciones físicas involucradas en la producción de xilanasa tales como pH de fermentación, volumen de inóculo y temperatura de optimización se optimizaron con experimentos independientes. El pH idóneo se determinó en el valor de 6 (Fig. 2).
El volumen de inóculo y temperatura se optimizaron (Fig. 3 y 4) en 1% v/v y 35 ºC respectivamente; cabe mencionar que dichos parámetros no fueron óptimos para el crecimiento bacteriano. Sin embargo, se seleccionaron por el propósito de la investigación de maximizar la producción de enzima. La temperatura coincide con la especie Bacillus subtilis detallada en una investigación [14].
El reemplazo del xilano puro con un residuo lignocelulósico, disminuye la actividad enzimática producida por fermentación sumergida (Tabla 1). La mayor actividad se obtiene con afrecho de trigo. Los residuos restantes demostraron inhibir en gran medida la producción de la enzima. Por tal razón se decidió suplementar el uso de afrecho de trigo con el azúcar purificado que demostró incrementar en mayor medida la actividad enzimática, es decir, glucosa (Tabla 1). El uso de afrecho se corroboró con varias especies de hongos y bacterias en bibliografía [15]; [16]; [17]; [18]; [19].
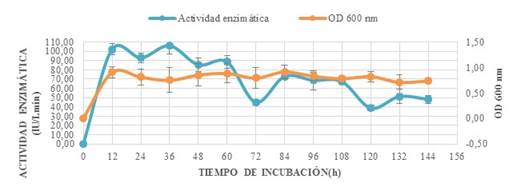
Figura 1: producción periódica de xilanasa y densidad óptica en función del tiempo de incubación cada 12 h por 6 días (144h)
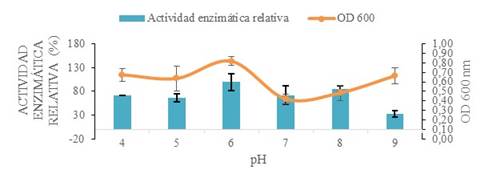
Figura 2: optimización del ph de fermentación mediante la comparación de la actividad enzimática relativa y densidad óptica.
La concentración de afrecho de trigo a utilizarse para la producción de xilanasa se ve limitada por la solubilidad de este en el medio de fermentación, razón por la cual su efecto se determinó en un rango de concentración de 0,5 a 5%.
La fuente de carbono se suplementó con glucosa al 0,5% debido a que las bacterias necesitan de un azúcar purificado simple en las fases iniciales de su crecimiento. Los resultados permitieron identificar la concentración óptima de afrecho de trigo en 4% con glucosa al 0,5% (Fig. 5).
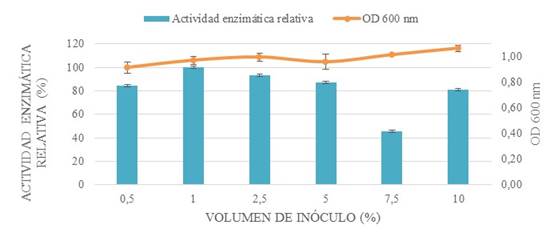
Figura 3: optimización del volumen de inóculo mediante la comparación de la actividad enzimática relativa y densidad óptica.
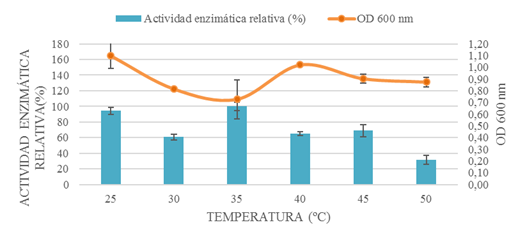
Figura 4: optimización de la temperatura de fermentación mediante la comparación de la actividad enzimática relativa y densidad óptica.
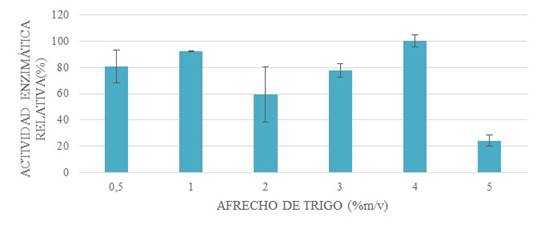
Figura 5: efecto de la concentración de afrecho de trigo suplementado con glucosa a 0.5%. Mediante la comparación de su actividad enzimática relativa
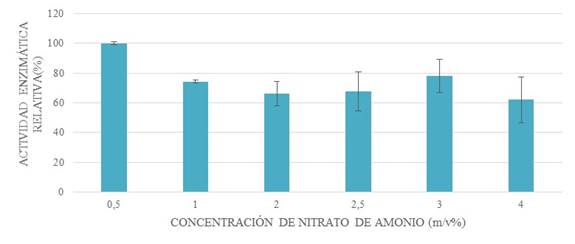
Figura 6: efecto de la concentración de nitrato de amonio mediante la comparación de la actividad enzimática de diferentes porcentajes m/v de la sustancia.
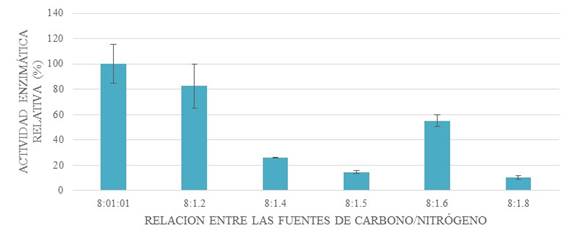
Figura 7: Efecto de la relación entre la concentración de las fuentes de nitrógeno y carbono mediante la comparación de la actividad enzimática relativa.
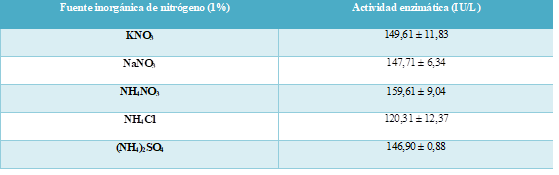
La fuente de nitrógeno inorgánico se determinó con la adición de 5 sustancias en concentración 1% al medio de fermentación. En la tabla 2 se puede observar que las actividades enzimáticas relativas del sobrenadante con nitrato de potasio, nitrato de sodio, sulfato de amonio y nitrato de amonio tienen valores similares.
La elección del nitrato de amonio se debe a que: demostró tener la mayor actividad enzimática y al realizar la cotización con el proveedor Sigma Aldrich en internet tuvo menor precio que las demás sustancias.
La concentración óptima de nitrato de amonio se determinó en un rango de 0,5-5%. Siendo la dosis de nitrato de amonio en 0,5% adecuada para maximizar la producción de xilanasa bacteriana. Por lo tanto, la relación entre la concentración porcentual de afrecho de trigo y nitrato de amonio es 8 a 1 (Fig. 6).
Tabla 2: Efecto de diferentes fuentes inorgánicas de nitrógeno al 1% de concentración en la actividad enzimática
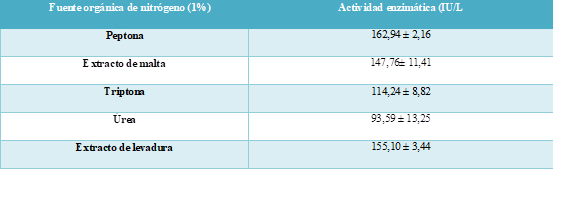
La fuente de nitrógeno orgánico fue determinada con la adición de 5 sustancias en concentración 1% al medio de fermentación. En la tabla 3 se puede observar que las actividades enzimáticas relativas del sobrenadante con la aplicación de peptona, extracto de levadura y extracto de malta tienen valores similares.
La peptona fue escogida debido a que demostró tener la mayor actividad enzimática y al realizar la cotización con el proveedor Sigma Aldrich en internet tuvo menor precio que las demás sustancias.
Tabla 3: Efecto de diferentes fuentes orgánicas de nitrógeno al 1% de concentración en la actividad enzimática
La relación entre la concentración porcentual de las fuentes de carbono y nitrógeno se determinó con la finalidad de maximizar la actividad enzimática de xilanasa. La relación del porcentaje de afrecho de trigo y nitrato de amonio se encontró en experimentos previos de 8 a 1. El porcentaje de peptona se halló equivalente a 8:1:1 (Fig. 7).
El efecto de la adición de diferentes aditivos, entre ellos iones metálicos (Tabla 4) al medio de fermentación en concentración 1mM se realizó con experimentos independientes y se determinó el efecto que ejerce cada uno de ellos en la actividad enzimática comparado con un experimento de control sin la incorporación de aditivos.
En general, la adición de los iones metálicos inhibió la actividad enzimática según la tabla 4. Sin embargo, cabe recalcar que los iones cúprico y manganoso influyeron en el decremento más significativo de la actividad de xilanasa, lo cual se puede deber al bloqueo de la secreción de proteína en el medio de fermentación, según [15].
El efecto de la adición de los surfactantes polisorbato-20 (Tween-20), dodecil sulfato de sodio y Triton X-100 en concentración 0,1% se realizó con experimentos independientes con la finalidad de comparar su actividad enzimática con un experimento de control sin la incorporación de aditivos.
La incorporación de Polisorbato-20 y Tritón X-100 mostró un decremento de la actividad enzimática relativa al experimento de control. Sin embargo, la adición de dodecil sulfato de sodio incrementó significativamente dicho parámetro. Este comportamiento puede ser explicado porque la adición de surfactantes al medio de cultivo ejerce diferentes efectos en la secreción de enzimas, dependiendo del grado en el que afecta la permeabilidad de las membranas celulares según [2].
La comparación de las actividades enzimáticas producidas con las variables previas y posteriores asociadas a la fermentación en la tabla 4 permitió determinar un valor final de 264,96±7,89 μmol xilosa/ Lmin, el cual se calculó que es 248,79% mayor a la actividad enzimática encontrada al inicio de la presente investigación.
CONCLUSIÓN
La bacteria Bacillus sp. K1, previamente aislada y determinada como productora de celulasa, demostró ser productora de xilanasa bacteriana con un tiempo de fermentación óptimo de 36h. Las condiciones físicas óptimas asociadas a la producción de xilanasa bacteriana fueron pH de 6, temperatura de 35ºC y volumen de inóculo 1%. La adición del surfactante SDS en 1% fue el parámetro que indujo de una manera significativa la actividad de la enzima.
Las condiciones físicas de fermentación y la producción verificada tanto de celulasa como de xilanasa por parte de la bacteria Bacillus sp. K1 favorecen su aplicación futura en la industria del bioetanol de segunda generación.