1. Introducción
Los pulgones o áfidos de la especie Brevicoryne brassicae L, especialistas en el ataque de las crucíferas a nivel mundial (Valverde Cadillo et al., 2021), causan estrés a la planta y, como consecuencia, pérdidas económicas por la baja producción. Ocupan sus piezas bucales modificadas en estiletes altamente especializados para perforar y alimentarse de floema e inyectar la saliva al tejido vegetal (Broekgaarden et al., 2008). La alimentación de los áfidos puede causar clorosis y enrollamiento de las hojas en el cultivo, y los enrollados servir como refugio de las colonias y de las nuevas progenies; en el proceso de la alimentación se constituyen en transmisores de enfermedades virales (Askar, 2021). Iniciadas las infestaciones, invaden los cultivos y nuevas áreas aledañas en menor tiempo, esto se da por parte de un tipo de hembra alada llamada virginopada (Kahan et al., 2002; Villacide y Masciocchi, 2014).
Para su control es común la utilización de plaguicidas de amplio espectro, como los organofosforados, peritros y carbamatos (Dubrovsky Berensztein et al., 2017), sin embargo, su uso ocasiona graves conflictos socioambientales (Islam et al., 2021), la mayoría de ellos son insecticidas con efecto residual de lixiviación prolongada, lo que genera perjuicio en el ciclo biogeoquímico (Jin et al., 2019; Pohare et al., 2021). Ya está evidenciado que los insectos tienen la capacidad de desarrollar resistencia genética y eso hace que restrinjan el uso prolongado del mismo ingrediente activo (Datta et al., 2021; Zhang et al., 2020). Es necesario la búsqueda de nuevas alternativas de control (Kim et al., 2017; Neuwirthová et al., 2019), entre ellas el uso de los microorganismos entomopatógenos (Lacey, 2017) que suelen ser enemigos naturales de los insectos, con alta eficiencia en el control y sin perjuicio al ambiente y a la salud humana (Islam et al., 2021; Khan et al., 2012).
Diferentes microorganismos, entre ellos los hongos, bacterias, los virus entomopatógenos pueden ser aplicados eficientemente en el manejo de plagas (Chen et al., 2021; Kaczmarek y Boguś, 2021; Chakrabarty et al., 2022). Varios géneros de hongos, entre ellos la Beauveria, presentan alta patogenicidad debido a la producción de toxinas capaces de matar al insecto (Rao y Narladkar, 2018; Yari Briones et al., 2021), el género Metarhizium afecta a más de trescientas especies de la clase insecta (Gómez Pereira y Mendoza Mora, 2004) así como también el Bacillus thuringiensis serovar kurstaki, que resulta ser altamente efectivo para reducir la densidad poblacional de numerosas plagas (Daquila et al., 2021; Lentini et al., 2020; Mannu et al., 2020; Straw y Forster, 2022). Sin embargo, la eficiencia de estos biocontroladores sobre las plagas difiere dependiendo de las cepas, el sitio de aislamiento, tiempo de incubación y dosis (Eidy et al., 2016), su uso resulta en una alternativa sostenible para el manejo integrado (Silva et al., 2021).
Existen varios antecedentes del uso de entomopatógenos en el control de áfidos de modo general a nivel internacional (Boni et al., 2021; Ek-Ramos et al., 2021; Gebreyohans et al., 2021; Jaber y Araj, 2018; Mukherjee et al., 2020). En Perú, es escasa la información relacionado al tema, esto podría ser por la poca información a nivel nacional y el desconocimiento de los agricultores sobre la efectividad de los microorganismos en el manejo de las plagas; no se ha encontrado reportes sobre el éxito del manejo de los pulgones con el uso de los entomopatógenos, más aún bajo las condiciones ambientales de los valles interandinos de Perú. Aunque los estudios han descrito los efectos de hongos y bacterias en las fases larvarias de los lepidópteros, no se reportan ensayos de manejo en los pulgones. Dada la importancia como un recurso alternativo al uso de insecticidas químicos y en el contexto del cuidado ambiental y la salud de los agricultores (Arias, 2021), en este documento, estudiamos el potencial entomopatógeno de cuatro formulaciones en B. brassicae, plaga de la col (B. oleracea L.) a nivel de campo y laboratorio, mediante diseños experimentales.
2. Material y Métodos
2.1. Lugar de ejecución
La investigación fue realizada en las parcelas del Centro de Investigación Olerícola Frutícola, adscrito a la Universidad Nacional Hermilio Valdizán, ubicado en el margen izquierdo del río Huallaga a 1.947 m s.n.m., 09°58’12” latitud sur y 76°15’08” longitud oeste, y los laboratorios del área de sanidad vegetal de la misma universidad, en la temporada agosto-diciembre 2019 y agosto- diciembre 2021.
Se ocuparon parcelas infestadas de B. brassicae bajo el diseño de bloques completos al azar (DBCA) de 4 tratamientos, sumado a ello un testigo en blanco y 4 réplicas. Se consideró como población a la totalidad de los pulgones existentes en 1.920 plantas de col variedad Globe Máster, y como muestra al total de los pulgones en 24 plantas de cada unidad experimental.
2.2. Tratamientos en estudio
Los tratamientos fueron constituidos a base de los formulados comerciales BioSafe, BesT-K, Metarrizo y Yurak que contenían cepas de los entomopatógeno Bacillus subtilis, Bacillus thuringiensis var kurstaki (Btk), Metarhizium anisopliae y Bauveria bassiana, respectivamente (del banco micológico de la empresa PBA-Perú), evaluados mediante aplicación por aspersión al cultivo (Tabla 1).
En campo, la unidad de análisis fue una planta de col y en laboratorio fue una placa que contenía 100 individuos adultos.
2.3. Análisis de agua
Previo a la dosificación de los tratamientos se realizó el análisis de agua a ocupar, con el propósito de medir el pH, teniendo en consideración que lo ideal está en un rango de 5,5 a 7 y los compuestos minerales en el agua inferiores a 150 mg l-1. Los valores de pH diferentes pueden alterar la germinación de las esporas del entomopatógeno (Enríquez Vara, 2021).
Según los resultados obtenidos el pH fue de 6,93, por lo que no fue necesario ocupar corrector de agua y la presencia de carbonatos en el agua era bajo, siendo favorable para su uso. Se creyó conveniente recolectar agua y realizar su exposición al sol por 48 horas para la eliminación de cloruros y sedimentación de las partículas previa aplicación al campo.
2.4. Dosificación y aplicación de los formulados en campo
En un balde de cinco litros de agua (individual para cada formulado) se incorporó el entomopatógeno y se obtuvo una mezcla homogénea; para el caso de los hongos fue necesario adicionar el aceite agrícola (Ec-oil) a una dosis de 20 ml por cada 20 l de agua, posteriormente se dejó reposar el caldo entomopatógeno por un tiempo de seis horas. Los aceites protegen las esporas del hongo frente a las inclemencias del tiempo (Gómez Ramírez et al., 2014).
2.5. Frecuencia de las aplicaciones
Los hongos entomopatógenos generalmente se aplican a los cultivos mediante pulverizaciones foliares o por incorporación al suelo (Quesada-Moraga et al., 2006; Russo et al., 2015). En este estudio las aplicaciones del caldo entomopatógeno se realizaron con la ayuda de una mochila pulverizadora manual de 20 litros, cabe resaltar que por cada tratamiento se tuvo una mochila en especial. Las aspersiones se realizaron en horas de la tarde a la puesta del sol (cinco a seis de la tarde), con una frecuencia de cada 7 días por tres veces consecutivas, cabe aclarar que las aplicaciones comenzaron al detectarse un porcentaje considerable de pulgones en campo.
2.6. Aplicación de los tratamientos en condiciones de laboratorio
Se ocuparon los procedimientos de Al-alawi y Obeidat (2014) y Gómez Ramírez et al. (2014) con algunas modificaciones:
Se colectaron hojas de la col de la parcela testigo como fuente de alimento del pulgón; se desinfectaron por 10 segundos con NaCIO 0,5% con enjuague inmediato por tres veces consecutivas utilizando agua destilada y el secado en papel toalla estéril. También se colectaron un total de 2.000 pulgones adultos de la parcela no tratada, ocupando 100 individuos por placa estéril de 50 ml, en 5 tratamientos y 4 repeticiones.
De los formulados Biosafe, BesT-K, Metarrizo y Yurak, que contenían cepas de los entomopatógenos, se preparó de forma individual el caldo biocontrolador en 60 ml de agua purificada adicionando el entomopatógeno en un rango de 0,12 g, según corresponda; en el caso de los hongos fue necesario incorporar 0,06 ml de aceite agrícola. Luego, los frascos que contenían el entomopatógeno fueron rotuladas como B. subtilis, Btk, M. anisopliae, B. bassiana y testigo, esta solución ya lista se dejó reposar seis horas, posteriormente fueron aplicadas en las placas según los tratamientos en estudio, luego mantenidas en laboratorio a 24±2 °C, 65±10 % HR y 16:8 h. fotoperíodo durante cinco a siete días.
El recambio de las hojas de col como alimento del pulgón se hizo en forma diaria, aprovechando el momento para las evaluaciones y limpieza de las placas, en el mismo horario durante los siete días consecutivos. El registro de eficiencia fue también en los mismos días, contabilizando los pulgones según su estado (vivos o muertos); considerando insecto muerto al pulgón con ausencia de movimientos, sin respuesta al pinchazo y con la presencia de las estructuras de los hongos en el cuerpo del individuo.
2.7. Análisis de eficacia
La mortalidad en campo y laboratorio fueron expresadas en porcentajes de eficacia, dadas por las fórmulas de Henderson y Tilton (1955) y Abbott (1925), respectivamente, siendo luego sometidos al análisis de varianza (ANOVA) y comparaciones múltiples a través de la prueba LSD de Fisher, ocupando el estadístico Infostat (Di Rienzo et al., 2020).
3. Resultados y Discusión
3.1. Incidencia de B. brassicae en campo post aplicación
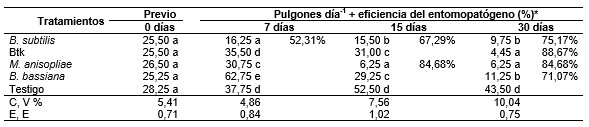
El registro de la incidencia previa a las aplicaciones fluctuó entre 26 y 28 pulgones por planta, y estadísticamente homogéneo en todo el campo experimental (p > 0,01). A los 7 días post aplicación el porcentaje de eficiencia del tratamiento Bs fue de 52,31 % con una población de 16,25 pulgones en promedio por planta, mientras tanto, en el tratamiento Btk, M. anisopliae, B. bassiana y el testigo (grupo control) se incrementaron las poblaciones a un promedio de 35,50; 30,75; 62,75 y 37,75 pulgones planta-1, respectivamente. A los 15 días post aplicación, en el tratamiento Bs, la eficiencia se incrementó al 67,29 %, seguida por el tratamiento M. anisopliae con 84,68 %.
En 30 días de evaluación todos los tratamientos registran eficiencia en el control de la plaga, siendo el tratamiento Btk superior con el 88,67 %, seguido por el M. anisopliae con 84,68 %, Bs con 75,17% y B. bassiana con 71,01 % (Tabla 2), observándose poblaciones de entre 4,45 a 11,25 individuos por planta (p < 0,01) con una marcada diferencia en el tratamiento testigo, donde se registró por sobre los 40 pulgones planta-1. La incidencia de la plaga, previa a las aplicaciones, resultó ser homogénea en todo el campo experimental, para luego decaer los días posteriores a la aplicación de los tratamientos, siendo el mayor porcentaje de reducción con el Btk, seguida por el M. anisopliae, B. subtilis y B. bassiana. Similares resultados de B. bassiana reportan Al-alawi y Obeidat (2014) al estudiar la eficiencia de tres aislados en el control el pulgón Myzus persicae en condiciones de laboratorio e invernadero (41,3 % y 46,5 % de eficiencia, respectivamente). Los hallazgos de Peña et al. (2000) con los biopreparados de Verticillium lecanii, Paecilomyces fumosoroseus y B. bassiana a nivel de parcelas en el control y del pulgón Toxoptera citricidus Kirkaldy, V. lecanii también registran el 76 % y 78 % de efectividad técnica, siendo superado por P. fumosoroseus con 85 % y B. bassiana 83 %, respectivamente. Por su parte Ríos et al. (2020) evidenciaron el 84 % de efectividad con B. bassiana en el control de B. brassicae en 23 días, mientras tanto, B. bassiana + M. anisopliae tuvieron el 79 % de eficiencia en los primeros seis días y M. anisopliae registra el 88 % en 23 días post aplicación.
Tabla 2 Eficacia (%) de los entomopatógeno en el control de B. brassicae en campo. / Efficacy (%) of the entomopathogens in the control of B. brassicae in the field.
* Medias con la misma letra en columna sin diferencia estadística (LSD a = 0,05).
* Means with the same letter in column with no statistical difference (LSD a = 0.05).
3.2. Eficacia de los entomopatógenos en el control de B. brassicae en condiciones de laboratorio
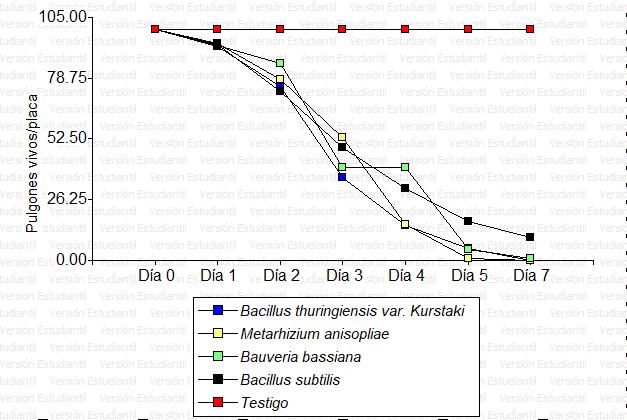
La mortalidad de los pulgones ocurrió a partir del segundo día post aplicación para todos los tratamientos (Figura 1) con descenso paulatino de individuos hasta llegar a un máximo de 0,00 pulgones vivos placa-1 en los días cinco y siete post tratamiento.
3.3. Disminución de individuos vivos por placa
Previo a la aplicación, el número de pulgones vivos fue de 100 individuos por placa, poblaciones homogéneas para todos los tratamientos. El primer día post aplicación se registraron cantidades menores a 93 pulgones vivos placa-1 en todos los tratamientos, el segundo día la población se redujo hasta 85 a 49, para luego decaer rápidamente hasta un 53 a 37 en promedio en el tercer día, el día siguiente con descensos de entre 40 a 15 individuos. Hasta este día sin diferencias estadísticas (p > 0,01) entre los tratamientos. Al quinto y séptimo días las poblaciones de individuos vivos se reducen a 0,00 en algunos tratamientos, con notoriedad de diferencias estadísticas (p < 0,01), siendo los menores promedios en los entomopatógenos M. anisopliae y Btk (Tabla 3).
Tabla 3 Mortalidad de los pulgones día-1 tratamiento-1. / Aphids mortality day-1 treatment-1.
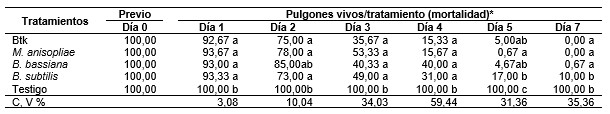
* Medias con la misma letra en columna sin diferencia estadística (LSD a = 0,05).
* Means with the same letter in column with no statistical difference (LSD a = 0.05).
La mortalidad sucedió con un descenso paulatino hasta llegar a 0,00 pulgones vivos placa-1 en los días cinco y siete post tratamiento, siendo los de menores promedios los entomopatógenos M. anisopliae y Btk. Este resultado es coincidente con los reportes de Ek-Ramos et al. (2021) con la disminución poblacional de M. persicae a nivel de campo en plantas de pimiento después de aplicar B. bassiana (cepa 7R) y M. brunneum (cepa metaBr1) a 1 *10 7 o 1 * 10 8 conidios ml-1, con diferencias significativas de las poblaciones entre la eficiencia de los hongos y el testigo (p < 0,001), donde M. brunneum redujo las poblaciones a cero en un período de nueve días. Los hongos entomopatógenos, resultan determinantes en el control de los pulgones en los cultivos, evitando la necesidad de aplicar productos químicos (Núñez Seoane, 2021). Cabe señalar que en la reducción de las poblaciones, los entomopatógenos normalmente exhiben un modo de acción inicialmente lento y terminalmente abrupto (Baverstock et al., 2006), y se sabe que después de la penetración del hongo al cuerpo del hospedante se produce una transición dimórfica provocando la formación de hifas con potencial de dispersión, en este proceso secretan toxinas y enzimas que cumplen la función de inhibir el proceso metabólico de los insectos, provocando la muerte (Bergamo et al., 2019; Moraes et al.,1998).También ocurre la muerte celular cuando las toxinas y enzimas son liberadas por M. anisopliae (Mwamburi, 2021).
3.4. Porcentaje de eficacia de los tratamientos
Las evaluaciones de eficacia se registraron hasta los siete días después post aplicación, dado que los formulados provocaron alta mortalidad a este nivel. Los entomopatógenos con el 100 % de eficacia en la mortalidad de los pulgones fueron Btk y M. anisopliae (Tabla 4) superando a los demás tratamientos, seguido por B. bassiana con 99,33 % de mortalidad.
Tabla 4 Eficacia de los tratamientos (%). / Efficacy of the treatments (%).
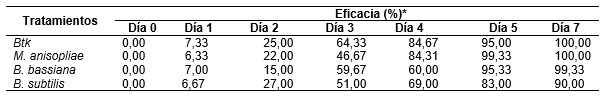
* % de eficacia= [1 - (Td / Cd)] x 100
* % efficacy= [1 - (Td / Cd)] x 100
En cuanto al porcentaje de eficacia de los tratamientos, los entomopatógenos con alta eficacia en la mortalidad de los pulgones fueron Btk y M. anisopliae, seguidos por B. bassiana. Cercanos porcentajes de mortalidad reportaron Gebreyohans et al. (2021) en sus estudios sobre el manejo de B. brassicae utilizando hongos entomopatógenos e insecticidas seleccionados, donde B. bassiana registra mortalidad de adultos entre 67 % y 100 % después de seis días de incubación y entre 56 % y 83 % con M anisopliae después de cinco días de incubación. De manera similar Murerwa et al. (2014) registran hasta 41 % de mortalidad de adultos con M. anisopliae en una concentración de 1 × 107 después de 6 días de tratamiento. Es bueno indicar que la eficacia de los biocontroladores sobre los pulgones difiere dependiendo de las cepas, el sitio de aislamiento, tiempo de incubación y dosis (Eidy et al., 2016; Litwin et al., 2020). Becerra Verdín (2010) al evaluar los formulados comerciales y cepas nativas de M. anisopliae y B. bassiana en la mortalidad de los pulgones en cucurbitáceas, registró hasta un 63 % de eficacia en cinco días para ambas especies de hongos. Clifton et al. (2018) comprobaron que la aplicación de B. bassiana y M. brunneum a semillas de soya las convierte en endófitos y estos pueden afectar las interacciones con el pulgón de la soya (Aphis glicines Matsumura), en este caso B. bassiana fue el más frecuente.
4. Conclusiones
Entre los resultados se muestra la efectividad de los cuatro entomopatógenos en el control del pulgón a nivel de campo y laboratorio. Los tratamientos mostraron un aumento paulatino en el tiempo de mortalidad de los insectos. En campo con una eficiencia de 71,07 a 88,67 % en el lapso de 30 días y en laboratorio causando la mortalidad máxima en 5 a 7 días y una eficiencia de 90 al 100 %.