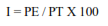Introducción
En Perú se cultivan aproximadamente 2000 hectáreas de doce especies comerciales de leguminosas, siendo el Phaseolus vulgaris el de mayor demanda, por su alto contenido en nutrientes y bajo costo. Uno de los problemas fitosanitarios de gran importancia en este cultivo es el marchitamiento vascular ocasionado por Fusarium oxysporum, un hongo saprófito, capaz de sobrevivir y crecer por largos períodos de tiempo en el material orgánico del suelo (Fravel et al., 2002). Este patógeno presenta estructuras de resistencia llamadas Clamidosporas que germinan produciendo micelio y esporas, las cuales penetran en las raíces a través de heridas ocasionadas por el manejo agronómico, insectos, nemátodos o por las raíces secundarias al emerger (Zapata et al., 2012).
La marchitez vascular en frijol es la enfermedad más limitante en el proceso productivo, causando grandes pérdidas económicas debido a su alto porcentaje de incidencia y severidad (Galindo y Pardo, 2010; García, 2018), llegando a una pérdida del rendimiento del 53% (Navarrete-Maya et al., 2009). El manejo convencional de esta enfermedad por los agricultores es difícil, teniendo que recurrir al uso de fungicidas que a veces, resultan deficientes, incrementan los costos de producción, contribuyen a la contaminación ambiental y deterioran la biota del suelo.
Por ello, ante las limitaciones en el manejo de la enfermedad, surge la necesidad de plantear alternativas sustitutivas o complementarias a las existentes, como el biocontrol o control biológico, importante para la recuperación del equilibrio de los agroecosistemas y para el aprovechamiento del potencial antagonista natural de ciertos microorganismos contra patógenos vulnerables. El biocontrol es el componente del manejo integrado de enfermedades mediante el uso de organismos vivos tipo PGPR, con el fin de suprimir la densidad poblacional o el impacto de un organismo patógeno específico, haciéndolo menos dañino (Avendaño y Arbeláez, 2006; Mejía-Bautista, 2016).
Las PGPRs actúan como fitoestimulantes produciendo sustancias bioactivas para incrementar el crecimiento de las plantas, además las protegen contra los patógenos por interacciones de antagonismo directo o indirecto. Dentro de estos se encuentran: Agrobacterium, Arthrobacter, Actinomicetos, Azotobacter, Azospirillum, Bacillus, Burkholderia, Chromobacterium, Erwinia, Flavobacterium, Klebsiella, Micrococcosa, Rhizobium, Pantoea, Pseudomonas entre otros (Bruto et al., 2014).
El control de los fitopatógenos mediante el uso de microorganismos antagonistas es una práctica mundial, lo que ha llevado a la investigación y búsqueda de nuevos aislamientos que sean efectivos en el control biológico (Flores y Roque, 2017).
En el presente trabajo se evalúan en condiciones de invernadero, el efecto biocontrolador de cuatro géneros de PGPR en el marchitamiento vascular del fríjol, ocasionado por F. oxysporum como contribución al desarrollo alternativo del manejo integrado de la enfermedad.
Materiales y métodos
Ubicación
El ensayo en vivo se llevó acabo en el invernadero de Fitopatología de la Universidad Nacional Agraria La Molina (UNALM, Lima-Perú). Los géneros con características PGPR: Bacillus (a y b), Rhizobium, Streptomyces y Azotobacter fueron obtenidas del banco de cepas del laboratorio de Ecología Microbiana y Biotecnología (LEMYB) (Dpto. Biología, Facultad de Ciencias, UNALM).
Material biológico y medios de cultivo
Germinación de semillas
Se evaluó el porcentaje de germinación (85%) de semillas de frijol común (Phaeolus vulgaris) var. canario, obtenidas del Programa de Leguminosas de la UNALM, pregerminadas por 3 días, con una radícula de 2 cm (Zúñiga, 2012).
Reactivación y preparación de inóculos
Las cepas bacterianas fueron reactivas en Agar levadura Manitol (LMA) por 3 días, luego sembradas en 15 ml de Caldo Levadura Manitol (LMC) a 28 °C por 2 días, a una OD de 0.5 y una concentración de 108 UFC/ml.
La cepa de F. oxysporum fue reactivada en el LEMYB, en Agar Papa Dextrosa (PDA) por una semana a 25 °C y luego repicado en placas de Agar Avena (OMA), con 10 ml de solución salina estéril y se recuperaron las esporas en un recipiente estéril.
Las esporas se cuantificaron en cámara de Neubauer y se diluyeron hasta obtener 106 conidias/ml.
Experimento en invernadero
Se trabajó con sustrato de jardín tamizado para maceta, que consiste en musgo y suelo de chacra (1:1), obtenidos del Programa de Ornamentales (UNALM), esterilizado por 2 días a 121 °C.
En una maceta de 900 g con el sustrato preparado, se sembraron 2 semillas pre germinadas, se inoculó 1 ml de caldo bacteriano a cada maceta. Al control químico se le agregó 0.45 g/ml de Prochloraz. Transcurridas cinco semanas se le inoculó el patógeno, inyectando 10 ml de la solución en el cuello de planta (Figura.1).
Las macetas se distribuyeron en el invernadero en arreglo completamente al azar (DCA). Se proporcionó las condiciones adecuadas para el desarrollo de las plantas con un riego a demanda.
Grado de severidad
La incidencia de las pudriciones de raíz se calculó con la fórmula de Van der Plank(1975):
Donde, I = índice de incidencia (%), PE= número de plantas afectadas y PT= número total de plantas.
Diseño experimental
Se probaron nueve tratamientos con cinco cepas obtenidas del banco de cepas: QP12, Actinobacteria (Streptomyces) (1); IBAC0212, Bacillus “a” (2); Bacillus “b” (5); CIAT899, Rhizobium (3): QZ1, Azotobacter (6); una cepa comercial de Bacillus subtilis (10g/LSL) (8x108 UFC/ml) (4) usado como control positivo.
Un control químico con Prochloraz (450 g/L EC) (7), un control sin inocular (H-) (8) y un control inoculado con el hongo Fusarium (H+) (9).
Empleando un diseño DCA y distribuidos en tres bloques, se realizaron 13 repeticiones con 2 plantas en cada maceta.
Resultados y discusión
Los parámetros de temperatura durante el ensayo fueron de 22 °C promedio, máxima de 27 °C y mínima 16 °C.
Dos semanas después de la inoculación con el patógeno se procedió a evaluar los tratamientos, se observó marchites foliar, múltiples lesiones necróticas y de color rojizo en cuello de planta y pudrición radicular (Figura 2)
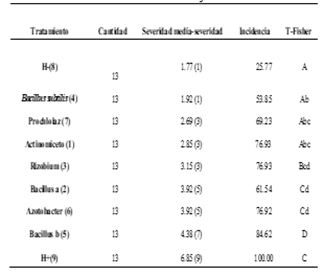
Se obtuvo una Anova de 0.002, con 6 grupos de diferente homogeneidad entre los tratamientos (Tabla 1).
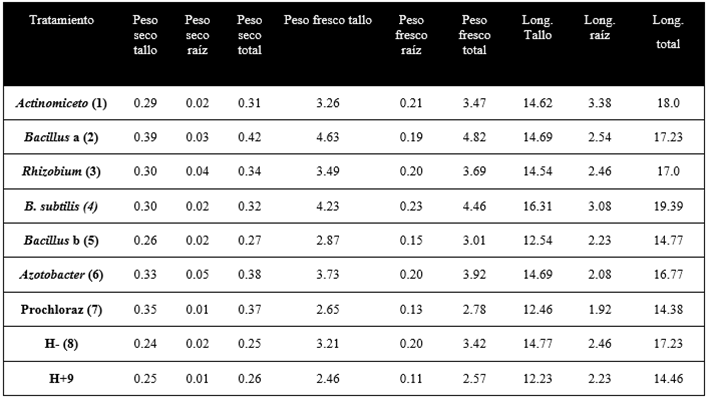
En los parámetros agronómicos obtenidos, se destaca que Bacillus “a” generó mayor peso seco (0.42g), seguido de Azotobacter con 0.38g. y Rhizobium con 0.37g. En longitud total, el Actinomiceto con 18.0 cm, Bacillus “a” con 17.23 cm y Rhizobiun con 17cm; mientras que en biocontrolador contra F. oxysporum se observa a Bacillus “a” con una severidad 5 y 61.54% de incidencia, seguido del Actinomiceto con severidad de 3 e incidencia del 76.93%, los cuales destacan frente a los demás tratamientos y controles (Tabla 2 y 3) (Figura 3 y 4).
De manera general se observa al Bacillus “a” con mejores características frente al control positivo (biocontrol), respaldado por la cepa comercial de Bacillus subtilis (4) del mismo género el cual tiene buen peso seco (0.32g), longitud total (19.38cm), índices de severidad (1) e incidencia (53.85%).
B. subtililis, es un género muy estudiado y conocido biocontrolador efectivo, con mecanismo de liberación de compuestos antifúngicos como la subtilina y otros antibióticos de la familia de las Iturinas, que actúan sobre la pared celular de los hongos (Fernández-Larrea, 2001).
El efecto biocontrolador de B. subtilis ha sido reportado sobre enfermedades tipo manchas foliares y tizón, que no son enfermedades producidas por Fusarium; sin embargo, no hay resultados que indiquen que es biocontrolador del hongo que produce la marchitez vascular (Guillen et al., 2006). Las 2 cepas pertenecientes al género Bacillus “a” y “b” tuvieron un comportamiento distinto, pero con incidencia mayor al 50% (Tabla 2).
Por otro lado, resalta la eficacia de la Actinobacteria (Streptomyces), muy conocida por producir compuestos bioactivos con diferentes actividades antifúngicas y antivirales (Schumacher et al., 2003), más del 75% de los antibióticos comercialmente útiles se derivan de este género (Peláez, 2006); muy valorado en el campo agrícola por su potencial control biológico contra los fitopatógenos (González-Franco y Robles-Hernández, 2009). También por producir metabolitos con actividad antimicrobiana, para biocontrol (Park et al., 2002).
Enzimas extracelulares como quitinasas y β-1,3- glucanasas desempeñan una función significativa en la actividad antifúngica y biocontroladora, siendo responsables del micoparasitismo ejercido por ciertas cepas de Streptomyces y la supresión de enfermedades en las plantas (González et al., 2004). En nuestro ensayo el tratamiento con Actinomiceto, mostró severidad de 3 e incidencia del 76.93% respecto al control inoculado.
Mejía-Bautista et al. (2016), evaluaron el antagonismo in vitro de diez cepas de Bacillus contra Fusarium equiseti ITCF1, mostrando 100% de incidencia de la enfermedad en plántulas de chile y severidad de 90.0 % por F. solani y 77.5 % por F. equiseti. En resistencia a la marchitez, cuatro cepas de B. subtilis CBMT51 y B. cereus BL18 redujeron la severidad de la enfermedad ocasionada por F. equiseti y la cepa BL18 para F. solani, en un 47.7, 37.8 y 50.9 % respectivamente. Valores muy cercanos a los obtenidos en este estudio.
Darío et al. (2011) evaluaron en PDA, la sensibilidad a F. graminearum, F. avenaceu y F. verticillioides, frente a varios fungicidas como Carbendazim, Tebuconazol, Flutriafol, Metconazol y Procloraz, destacando este último como el más efectivo. Sin embargo, en nuestro ensayo en maceta no se observó buenos resultados.
Existen pocos estudios sobre el potencial biocontrol de la bacteria simbiótica Rhizobium sobre Fusarium. En este trabajo no hubo presencia de nodulación efectiva, El exceso de materia orgánica u otros factores como temperatura, acidez o alcalinidad del sustrato, pueden inhibir la nodulacion. A pesar de esta carencia, se observó un buen desempeño en el peso de las plantas con este tratamiento. Los PRGR hacen disponible los nutrientes presentes en el sustrato.
Tabla 2 Escala para determinar el grado de severidad del ataque de pudriciones de raíz en el cultivo del fríjol, según Schoonhoven y Pastor-Corrales, 1987 modificado.
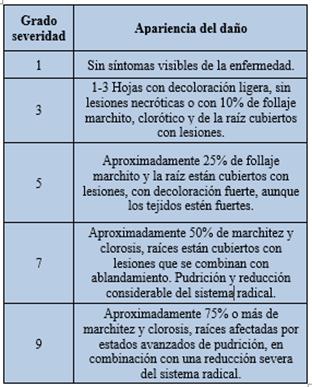

Fig. 2 Tratamientos con síntomas de la marchitez vascular a, b, c, e raíces con lesiones necróticas rojizas. Todos los tratamientos mostraron algún grado de marchitez


Fig. 3 Tratamientos evaluados, Prochloraz (7), H+ (9) H- (8), Bacillus a (2), Bacillus subtlis (4), Azotobacter (6), Bacillus b (5), Rhizobium (3), Actinomiceto (1).

Fig. 4 Tratamientos evaluados. La cepa Bacillus a (2). Actinomiceto (1) son relevantes respecto al comercial B. subtilis.
Conclusiones
El tratamiento con mejor resultado en el biocontrol de Fusarium fue la cepa Bacillus “a” (IBAC0212).
La cepa Rhizobium (CIAT 899), el Actinomiceto (QP12), y el agroquímico Prochlorax mostraron eficiencia similar de protección, disminuyendo la severidad a grado 3.
Bacillus “a” (IBAC0212), Rhizobium (CIAT 899), Actinomiceto (QP12) y Azotobacter (QZ1) mostraron buenas características PGPR.











 uBio
uBio