Introducción
El estado epiléptico (EE) es una frecuente emergencia neurológica con elevada morbimortalidad. (1) Pese a los múltiples avances terapéuticos alcanzados en los últimos años, un grupo no despreciable de pacientes persisten en EE luego de recibir la primera y segunda línea de tratamiento antiepiléptico recomendado; considerándose estos casos como EE refractario (EER). (2)
Acorde diferentes estudios, el EER ocurre entre el 9 y 40% de los pacientes con EE, (2)(3) siendo los fármacos anestésicos una recomendación establecida en las diferentes guías de tratamiento. (4)(5) Sin embargo, la mejor evidencia disponible se origina de revisiones sistemáticas de series de casos, (2)(6)(7)(8) consecuente con la ausencia de estudios clínicos aleatorizados. Los trabajos que han explorado la eficacia y dosis óptimas de los anestésicos, así como, las complicaciones o la duración óptima de su indicación acorde la evolución final de los pacientes son limitados. Los múltiples contextos clínicos encontrados en los pacientes con EER, y la heterogeneidad de los protocolos de tratamiento son algunos de los factores que condicionan los resultados de las diferentes series publicadas. Razones por la que ha sido imposible realizar recomendaciones de preferencia entre los diferentes medicamentos utilizados como tercera línea de tratamiento en el EE. (3)(7)
En concordancia con los argumentos previamente mencionados, nos propusimos evaluar los factores clínicos y evolutivos asociados a la evolución final de pacientes con EER acorde los fármacos anestésicos utilizados en su tratamiento (midazolam-MDL y/o propofol-PRO). La hipótesis del presente estudio es que la evolución final de los pacientes con EER no está en relación con el fármaco anestésico utilizado, sino con los factores de severidad y/o gravedad del paciente con EER.
Pacientes y métodos
Se realizó un análisis retrospectivo, de las variables recogidas prospectivamente, en nuestra base de datos de pacientes diagnosticados y tratados consecutivamente por EE en el hospital Eugenio Espejo de Quito, desde noviembre de 2015 a junio de 2018. Los criterios de inclusión considerados fueron: Pacientes mayores de 18 años; diagnóstico de EE acorde los criterios propuestos por la ILAE, 2015; (9) diagnóstico de EE no convulsivo (EENC) acorde los criterios del consenso de Salzburgo, 2015; (10) EER definido como la falla de control del EE con las dos primeras líneas de tratamiento indicados.(2) Mientras que los criterios exclusión: Pacientes en los que no se completó el seguimiento al egreso hospitalario; y en los que se limitó el esfuerzo terapéutico.
Definición de variables.
Se consideró falla de control del EE a aquellos pacientes que posterior a la administración de las dosis de benzodiacepina y de fenitoína o ácido valproico (intravenoso) continuaron con: Crisis epilépticas; o mantuvieron deterioro del nivel de conciencia y actividad electroencefalográfica característica de EENC, acorde los criterios del consenso de Salzburgo. (10)
Se registraron variables como: edad; sexo; antecedentes personales de salud; nivel de conciencia al inicio del tratamiento acorde la escala de coma de Glasgow (ECG); (11) severidad del EE según la escala STESS; (12) tipo de crisis epiléptica; fecha inicio del EE; estadía hospitalaria y en la unidad de cuidados intensivos. La etiología fue evaluada por grupos, epilepsia descompensada, enfermedades cerebrovasculares (hemorragia intracerebral, hemorragia subaracnoidea e infarto cerebral), trauma craneoencefálico, sistémicas (metabólicas), autoinmunes, infecciones del sistema nervioso central, degenerativas y anóxicas.
Además se incluyó la mortalidad hospitalaria y se utilizó la escala de Rankin para la evaluación evolutiva.(13) Se consideró como evolución desfavorable los pacientes con Rankin 4-6 a los 3 meses de iniciado el EE. Todos los enfermos tuvieron seguimiento en el área de Neurología con un mínimo de 2 evaluaciones en los 3 meses subsecuentes a su egreso hospitalario. Durante estas atenciones se realizó la valoración evolutiva y se registró el tiempo de sobrevida.
Protocolo de tratamiento.
Todos los pacientes fueron tratados acorde al protocolo institucional. (14) En términos generales se aplicaron las dosis de medicamentos y recomendaciones sugeridas por la Sociedad de Cuidados Neurocríticos en el tratamiento de EE. (4)
Análisis estadístico.
Los datos fueron resumidos en frecuencias absolutas y porcentajes para las variables cualitativas, mientras que para las cuantitativas continuas se utilizó la media y su desviación estándar. Se realizó un análisis para las variables clínicas y evolutivas acorde los diferentes esquemas de tratamiento en la inducción del coma terapéutico. Se utilizó la curva de Kaplan Meier para evaluar la frecuencia de supervivencia de los pacientes acorde el tipo de tratamiento recibido. Se consideró estadísticamente significativo la p≤0,05. El análisis estadístico se realizó utilizando el programa, SPSS Statistics for Windows Versión 20.0.
Consideraciones éticas
Se aplicaron los principios de la declaración de Helsinki de 1964. Se obtuvo el consentimiento informado de los pacientes o de sus tutores legales en los casos con deterioro del nivel de conciencia, y la aprobación del comité de ética de la institución para la realización y publicación de la investigación.
Resultados
En total se evaluaron 34 pacientes con el mismo número de episodios de EER. En el 35,3%(12) de los enfermos fue imposible controlar el EE posterior a 24hs de tratamiento de tercera línea, considerándose como EE super-refractario (EESR). La estadía hospitalaria y en la UCI fue de 30,2±22,1 y 13,3±10,4 respectivamente. La mortalidad hospitalaria alcanzó el 50% de los pacientes y a los 3 meses se extendió hasta el 55,9%. (Tabla 1)
Tabla 1 Características generales de los pacientes.
| Variables | N=34 (%)(media±DS) |
| Edad | 51,21±22,3 |
| Sexo masculino | 25(73,5) |
| ECG pretratamiento | 9,3±3,5 |
| Antecedentes Epilepsia | 11(32,4) |
| STESS | 2,9±1,3 |
| Tipo de crisis epiléptica | |
| Focal, Mioclónica, Ausencia | 7(20,6) |
| Tónico Clónica generalizada | 21(61,8) |
| EE no convulsivo | 6(17,6) |
| EE súper-refractario | 12(35,3) |
| Estadía hospitalaria | 30,2±22,1 |
| Estadía UCI | 13,3±10,4 |
| Traqueostomía | 17(50,0) |
| Uso vasopresores | 18(52,9) |
| Mortalidad hospitalaria | 17(50,0) |
| Evolución desfavorable 3 meses (Rankin 4-6) | 22(64,7) |
| Mortalidad 3 meses | 19(55,9) |
*ECG-escala de coma de Glasgow, STESS-escala de severidad del estado epiléptico, EE-estado epiléptico, UCI-unidad de cuidados intensivos, DS-desviación estándar.
En la figura 1 se muestran las etiologías acordes al tratamiento recibido, evidenciándose como las Enfermedades Cerebrovasculares y los Traumatismos Craneoencefálicos fueron las más frecuentes, agrupando 18(53,0%) pacientes. (Figura 1)
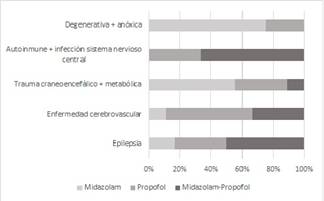
Figura 1 Distribución de etiologías del estatus epiléptico refractario acorde el tratamiento de tercera línea utilizado.
Se utilizó MDL o PRO de forma similar como primera línea de tratamiento en la inducción del coma terapéutico (17/50%). Sin embargo, el PRO fue utilizado más frecuentemente como fármaco de asociado o de 2da línea con 7(20,6%) vs 4(11,8%) MDL pacientes. Mientras que los pacientes que utilizaron MDL tuvieron una frecuencia superior de uso de vasopresores (71,4% vs 50,0%). (Tabla 2)
Tabla 2 Factores asociados al tratamiento con midazolam y proprofol en pacientes con estado epiléptico refractario.
| Midazolam n=21 (%)(media±DS) | Propofol n=24 (%)(media±DS) | |
| Inicio (1ra línea) | 17(50,0) | 17(50,0) |
| Asociado (2da línea) | 4(11,8) | 7(20,6) |
| Dosis (mg/kg/h) (mcg/kg/min) | 0,54±0,92 | 40,8±41,1 |
| Duración | 2,8±3,3 | 2,5±2,0 |
| Control EE | 13(61,9) | 12(50,0) |
| Vasopresores | 15(71,4) | 12(50,0) |
| Hipotensión que requirió disminución de dosis de sedación | 6(28,6) | 6(25,0) |
*%-porciento, DS-desviación estándar, mg-miligramos, kg-kilogramos, h-hora, mcg-microgramo, min-minuto, EE- estado epiléptico.
En la tabla 3 se realizó un análisis de las variables clínicas y evolutivas de los 3 grupos sometidos a diferentes esquemas de tratamiento. Apreciándose que los pacientes que necesitaron esquema combinado de MDL y PRO incluyeron al mayor grupo de EESR (p≤0,01), así como una frecuencia superior de traqueostomía (p=0,03), vasopresores (p=0,01). (Tabla 3)
Tabla 3 Análisis de variables clínicas y evolutivas acorde los fármacos (midazolam - propofol) utilizados en el tratamiento del estado epiléptico refractario.
| Variables | Midazolam n=10 (media±DS) | Propofol n=13 (media±DS) | Midazolam-Propofol n=11 (media±DS) | P |
| Edad | 52,6±24,0 | 59±17,2 | 40,6±22,3 | 0,12® |
| ECG pretratamiento | 10,7±3,1 | 7,9±3,2 | 9,7±3,8 | 0,13® |
| STESS | 2,2±0,9 | 3,4±1,5 | 2,8±1,1 | 0,09® |
| EESR | 0 | 2 | 10 | 0,000*Ω |
| Traqueostomía | 3 | 5 | 9 | 0,03*Ω |
| Vasopresores | 6 | 3 | 9 | 0,01*Ω |
| Hipotensión severa | 1 | 1 | 5 | 0,05*Ω |
| Control EE | 10 | 9 | 3 | 0,002*Ω |
| Estadía hospitalaria | 25,5±17,1 | 26,5±21,0 | 39,0±22,1 | 0,28® |
| Estadía UCI | 10,2±9,3 | 11,1±8,5 | 18,7±12,1 | 0,10® |
| Mortalidad hospitalaria | 3 | 8 | 6 | 0,30 Ω |
| Evolución desfavorable 3 meses | 6 | 10 | 6 | 0,49 Ω |
| Mortalidad 3 meses | 4 | 9 | 6 | 0,37 Ω |
*ECG-escala de coma de Glasgow, STESS-escala de severidad del estatus epiléptico, EESR-estado epiléptico super-refractario, Hipotensión severa- requirió disminución de dosis de fármacos anestésicos utilizados, UCI-unidad de cuidados intensivos, DS-desviación estándar. ICT-inducción del coma terapéutico. ® Test anova, Ω test Chi cuadrado, * p≤0,05.
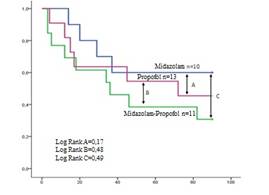
El resto de las variables como estadía hospitalaria (p=0,28), en UCI (p=0,10), mortalidad hospitalaria (p=0,30) y mortalidad a los 3 meses (p=0,37) no se evidenciaron diferencias significativas. Similares resultados fueron demostrados en el análisis de supervivencia realizado en la curva de Kaplan Meier. (Figura 2)
Discusión
El tratamiento del EER resulta todo un reto clínico. La necesidad de mantener un equilibrio entre el control del EE, y la exposición de los riesgos inducidos por el CT, suele ser un panorama complicado para la toma de decisiones clínicas. Asociado a esto, la evidencia disponible del uso fármacos anestésicos (FAs) como MDL, PRO, pentobarbital, tiopental o ketamina es predominantemente basado en series de casos. (2) Específicamente en el área de Latinoamérica, la evidencia es aún más limitada. En reciente encuesta internacional en la región, solo se describen 8 pacientes de México, 10 de Argentina, 15 de Brasil, 1 de Chile y 1 de Colombia. (15) La limitada evidencia disponible, demuestra la necesidad de desarrollar estudios que nos permitan evaluar las características clínicas y evolutivas asociadas al tratamiento de pacientes con EER.
En esta serie la mortalidad hospitalaria alcanzó el 50% y se extendió al 55% de los pacientes a los 3 meses de evolución. Resultados similares a los encontrados en investigaciones previas. (2)(3)(16) Sin embargo, una extensa cohorte de pacientes tratados en las UCI de Finlandia encontró una mortalidad al año del 22%(17%-27%) para pacientes con EER, mientras para enfermos con EESR fue de 36% (26%-46%).(17) Resultados inferiores a los previamente descritos y al encontrado en este trabajo. De forma similar, Ferlisi M. y cols encontraron una mortalidad del 24% en un estudió que incluyó pacientes con EER de 50 países durante 4 años. (15)
Las deficiencias encontradas en países en vías de desarrollo como: el retraso en la atención inicial de los pacientes, la no disponibilidad de los nuevos fármacos IV de segunda línea de tratamiento, la falta de monitoreo electroencefalográfico continuo en las UCI, son algunos factores que hacen sospechar que podrían explicar un peor pronóstico para los pacientes con EE en estas regiones. (18) Sin embargo, la evidencia disponible es bastante limitada para poder determinar si existe una mayor mortalidad en centros con limitados recursos.
Al analizar la mortalidad acorde los diferentes esquemas de tratamiento anestésicos utilizados (MDL vs PRO vs MDL y PRO) no apreciamos diferencias significativas. Trabajos previos no han identificado relación entre el fármaco anestésico (FA) utilizado y una evolución desfavorable. (2)(3)(7)Razón por lo que los expertos recomiendan seleccionar el FA de forma individualizada en cada paciente, teniendo en cuenta la etiología del EE y el estado clínico del enfermo. (7)
No existe evidencia que demuestre superioridad de un fármaco sobre el resto en algún contexto clínico específico. Sin embargo, es conocido el efecto del PRO en la disminución presión intracraneal, (19) y la menor frecuencia de hipotensión arterial, (7) como también encontramos en nuestros resultados. Algunos trabajos han encontrado una mayor mortalidad en pacientes con EER tratados con FAs, (20)(21)(22) por lo que recomiendan evaluar adecuadamente los riesgos y beneficios antes de la inducción del CT, así como intentar optimizar rápidamente las dosis de los fármacos de segunda línea como ácido valproico, levetiracetam, lacosamida, topiramato, entre otros. Para otros autores, los resultados que demuestran un incremento en la mortalidad de pacientes tratados con FAs se debe a la mayor severidad del EER y la necesidad de tratamiento más agresivo con fármacos de tercera línea, y no específicamente a factores asociados al tratamiento con FAs. (23) La ausencia de estudios clínicos aleatorizados no ha permitido obtener una evidencia concluyente.
La mayoría de las investigaciones sugieren que la mortalidad del EER está más asociada con la etiología y la edad del paciente, que con el esquema de sedación utilizado. (2)(6)(7) Desafortunadamente, en la región de Latinoamérica no disponemos de estudios que hayan realizado un análisis de los factores predictores de mortalidad en pacientes con EER. En este trabajo las etiologías más frecuentes fueron las Enfermedades Cerebrovasculares y Traumatismos Craneoencefálicos, agrupando entre ellas más del 50% de todos los pacientes. Similar resultado a estudios europeos. (6)(15)
Dentro de las múltiples limitaciones que presenta esta investigación encontramos el reducido tamaño de la muestra, además de la posibilidad de introducción de sesgos propios de los estudios de cohorte. Existieron criterios de preferencia en la selección del fármaco anestésico acorde la etiología de los pacientes, lo que pudo condicionar diferencias entre la gravedad de cada grupo de tratamiento. Sin embargo, las variables clínicas como STESS, ECG pretratamiento y edad no mostraron diferencias significativas, permitiéndonos contrastar cierta homogeneidad entre los tres grupos de pre-tratamiento. Consideramos que las conclusiones de este trabajo deben ser evaluadas con cautela debido a los múltiples factores que influyen en la evolución final de los pacientes con EER. Estudios aleatorizados multicéntricos pudiesen contribuir a identificar el fármaco y el esquema de tratamiento más adecuado para los diferentes contextos clínicos en los que se puede presentar el EER.
Conclusiones
Los pacientes con EER mostraron una elevada mortalidad, sin evidenciarse un incremento de la misma acorde los diferentes fármacos y esquemas de tratamiento anestésico utilizados. Los pacientes que recibieron MDL en monoterapia o asociado a PRO tuvieron mayor frecuencia de hipotensión, siendo significativo en los casos que recibieron tratamiento combinado MDL y PRO. El grupo de enfermos con EESR, necesitó predominantemente de terapia combinada, además de una mayor frecuencia de traqueostomía, vasopresores y disminución de la dosis de los fármacos anestésicos por hipotensión severa.