Forma sugerida de citar:
López, C., González, C., Guerrero, M.J., Mariño, G., Jácome, B. y Beltrán, E. (2019). Estudio de la estabilidad de los antioxidantes del vino de Flor de Jamaica (Hibiscus sabdariffa L) en el almacenamiento. La Granja: Revista de Ciencias de la Vida. Vol. 29(1):105-118. http://doi.org/10.17163/lgr.n29.2019.09.
1 Introducción
En la actualidad se han incrementado los estudios de alimentos que contienen compuestos bioactivos, entre estos los antioxidantes, al ser moléculas capaces de interactuar con especies reactivas de oxígeno (ERO) que incluyen iones de oxígeno, radicales libres y peróxidos (Usoh y col., 2005) las cuales son altamente reactivas al tener en su estructura una capa externa con uno o dos electrones de valencia no apareados. Estos niveles elevados de radicales libres en las células son generadores de daños en las proteínas y lípidos de la membrana celular y en los ácidos nucleicos por lo que se estrecha directamente con enfermedades carcinogénicas (Ferretti y col., 2010) mutagénicas, Alzheimer (Andzi Barhé y Feuya Tchouya, 2016) diabetes, hipertensión, obesidad y otros síntomas metabólicos (Chen y col., 2013). Las moléculas antioxidantes transfieren electrones a la capa externa con electrones no emparejados de los radicales libres logrando estabilidad, siendo capaces de transferir sus electrones evitando el efecto dañino en la célula, ejerciendo un mecanismo quelante y secuestrando a las ERO (Sáyago Ayerdi y Goñi, 2010). La flor de Jamaica ha sido una de las especies más estudiadas por su alto contenido de moléculas antioxidantes como vitamina E y C, compuestos fenólicos, ácidos polifenólicos, flavonoides y antocianinas (Cid-Ortega y Guerrero- Beltrán, 2012). Estas propiedades le confieren a esta flor efectos anticancerígenos, cardioprotectores, diuréticos, antinflamatorios, antimicrobianos (Martínez Flórez y col., 2002) ejerciendo una acción protectora del daño celular y peroxidación de lípidos (Galicia Flores y col., 2008).
Estudios realizados con extractos de cálices y flor de Jamaica han determinado que en los tejidos de estas estructuras existe una alta concentración de antioxidantes fenólicos de tipo noflavonoide y flavonoides simples o polimerizados (Da-Costa Rocha y col., 2014). Dentro del grupo de los flavonoides se identifican 5 subtipos de acuerdo a sus características estructurales: flavonas, flavonoles, flavanonas y antocianidinas (Martínez Flórez y col., 2002). Entre los compuestos polifenólicos flavonoides presentes en los cálices y hojas de flor de Jamaica se encuentra la Naringenina perteneciente a la clase de las flavonas, la catequina, galato de galocatequina, galato de epicatequina y la galocatequina de los flavanoles y la luteolina, tilirosido, sabdaritrin hidroxiflavona de la clase de flavonas (Galicia Flores y col., 2008; Da-Costa Rocha y col., 2014; Chen y col., 2013; Sindi, Marshall y Morgan, 2014). Así mismo los cálices de flor de Jamaica han demostrado contener un alto porcentaje de antiocianinas en sus tejidos estructurales identificando a la denominada crisanteina y cianidina-3-sambubiosido o gosipicianina (Da-Costa Rocha y col., 2014). Estas antiocianinasson pigmentos naturales solubles en agua y que están presentes en algunos tejidos vegetales, siendo estos los responsables de las coloraciones rojas, azules y púrpuras; la producción de este compuesto seda en la maduración y se aloja dentro de las vacuolas en las células vegetales (Yang y col., 2011).
Dentro del Ecuador, la producción de la flor de Jamaica se ha extendido en la región Amazónica debido a sus condiciones óptimas de temperatura que oscilan entre los 15°C y 38°C convirtiéndose en una alternativa del desarrollo económico sustentable de su población (Meza Chavarría, 2012); sin embargo, al ser un producto con baja industrialización ya que se comercializa a granel y al no existir estudios de la obtención de productos en base a esta materia prima que brinda compuestos bioactivos, la presente investigación tuvo como objetivo estudiar la estabilidad de los antioxidantes del vino de flor de Jamaica (Hibiscus sabdariffa L) durante su almacenamiento,con la finalidad de incrementar la producción de subproductos.
2 Materiales y métodos
2.1 Elaboración de vino
Para la elaboración del vino se utilizó flor de Jamaica procedente del cantón Macas, Provincia de Morona Santiago. Una vez realizados los análisis físicos-químicos y microbiológicos establecidos por la Norma Mexicana NMX-FF-115-SCFI-2010 (NMX, 2010) para productos agrícolas destinados al consumo humano: Flor (cáliz) de Jamaica, se procedió a realizar el mosto a partir del cáliz con una relación 1 : 3 (cálices de jamaica:agua) hasta llegar a un mosto de 23°Brix con un pH de 3 _ 3, 6; la fermentación se realizó durante 29 días bajo condiciones de anaerobiosis a una temperatura de 21°C 1°C. Posteriormente, el vino se sometió a un proceso de decantación natural durante 6 días, tiempo en el que se tomaron muestras diarias en las cuales se analizaron sólidos solubles (° Brix), pH, acidez titulable y turbidez.
1°C. Posteriormente, el vino se sometió a un proceso de decantación natural durante 6 días, tiempo en el que se tomaron muestras diarias en las cuales se analizaron sólidos solubles (° Brix), pH, acidez titulable y turbidez.
2.2 Tratamientos
Las condiciones de almacenamiento del vino de flor de Jamaica fue durante 14 días y se dividieron en dos grupos: (temperatura ambiente 20°C 1°C y temperatura de refrigeración 6°C), posteriormente, se tomaron muestras de cada grupo durante los días 0, 7 y 14, siguiendo el diseño escalonado de Gacula para estudios de vida útil, utilizando un solo lote de producto (o lotes replicados) donde se ponen a prueba las muestras al momento cero, y se toman muestras a intervalos determinados por la expectativa de la probabilidad de supervivencia (Kilcast y Subramaniam, 2000). Después se congelaron las muestras y una vez culminada la etapa de almacenamiento se midió el contenido de polifenoles y capacidad antioxidante.
1°C y temperatura de refrigeración 6°C), posteriormente, se tomaron muestras de cada grupo durante los días 0, 7 y 14, siguiendo el diseño escalonado de Gacula para estudios de vida útil, utilizando un solo lote de producto (o lotes replicados) donde se ponen a prueba las muestras al momento cero, y se toman muestras a intervalos determinados por la expectativa de la probabilidad de supervivencia (Kilcast y Subramaniam, 2000). Después se congelaron las muestras y una vez culminada la etapa de almacenamiento se midió el contenido de polifenoles y capacidad antioxidante.
2.3 Métodos de análisis
Los análisis se realizaron de acuerdo a los Métodos Oficiales de AOAC: para sólidos solubles (AOAC, 2005b) 932;12 , pH (AOAC, 2012) 960;19, acidez titulable (AOAC, 2005a) 962;12. La turbidez se midió conforme al Método Internacional OIV-MA-AS2-08 (OIV, 2009), y para determinar la intensidad del color de vino se utilizó el Método Glories descrito en (OIV, 2014)-MA-BS-26, utilizando un espectrofotómetro cuyas mediciones de absorbancia se realizaron en rangos de 380 y 780nm. El contenido de polifenolesse determinó bajo el protocolo de Folin-Ciocalteus descrito en Zhen y col., (2016) y la capacidad antioxidante se realizó mediante el método espectrofotométrico descrito por Chen y col., (2013) y Re y col., (1999) basado en la decoloración del radicalABTS.
3 Resultados y discusión
3.1 Análisis de sólidos solubles (°Brix)
Como se muestra en la Figura 1, el efecto del almacenamiento del vino de flor de Jamaica bajo dos condiciones de temperatura al transcurso de 14 días no fue significativo (p > 0,05) respecto a la cantidad de sólidos solubles (° Brix).
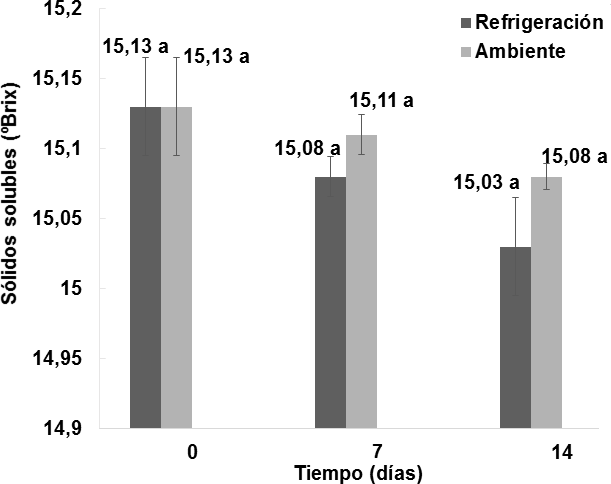
Figura 1. Comportamiento de la cantidad de sólidos solubles (° Brix) en los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0,05.
Se puede observar que la cantidad de sólidos solubles en el día 0 de almacenamiento fue de 15,13 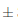 0,035° Brix. Al transcurrir 7 días de almacenamiento a temperatura ambiente hubo una ligera disminución a 15,11
0,035° Brix. Al transcurrir 7 días de almacenamiento a temperatura ambiente hubo una ligera disminución a 15,11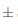 0,014° Brix, y finalmente a los 14 días no existió un cambio significativo disminuyendo a 15,08
0,014° Brix, y finalmente a los 14 días no existió un cambio significativo disminuyendo a 15,08 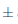 0,009° Brix. Un comportamiento similar se detectó bajo condiciones de almacenamiento a temperatura de refrigeración, puesto que al transcurrir 7 días hubo una ligera disminución a 15,08
0,009° Brix. Un comportamiento similar se detectó bajo condiciones de almacenamiento a temperatura de refrigeración, puesto que al transcurrir 7 días hubo una ligera disminución a 15,08 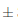 0,014° Brix, y a los 14 días fue 15,03
0,014° Brix, y a los 14 días fue 15,03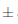 0,035° Brix. En el análisis físico-químico realizado por Mounigan y Badrie, (2007), al someter al vino de flor de Jamaica a condiciones de almacenamiento a 23°C durante 8 semanas no se registraron diferencias significativas en la cantidad de sólidos solubles entre las muestras, las cuales fueron medidas cada 30 días, dando como resultados a las 4 semanas de almacenamiento un valor de 10,22° Brix, y a las 8 semanas 10, 17° Brix.
0,035° Brix. En el análisis físico-químico realizado por Mounigan y Badrie, (2007), al someter al vino de flor de Jamaica a condiciones de almacenamiento a 23°C durante 8 semanas no se registraron diferencias significativas en la cantidad de sólidos solubles entre las muestras, las cuales fueron medidas cada 30 días, dando como resultados a las 4 semanas de almacenamiento un valor de 10,22° Brix, y a las 8 semanas 10, 17° Brix.
Por lo tanto, se puede evidenciar que la cantidad de sólidos solubles en el vino de flor de Jamaica no sufre cambios significativos en el transcurso del tiempo bajo condiciones ambientales o de refrigeración durante el almacenamiento. La estabilidad de los sólidos solubles se debe a que de acuerdo con Blouin y Peynaud, (2003) las levaduras y bacterias presentes en el vino se destruyen debido a un adecuado sulfitado y que puede continuar con el consumo lento de sustrato. Por otro lado, la ligera disminución sin diferencia significativa en la cantidad de sólidos solubles puede deberse a que a pesar de que el vino atravesó por un proceso de decantación previo, durante el tiempo de almacenamiento en reposo el vino continúa decantándose lentamente, sedimentando ciertos taninos glicosilados que pueden llevarse consigo a cristales de azúcares hacia el fondo de la botella, provocando una ligera disminución en los ° Brix (Blouin y Peynaud, 2003; Mijares y Sáez, 2007; Bujan, 2002).
3.2 Análisis de pH
Como se muestra en la Figura 2, el efecto del almacenamiento del vino de flor de Jamaica bajo dos condiciones de temperatura al transcurso de 14 días no fue significativo (p > 0, 05) respecto al pH.
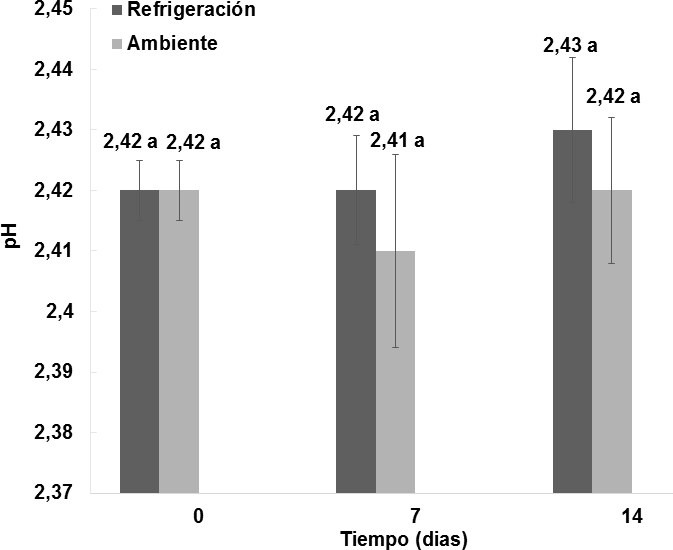
Figura 2. Comportamiento del pH en los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0,05.
Se puede observar que en el día 0 de almacenamiento,el nivel de pH es de 2;42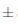 0,005 y no presenta diferencias significativas en el transcurso de los 14 días bajo dos condiciones distintas de almacenamiento, en donde las muestras de ambiente alcanzan un pH de 2;42
0,005 y no presenta diferencias significativas en el transcurso de los 14 días bajo dos condiciones distintas de almacenamiento, en donde las muestras de ambiente alcanzan un pH de 2;42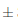 0;012 y las de refrigeración un pH de 2,43
0;012 y las de refrigeración un pH de 2,43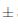 0,012. A diferencia del comportamiento registrado por Mounigan y Badrie, (2007), en el cual el proceso de almacenamiento empieza con un pH de 2,61, al transcurso de 4 semanas disminuyó a un pH de 2,43 y finalmente a las 8 semanas se observó un aumento del pH de 2,77. En los dos estudios de almacenamiento realizados con vino de flor de Jamaica, los valores de pH coinciden dentro del nivel recomendado por Jackson, (2011) y Reeves, (2010), quienes describen que los pH inferiores a 3,5 son favorables para el mantenimiento de la vida útil puesto a que aumentan el poder antiséptico y la capacidad antioxidante del sulfitado, proporcionan a los vinos un sabor fresco, reducen el pardeamiento, se enriquece la intensidad colorante y el tono, y se minimiza la concentración de la forma fenólica más fácilmente oxidable de los polifenoles.
0,012. A diferencia del comportamiento registrado por Mounigan y Badrie, (2007), en el cual el proceso de almacenamiento empieza con un pH de 2,61, al transcurso de 4 semanas disminuyó a un pH de 2,43 y finalmente a las 8 semanas se observó un aumento del pH de 2,77. En los dos estudios de almacenamiento realizados con vino de flor de Jamaica, los valores de pH coinciden dentro del nivel recomendado por Jackson, (2011) y Reeves, (2010), quienes describen que los pH inferiores a 3,5 son favorables para el mantenimiento de la vida útil puesto a que aumentan el poder antiséptico y la capacidad antioxidante del sulfitado, proporcionan a los vinos un sabor fresco, reducen el pardeamiento, se enriquece la intensidad colorante y el tono, y se minimiza la concentración de la forma fenólica más fácilmente oxidable de los polifenoles.
3.3 Análisis de acidez titulable
Como se muestra en las Figuras 3 y 4, el efecto del almacenamiento del vino de flor de Jamaica bajo dos condiciones de temperatura al transcurso de 14 días no fue significativo (P > 0, 05) respecto a la acidez titulable en relación al ácido cítrico y al ácido tartárico.
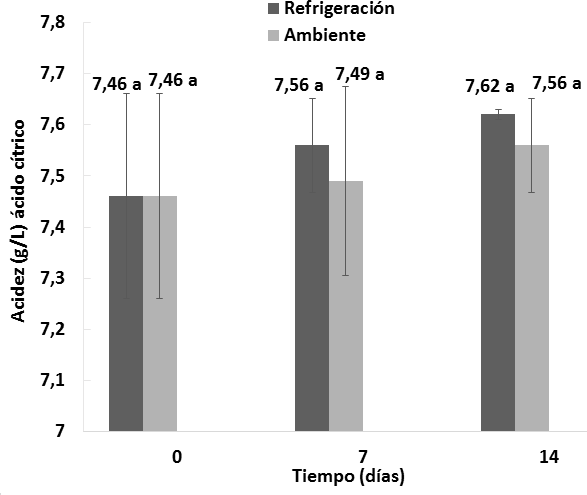
Figura 3. Comportamiento de la acidez titulable respecto al ácido cítrico en los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0,05.
Los vinos almacenados bajo dos condiciones de temperatura durante el transcurso de 14 días no presentaron diferencias significativas respecto a las cantidades de ácido cítrico y tartárico presentes. Las muestras iniciaron el proceso de almacenamiento en refrigeración con una acidez titulable de 7,46 g/L de ácido cítrico y 8,74 g/L de ácido tartárico, y culminaron a los 14 días con una acidez de 7,62 g/L de ácido cítrico y 8, 94 g/L de ácido tartárico. Para el caso de las muestras sometidas a condiciones ambientales, iniciaron el almacenamiento con una acidez de 7,46 g/L de ácido cítrico y 8,74 g/L de ácido tartárico, y culminaron a los 14 días con una acidez de 7,56 g/L de ácido cítrico y 8,86 g/L de ácido tartárico. De manera similar, Mounigan y Badrie, (2007) en su estudio de almacenamiento de vino de flor de Jamaica no reportaron diferencias significativas respecto a la acidez titulable con relación al ácido cítrico durante el periodo de 8 semanas de almacenamiento, debido a que sus muestras iniciaron con una acidez 4,2 g/L de ácido cítrico, y concluyeron a las 8 semanas con una acidez de 4,8 g/L de ácido cítrico.
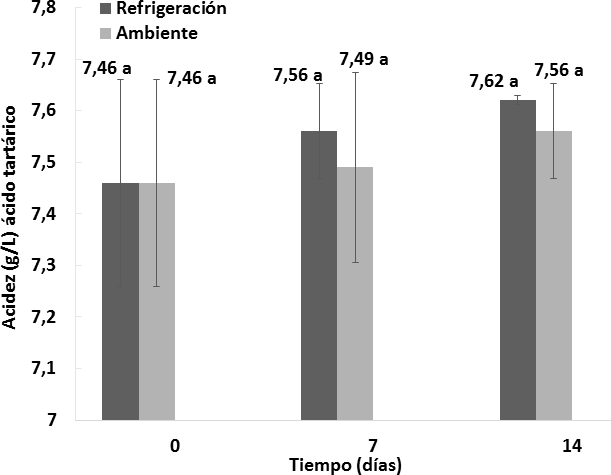
Figura 4. Comportamiento de la acidez titulable respecto al ácido tartárico en los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0,05.
De acuerdo con Jackson, (2011), la vida útil de todos los vinos se ve reforzada por un contenido de ácido deseable y un nivel de pH bajo, puesto a quea un nivel de acidez bajo favorece la oxidación de los compuestos fenólicos y la presencia del estado más fácilmente oxidado del fenolato, además tiene una gran influencia en la degradación de los ésteres frutales. Cuando la acidez del vino es indeseablemente baja, se puede ajustar hacia arriba mediante la adición de ácido tartárico o ácido cítrico, puesto a que son constituyentes naturales de las frutas, pero principalmente debido a que estos ácidos no son metabolizados adecuadamente por la mayoría de las bacterias, reduciendo así la probabilidad de deterioro microbiano.
3.4 Análisis de turbidez
Como se muestra en las Figura 5, el efecto del almacenamiento del vino de flor de Jamaica bajo dos condiciones de temperatura al transcurso de 14 días si fue significativo (p < 0,05) con respecto a la turbidez.
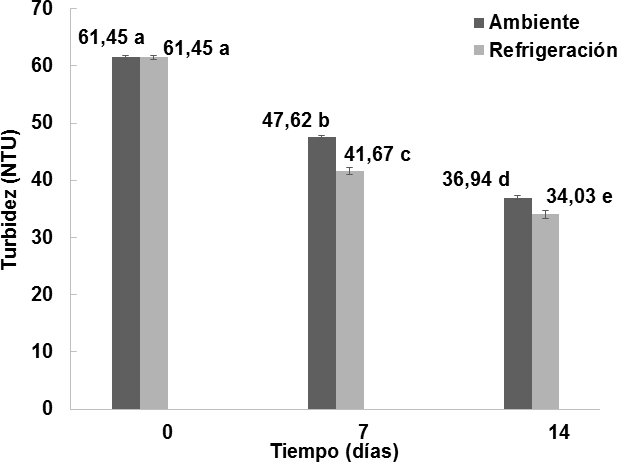
Figura 5. Comportamiento de la turbidez (NTU) en los vinos almacenados bajo dos condiciones de temperatura durante14 días. n = 2 Desviación estándar. Letras diferentes entre las medias indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0;05.
Se puede observar que las muestras de vino ingresaron a la etapa de almacenamiento con una turbidez de 61,45 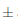 0, 3 NTU. Para el caso de las muestras que fueron sometidas a temperatura de ambiente a 21°C, la turbidez disminuyó notablemente hacia el día 7, alcanzando 47,62
0, 3 NTU. Para el caso de las muestras que fueron sometidas a temperatura de ambiente a 21°C, la turbidez disminuyó notablemente hacia el día 7, alcanzando 47,62 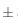 0, 2 NTU, y reduciéndose hasta en un 39, 88 % hasta el día 14 en el que se reportó 36,94
0, 2 NTU, y reduciéndose hasta en un 39, 88 % hasta el día 14 en el que se reportó 36,94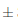 0,3 NTU. Para el caso de las muestras que fueron sometidas a temperatura de refrigeración a 6°C, la turbidez disminuyó más en comparación a los vinos almacenados en ambiente, puesto que hacia el día 7 llegaron a 41,67
0,3 NTU. Para el caso de las muestras que fueron sometidas a temperatura de refrigeración a 6°C, la turbidez disminuyó más en comparación a los vinos almacenados en ambiente, puesto que hacia el día 7 llegaron a 41,67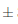 0, 6 NTU, y reduciéndose hasta en un 44,62 % hasta el día 14, en el que se reportó 34,03±0,7 NTU. Las muestras de vino sometidas a condiciones de refrigeración, tuvieron una mejor respuesta respecto al descenso de los valores de turbidez en el transcurso de los 14 días de almacenamiento, esto de acuerdo a Blouin y Peynaud, (2003), quienes describen que el efecto clarificante, ya sea por decantación o porfloculación con colas, es más intenso cuando se produce a bajas temperaturas, o a temperaturas de refrigeración.
0, 6 NTU, y reduciéndose hasta en un 44,62 % hasta el día 14, en el que se reportó 34,03±0,7 NTU. Las muestras de vino sometidas a condiciones de refrigeración, tuvieron una mejor respuesta respecto al descenso de los valores de turbidez en el transcurso de los 14 días de almacenamiento, esto de acuerdo a Blouin y Peynaud, (2003), quienes describen que el efecto clarificante, ya sea por decantación o porfloculación con colas, es más intenso cuando se produce a bajas temperaturas, o a temperaturas de refrigeración.
Sin embargo, durante el almacenamiento en reposo, los vinos a pesar de haber sido clarificados en un proceso previo de decantación, continúan sedimentándose en las botellas. La turbidez generalmente se debe a la presencia de las neblinas de flavonoles, taninos, cristales finos de quercetina y de ácido elágico (Jackson, 2011), que son polifenoles importantes en el vino y que continúan decantándose a lo largo del tiempo; por este motivo, las muestras sometidas a dos condiciones de almacenamiento tuvieron una disminución notoria en la turbidez, lo cual es favorables en sorialmente para los vinos, puesto a que adquieren propiedades de transparencia y limpidez (Blouin y Peynaud, 2003; Mijares y Sáez, 2007).
3.5 Análisis de color
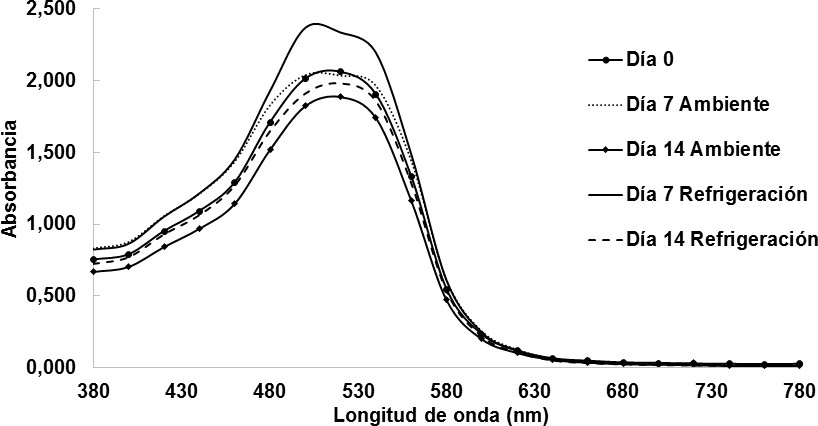
En la Figura 6 se observan las medias de las mediciones de absorbancia obtenidas mediante espectrofotometría, a través del barrido del espectro electromagnético (380 a 780 nm) de las muestras de vino sometidas a diferentes condiciones de almacenamiento. Se pudo comprobar que todas las muestras tienen el mayor valor de absorbancia entre 500 y 520 nm, ubicando la región del color rojo. Mariño y col., (2017), en su estudio de color en vino de mora de castilla (Rubus glaucus benth) reporta un comportamiento similar de las absorbancias, situándose en un rango entre 515 y 520 nm. De acuerdo con Jackson, (2011) y Reeves, (2010), los resultados de ambos estudios arrojan resultados similares puesto a que tanto la flor de Jamaica como la mora de castilla son materias primas ricas en antocianinas y otros compuestos fenólicos responsables de la pigmentación roja en los vinos.
Así mismo, el método de Glories permitió determinar: la intensidad colorante (IC), el tono (T), elporcentaje de amarillo, el porcentaje de rojo y el porcentaje de azul en las muestras de vino sometidas a dos condiciones distintas de almacenamiento.
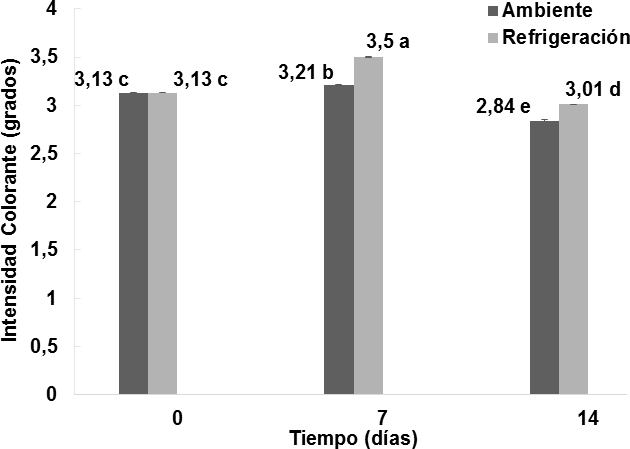
Figura 7. Comportamiento de la intensidad colorante en los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias, indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0, 05.
La intensidad colorante es una característica cromática relacionada con la luminosidad. En la Figura7 se puede observar que el efecto del almacenamiento del vino de flor de Jamaica bajo dos condiciones de temperatura al transcurso de 14 días si fue significativo (p < 0;05) respecto a la intensidad colorante. El vino sometido a condiciones de almacenamiento en refrigeración durante 7 días presentó el valor más alto 3;5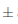 0,005 IC, sufriendo una ligera disminución en el día 14 a 3,01
0,005 IC, sufriendo una ligera disminución en el día 14 a 3,01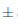 0,001 IC. Para el caso del vino sometido a condiciones de almacenamiento ambientales al día 7, éste presentó un valor bajo de 3,21
0,001 IC. Para el caso del vino sometido a condiciones de almacenamiento ambientales al día 7, éste presentó un valor bajo de 3,21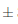 0,005 IC, disminuyendo finalmente al día 14 a 2,84
0,005 IC, disminuyendo finalmente al día 14 a 2,84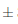 0,009 IC. De acuerdo con Jackson, (2011), las temperaturas bajas o de refrigeración evitan el desarrollo de las reacciones de Maillard que pueden generar compuestos que afecten a la luminosidad del vino. Por otro lado, ralentizan la oxidación de los compuestos fenólicos flavonoides; especialmente las catequinas en quinonas, que pueden modificar las propiedades cromáticas y generar pigmentos de colores parduzcos que brinden opacidad al vino. Es por este motivo que los vinos almacenados a temperaturas de refrigeración presentan valores más altos de intensidad colorante, respectoa las muestras almacenadas a temperatura ambiente.
0,009 IC. De acuerdo con Jackson, (2011), las temperaturas bajas o de refrigeración evitan el desarrollo de las reacciones de Maillard que pueden generar compuestos que afecten a la luminosidad del vino. Por otro lado, ralentizan la oxidación de los compuestos fenólicos flavonoides; especialmente las catequinas en quinonas, que pueden modificar las propiedades cromáticas y generar pigmentos de colores parduzcos que brinden opacidad al vino. Es por este motivo que los vinos almacenados a temperaturas de refrigeración presentan valores más altos de intensidad colorante, respectoa las muestras almacenadas a temperatura ambiente.
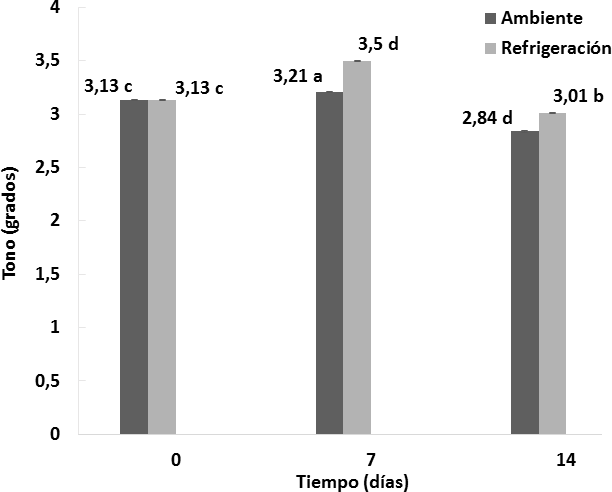
Figura 8. Comportamiento de la tonalidad en los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias, indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0, 05.
El matiz o tono (T) es el factor de cualidad del color y corresponde a la longitud de onda dominante (amarillo, rojo, azul) que caracteriza la tonalidad del vino (García Barceló, 1990) y expresa la variación cualitativa del color en la muestra (Iñiguez ycol., 1995). En la Figura 8 se puede observar que el efecto del almacenamiento del vino de flor de Jamaica bajo dos condiciones de temperatura al transcurso de 14 días si fue significativo (p < 0;05) respectoa la tonalidad. Las muestras de vino iniciaron el proceso de almacenamiento con una tonalidad de 0,46° 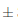 0,004; las muestras sometidas a condiciones de almacenamiento en refrigeración sufrieron ligeras variaciones en el tono, culminando en el día 14 con un valor de 0,47°
0,004; las muestras sometidas a condiciones de almacenamiento en refrigeración sufrieron ligeras variaciones en el tono, culminando en el día 14 con un valor de 0,47°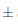 0,001. Las muestras sometidas a condiciones de almacenamiento en ambiente mostraron una variación más significativa, siendo la del día 7 la más elevada con un valorde 0,52°
0,001. Las muestras sometidas a condiciones de almacenamiento en ambiente mostraron una variación más significativa, siendo la del día 7 la más elevada con un valorde 0,52°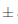 0,002 para T, este valor superior del tono está estrechamente relacionado con el elevado porcentaje de rojo como que se puede observar en la Figura 9 en esta muestra.
0,002 para T, este valor superior del tono está estrechamente relacionado con el elevado porcentaje de rojo como que se puede observar en la Figura 9 en esta muestra.
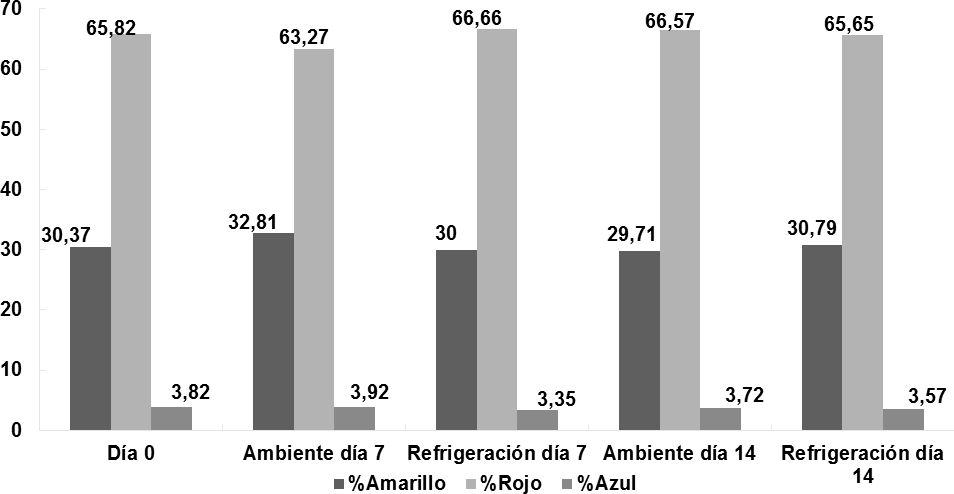
Los componentes polifenólicos son las principales sustancias en los vinos que absorben las radiaciones y por lo tanto son las responsables de los colores que reflejan (Iñiguez y col., 1995). En la Figura 9 se pueden observar los diferentes porcentajes de pigmentos amarillos, rojos y azules presentes en las muestras de vino sometidas a dos condiciones de almacenamiento. Todos los vinos coinciden con un porcentaje elevado de color rojo de alrededor del 65%. De acuerdo con Da-Costa Rocha y col., (2014), la flor de Jamaica es rica en antocianinas principalmente en delfinidina-3-sambubiosido, delfinidina- 3-glucósido y cianidina-3-glucósido, que corresponden a cationes flavilios y a un valor de pH entre 1 y 3, y son los responsables de reflejar el color rojo. En la Figura 9 también se puede observar que todos los vinos bajo condiciones de estudio tienen un contenido de alrededor de 30% de amarillo, concordante a lo descrito por Galicia Flores y col., (2008), quienes reportan que la flor de Jamaica es rica en compuestos fenólicos como Quercetina, Quercetina-3- glucósido, Quercetina-3-rutinosa y Kaempferol, y que de acuerdo a Jackson, (2011), son responsables de reflejar el color amarillo. Además, se observa que todas las muestras tienen colores inferiores a los anteriores de cerca de 4% de azul; según Yang y col., (2011), ciertas antocianinas del grupo quinonoides presentes en la flor de Jamaica son las responsables de reflejar el color azul.
Las variaciones significativas (p < 0;05) respecto a los porcentajes de colores amarillo, rojo y azul en las muestras de vino sometidas a diferentes condiciones de almacenamiento durante 14 días, concuerdan con lo descrito por Jackson, (2011). Quien, en su estudio de color en vinos asevera que cambios de color durante el almacenamiento se consideran normales, y no contribuyen a la reducción de la vida útil del producto. Reeves, (2010), describe que durante el almacenamiento los complejos glicosilados formados por las antocianinas pueden romperse, quedando susceptibles a la oxidación que generauna degradación del color y que muchas otras reacciones bioquímicas sucedidas durante esta etapa generan una gama de pigmentos que le dan características específicas a cada vino.
3.6 Análisis de Contenido de Polifenoles
3.6.1 Contenido de Polifenoles durante el proceso de vinificación y decantación del vino de flor de Jamaica
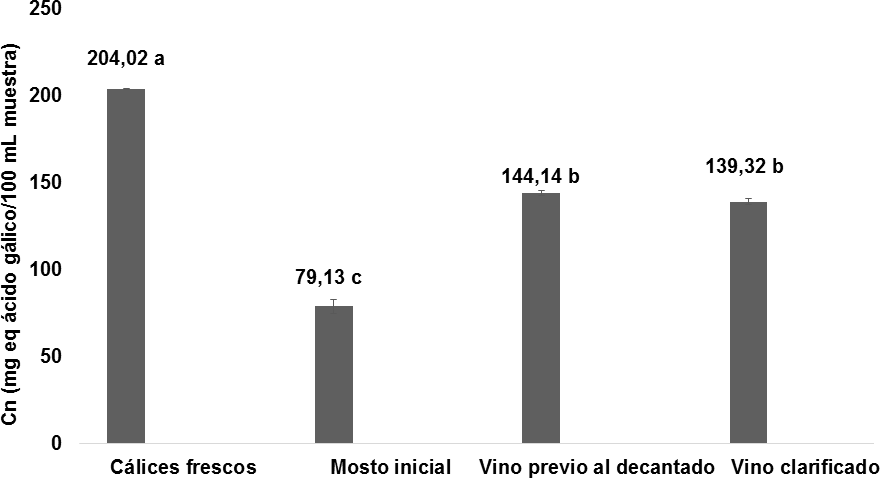
En la Figura 10 se observa la evolución significativa del contenido de polifenoles desde la materia prima hasta la clarificación del vino. El contenido de polifenoles en los cálices frescos de flor de Jamaica fue de 204,02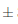 0,4 mg equ. ácido gálico/100 g muestra dando un valor similar a los reportados por Zhen y col., (2016) y Sindi, Marshall y Morgan, (2014) de 189, 8 mg equ. ácido gálico/100 g y 216, 7 mg equ. ácido gálico/100 g, respectivamente. Las diferencias de estos valores se debe por el mé- todo de extracción utilizado por los autores Zhen y Sindi, quienes emplearon soluciones extractoras de metanol/agua 70% v/v, además de la variedad de flor de Jamaica utilizada en cada estudio y su grado de maduración. El mosto inicial corregido presentó un valor inferior al del contenido de polifenoles de los cálices frescos de 79,13
0,4 mg equ. ácido gálico/100 g muestra dando un valor similar a los reportados por Zhen y col., (2016) y Sindi, Marshall y Morgan, (2014) de 189, 8 mg equ. ácido gálico/100 g y 216, 7 mg equ. ácido gálico/100 g, respectivamente. Las diferencias de estos valores se debe por el mé- todo de extracción utilizado por los autores Zhen y Sindi, quienes emplearon soluciones extractoras de metanol/agua 70% v/v, además de la variedad de flor de Jamaica utilizada en cada estudio y su grado de maduración. El mosto inicial corregido presentó un valor inferior al del contenido de polifenoles de los cálices frescos de 79,13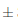 3,9 mg equ. ácido gálico/100 mL en la muestra, esto se debe al 70% de contenido de agua que posee el mosto.
3,9 mg equ. ácido gálico/100 mL en la muestra, esto se debe al 70% de contenido de agua que posee el mosto.
Después del proceso de vinificación, la cantidad de polifenoles obtenidos en el vino es significativamente superior al del mosto inicial, dando un valor de 144,14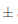 1,5 mg equ. ácido gálico/100 mL en la muestra. Este aumento notorio del contenido fenólico despues de la vinificación es similar al estudio comparativo de la composición fenólica de la uva y del vino realizado por Flanzy, (2003). Además de que en la etapa fementativa se generan otros compuestos fenólicos resultantes de la evolución de los polifenoles nativos de la materia prima utilizada para la elaboracion del vino (Pérez Jiménez y col., 2010; Hidalgo T., 2011). Una vez obtenido el vino clarificado se presentó un valor de 139,32
1,5 mg equ. ácido gálico/100 mL en la muestra. Este aumento notorio del contenido fenólico despues de la vinificación es similar al estudio comparativo de la composición fenólica de la uva y del vino realizado por Flanzy, (2003). Además de que en la etapa fementativa se generan otros compuestos fenólicos resultantes de la evolución de los polifenoles nativos de la materia prima utilizada para la elaboracion del vino (Pérez Jiménez y col., 2010; Hidalgo T., 2011). Una vez obtenido el vino clarificado se presentó un valor de 139,32 1,6 mg equ. ácido gálico/100 mL por muestra, sin mostrar diferencia significativa en comparación con el vino previo a la decantación; este desceso de contenido de polifenoles es normal de acuerdo con lo descrito por Blouin y Peynaud, (2003), debido a que durante el proceso de decantación, los taninos eliminados durante la clarificacion es escasa pero es variable en concentraciones desde 50 a 300 mg/L.
1,6 mg equ. ácido gálico/100 mL por muestra, sin mostrar diferencia significativa en comparación con el vino previo a la decantación; este desceso de contenido de polifenoles es normal de acuerdo con lo descrito por Blouin y Peynaud, (2003), debido a que durante el proceso de decantación, los taninos eliminados durante la clarificacion es escasa pero es variable en concentraciones desde 50 a 300 mg/L.
3.6.2 Estudio de la estabilidad del contenido de polifenoles durante el proceso de almacenamiento de vino de flor de Jamaica
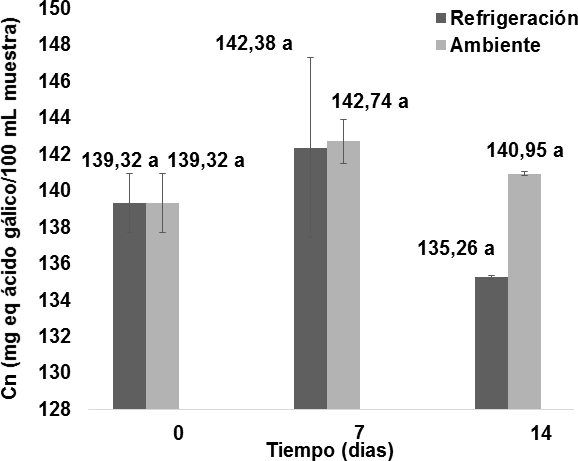
En el día 0 el contenido de polifenoles totales fue de139,32 1,6 mg equ. ácido gálico/100 mL (Figura11) y no presentó diferencias significativas respe to a los valores obtenidos durante el transcurso de los 14 días de estudio bajo dos condiciones de temperatura, por lo que se observa que la cantidad de compuestos fenólicos presentes en las muestras de vino permacenieron estables a pesar del transcurso del tiempo y de las temperaturas de almacenamiento. Estudios realizados afirman que la flor de Jamaica tiene un importante contenido fenólico, entre el cual se identifican principalmemnte los flavonoides y antocianinas, responsables del color de tinto del vino (Camussoni y Carnevali, 2004; Da-Costa Rocha y col., 2014; Chen y col., 2013; Zhen y col., 2016).
1,6 mg equ. ácido gálico/100 mL (Figura11) y no presentó diferencias significativas respe to a los valores obtenidos durante el transcurso de los 14 días de estudio bajo dos condiciones de temperatura, por lo que se observa que la cantidad de compuestos fenólicos presentes en las muestras de vino permacenieron estables a pesar del transcurso del tiempo y de las temperaturas de almacenamiento. Estudios realizados afirman que la flor de Jamaica tiene un importante contenido fenólico, entre el cual se identifican principalmemnte los flavonoides y antocianinas, responsables del color de tinto del vino (Camussoni y Carnevali, 2004; Da-Costa Rocha y col., 2014; Chen y col., 2013; Zhen y col., 2016).
A pesar de no existir una diferencia significativa entre las dos temperaturas ni en el tiempo de almacenamiento, en la Figura 11 se observa que las muestras sometidas a refrigeración tienen un contenido fenólico ligeramente menor en comparación a las muestras sometidas a temperatura ambiente, lo que explica que el vino durante el almacenamiento se encuentra decantándose constantemente y la temperatura de refrigeración favorece a la sedimentación de las moléculas grandes polimerizadas de taninos (Blouin y Peynaud, 2003; Jackson, 2011).
3.7 Importar tabla Análisis de la Capacidad Antioxidante
3.7.1 Capacidad antioxidante durante los procesos de vinificación y decantación del vino de flor de Jamaica
La Figura 12 indica las diferencias significativas que hubo en la capacidad antioxidante durante el proceso de elaboración del vino; en los extractos de los cálices frescos de flor de Jamaica la capacidad antioxidante fue de 13,74 0,1 Equiv mM Trolox/100g por muestra, similar al reportado por Zhen y col.,(2016) de 15,25 Equiv mM Trolox/100 g, y superior al reportado por Sáyago Ayerdi y Goñi, (2010) de 9,08 Equiv mM Trolox/100 g. La diferencia entre estos valores puede deberse al método de extracción, ya que la actividad antioxidante depende de la concentración del extracto, y las mejores respuestas obtenidas dependen de los disolventes aplicados (Kuskoski y col., 2005).
0,1 Equiv mM Trolox/100g por muestra, similar al reportado por Zhen y col.,(2016) de 15,25 Equiv mM Trolox/100 g, y superior al reportado por Sáyago Ayerdi y Goñi, (2010) de 9,08 Equiv mM Trolox/100 g. La diferencia entre estos valores puede deberse al método de extracción, ya que la actividad antioxidante depende de la concentración del extracto, y las mejores respuestas obtenidas dependen de los disolventes aplicados (Kuskoski y col., 2005).
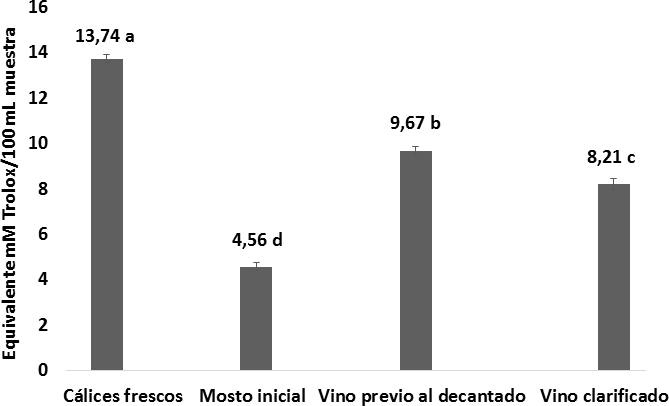
Figura 12. Comportamiento de la capacidad antioxidante desde la materia prima hasta los procesos de vinificación y decantación. n = 2 Desviación estándar. Letras diferentes entre las medias, indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0, 05.
En el mosto se observa que existió una disminución en la capacidad antioxidante presentando valores de 4,56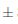 0,1 Equiv mM Trolox /100 mL por muestra. En el estudio de comparación de actividad antioxidante en vinos tintos y blancos de determinó que existe una correlación directa entre los polifenoles totales y la actividad antioxidante (Vinson y Hontz, 1995), motivo por el cual se explica que el mosto inicial al contener una cantidad de polifenoles totales baja también tuvo una capacidad antioxidante baja (Figura 12), ya que existe una relación lineal entre los polifenoles totales y el valor de la capacidad de captar radicales libres o actividad antioxidante (Avalos Llano, Sgroppo y Avanza, 2003). En la etapa de vinificacion, la capacidad antioxidante aumenta a 9,670,2 Equiv mM Trolox/100 mL por muestra, aumento que está relacionado con el incremento del contenido fenólico después de la fermentación (Flanzy, 2003; Hidalgo T., 2011). Finalmente, la actividad antioxidante en el vino clarificado fue de 8,21
0,1 Equiv mM Trolox /100 mL por muestra. En el estudio de comparación de actividad antioxidante en vinos tintos y blancos de determinó que existe una correlación directa entre los polifenoles totales y la actividad antioxidante (Vinson y Hontz, 1995), motivo por el cual se explica que el mosto inicial al contener una cantidad de polifenoles totales baja también tuvo una capacidad antioxidante baja (Figura 12), ya que existe una relación lineal entre los polifenoles totales y el valor de la capacidad de captar radicales libres o actividad antioxidante (Avalos Llano, Sgroppo y Avanza, 2003). En la etapa de vinificacion, la capacidad antioxidante aumenta a 9,670,2 Equiv mM Trolox/100 mL por muestra, aumento que está relacionado con el incremento del contenido fenólico después de la fermentación (Flanzy, 2003; Hidalgo T., 2011). Finalmente, la actividad antioxidante en el vino clarificado fue de 8,21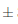 0,2 Equiv mM Trolox/100 mL muestra. Este descenso en la actividad antioxidante es normal ya que durante la decantación se va perdiendo taninos y otros polifenoles polimerizados (Blouin y Peynaud, 2003).
0,2 Equiv mM Trolox/100 mL muestra. Este descenso en la actividad antioxidante es normal ya que durante la decantación se va perdiendo taninos y otros polifenoles polimerizados (Blouin y Peynaud, 2003).
3.7.2 Estudio de la estabilidad de la capacidad antioxidante durante el proceso de almacenamiento del vino de flor de Jamaica
La capacidad antioxidante del vino de flor de Jamaica no presenta diferencias significativas entre las muestras y el tiempo, sin embargo las muestras sometidas a refrigeración tienen una capacidad antioxidante ligeramente menor en comparación a las muestras sometidas a temperatura ambiente (Figura 13), lo que se explica debido a que el fenómeno de sedimentación de los taninos sucede más rápido a temperaturas de refrigeración (Blouin y Peynaud, 2003).
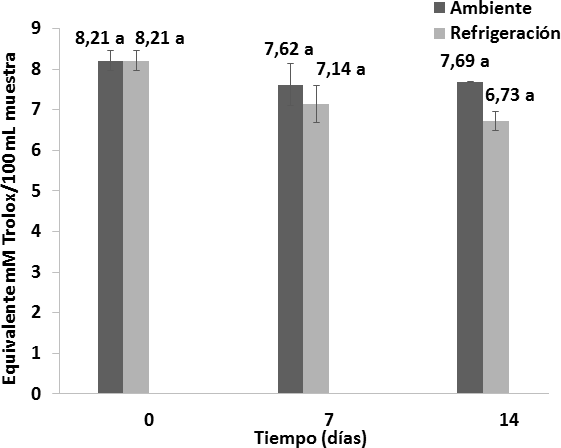
Figura 13. Comportamiento de la capacidad antioxidante de los vinos almacenados bajo dos condiciones de temperatura durante 14 días. n = 2 Desviación estándar. Letras diferentes entre las medias, indican diferencias significativas de acuerdo con la prueba de Tukey a p < 0, 05.
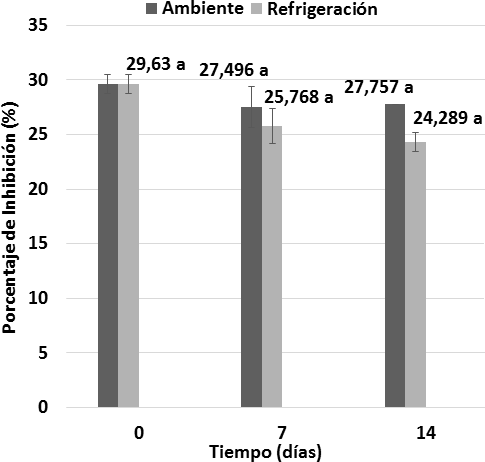
Así mismo en el análisis estadístico realizado para la determinación del porcentaje de inhibición del radical ABTS (Figura 14), se observaron las diferencias entre las temperaturas de almacenamiento, es por ello que las muestras sometidas a refrigeración tuvieron un porcentaje de inhibición ligeramente menor en comparación a las muestras sometidas a temperatura ambiente, lo que explica que el porcentaje de inhibición está estrechamente relacionado a la disminución de la capacidad antioxidante en las muestras. El porcentaje de inhibición de los antioxidantes contenidos en los vinos de flor de Jamaica presentaron valores similares a los vinos de uva del estudio de la evaluación de la actividad antioxidan- te sometidos a distintos tiempos de envejecimiento; donde se reportan valores promedio de 2,44 Equiv mM Trolox/100 mL y un porcentaje de inhibición de 10,59 % para el vino Oporto, 45, 04 % para el vino Barbera Malbec, 15,93 Equiv mM Trolox/100 mL yun porcentaje de inhibición de 77,71% para el vino Cabernet-Sauvignon, 16,45 Equiv mM Trolox/100mL y un porcentaje de inhibición 80,28% para el vino Merlot (Jáuregui y col., 2007). De acuerdo conestas comparaciones, se puede determinar que los vinos de flor de Jamaica sometidos al estudio de estabilidad durante el almacenamiento bajo dos condiciones de temperatura tienen, en general, una capacidad antioxidante y un porcentaje de inhibición de radicales libres intermedios, en comparación a los vinos de uva.
4 Conclusiones
La cantidad de sólidos solubles, el pH y la acidez titulable tanto para el ácido cítrico como para el ácido tartárico del vino se mantuvo estable tanto en la condición de refrigeración, como en la condición a temperatura ambiente durante los 14 días de almacenamiento gracias al adecuado sulfitado que recibieron todas las muestras de vino que eliminó la presencia de microrganismos, manteniendo su dulzura y favoreciendo la oxidación de los compuestos fenólicos y la presencia del estado más fácilmente oxidado del fenolato.
Respecto al análisis de turbidez, si se encontrarondiferencias significativas entre las dos condicionesde almacenamiento, siendo las muestras de vino sometidasa refrigeración durante 14 días las que presentaronuna velocidad de decantación más alta que las muestras sometidas al ambiente. Con respecto al barrido espectrofotométrico, se concluye que todas las muestras sometidas a dos condiciones de almacenamiento durante 14 días presentaron sus ni- veles más altos de absorbancias en un rango entre 515 y 520 nm representativo de los pigmentos que reflejan el color rojo, los cuales corresponden a una alta concentración de antocianinas. El método de Glories permitió identificar una diferencia significativa entre las muestras sometidas a refrigeración, que tuvieron valores más elevados de intensidad colorante y de tono que las muestras sometidas al ambiente durante 14 días, ya que a temperatura de refrigeración se evita el desarrollo de las reacciones de Maillard que pueden generar compuestos que afectan la luminosidad del vino, y se ralentiza la oxidación de compuestos fenólicos como los flavonoides que pueden modificar sus características cromáticas. Por otro lado, todas las mues- tras de vino coinciden con un porcentaje elevado de color rojo de alrededor del 65% que confirman que la flor de Jamaica es rica en antocianinas principal- mente en delfinidina-3-sambubiosido, delfinidina- 3-glucósido y cianidina-3-glucósido, que corresponden a cationes flavilios y a un valor de pH entre 1 y 3, son responsables de reflejar el color rojo. Además todos los vinos tienen un contenido considerable de alrededor de 30% de amarillo, el cual es generado por polifenoles que reflejan este color como la quercetina, quercetina-3-glucósido, quercetina-3- rutinosa y kaempferol.
La estabilidad y capacidad antioxidante del vino de flor de Jamaica es mayor a temperatura ambiente disminuyendo la probabilidad de oxidación de compuestos fenólicos presentes en el vino. El contenido de polifenoles está directa y linealmente relacionado con la capacidad antioxidante, lo cual es favorable para el mantenimiento de la vida útil del vino de Flor de Jamaica. De acuerdo con las referencias consultadas, el contenido de polifenoles, la capacidad antioxidante y el porcentaje de inhibición de EROS del vino de flor de Jamaica es intermedio entre los valores reportados en los distintos tipos de vinos de uva.