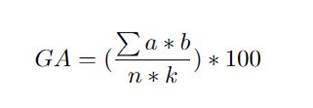Introducción
El maíz es una gramínea ampliamente producida en el mundo y su cultivo está vinculado a diversos aspectos económicos, sociales y culturales en América Latina. En el 2020 en Ecuador el cultivo de maíz ocupó una superficie de 341300 hectáreas y la producción fue de 1 358 626 toneladas, con un rendimiento promedio de 3,8 t ha-1, aunque en términos de área hubo un incremento del 5,7% la producción decreció en un 7% con relación al año anterior [1, 2].
De la producción nacional de maíz, la provincia de Santa Elena aporta con 21 528 t y una superficie de 3 327 ha con un rendimiento medio de 6,47 t ha-1 [3]. Debido a la gran expansión de la frontera agrícola y simplificación de los agroecosistemas, los cultivos se han visto más susceptibles al ataque de plagas [4]. Dentro de estas plagas se destaca el gusano cogollero Spodoptera frugiperda (Smith) el cual es un insecto nativo de América y extendido hacia África [5], Asia [6] y Europa [7].
Actualmente se lo considera una plaga clave en el cultivo de maíz y la más destructiva de América [8], ya que al alimentarse del tejido foliar de la planta causa reducciones del rendimiento de entre el 15 al 60% y de hasta el 100% en plantas jóvenes [9]. Su aparición en el cultivo de maíz se da después de la emergencia de las plantas y durante todo el periodo del cultivo, sin embargo, el periodo de mayor susceptibilidad de la planta es alrededor de los 40 días después de la siembra [10].
S. frugiperda se caracteriza por tener una reproducción acelerada, alta actividad migratoria, gran poder de aclimatación y capacidad de alimentarse de diversas especies, lo que hace que su control sea complejo [11].
De manera histórica, el control del gusano cogollero se ha realizado usando insecticidas de amplio espectro; sin embargo, su uso intensivo ha generado la aparición de resistencia, además de los efectos de estos en la resurgencia de plagas, contaminación ambiental e intoxicación de quienes los aplican [12, 13,14]. Para reducir el efecto negativo del control químico es necesario se desarrollen de manera constante investigaciones que involucren tácticas de control alternativo dentro del manejo integrado de plagas (MIP) como lo son metabolitos secundarios, entomopatógenos, parasitoides, depredadores y otros que ya tienen eficiencia comprobada [15].
Dentro del control biológico como método en el MIP, resaltan los parasitoides, los cuales son usados para control especifico de insectos plaga debido a su comportamiento caracterizado por capacidad de búsqueda y especificidad [16] y que conforman hasta el 76% de la entomofauna benéfica [17]. El empleo de especies del género Trichogramma en el control biológico de lepidópteros está ampliamente distribuido en el mundo [18].
Por lo tanto, el objetivo de la investigación fue evaluarla eficacia del Trichogramma sp. como controlador biológico de Spodoptera frugiperda en el cultivo de maíz en la comuna San Marcos, parroquia Colonche.
Materiales y Métodos
La investigación se realizó en la comuna San Marcos, de la parroquia Colonche, provincia de Santa Elena entre enero y abril de 2020.
Se estableció un cultivo con semillas de maíz híbrido Hércules previamente tratadas con fungicida, se colocó 2 semillas por hoyo en un marco de plantación de 1,15 metros entre hileras x 0,15 metros entre plantas, para una densidad de 58 823 plantas ha-1. El cultivo se fertilizó vía edáfica a los 15 días después de germinadas las plantas (DDG) con urea. El riego se mantuvo de manera regular. Se realizaron tres controles manuales de malezas a los 15, 30 y 45 días después de haber emergido las plantas. A los 20 DDG se procedió a realizar una aplicación de insecticida con la finalidad de reducir la presencia de S. frugiperda en la plantación y tener condiciones similares en todas las unidades experimentales.
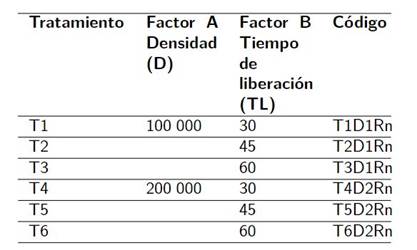
Se utilizó un diseño experimental completamente al azar (DCA) con arreglo factorial 2*3 (seis tratamientos), con 4 repeticiones. Cada unidad experimental estuvo conformada por un área de 70 m2 compuesta por seis hileras de maíz de 10 m de largo. El primer factor corresponde a dos densidades de individuos de Trichogramma sp. (D1=100 000 y D2=200 000 individuos ha-1) y el segundo a tres tiempos de liberación del parasitoide (TL1 = 30 días, TL2 = 45 días y TL3= 60 días) como se puede observar en la Tabla 1.
Como controlador biológico se usó el parasitoide Trichogramma sp., proveniente del centro de producción de entomófagos del laboratorio BIOSEDINSA.S.A. ubicado en el cantón La Libertad, provincia de Santa Elena. La presentación del parasitoide fue en forma de cartuchos de una pulgada cuadrada conteniendo 100 000 huevos (Figura 1).

Fig. 1: Presentación comercial del parasitoide Trichogramma sp. en forma de cartucho de una pulgada cuadrada.
Para la liberación de las dos densidades (100 000 y 200.000 individuos∙ha-1) de Trichogramma sp., se consideraron tres tiempos relacionados con el estadio vegetal del cultivo en que es más susceptible al ataque de S. frugiperda. Se hizo una liberación temprana a los 30 DDG, en pleno desarrollo vegetativo del cultivo; una segunda liberación semi-tardía a los 45 DDG, y una liberación tardía a los 60 DDG, cuando el cultivo comenzó su etapa de floración. En la Figura 2 se observa un esquema temporal del experimento.
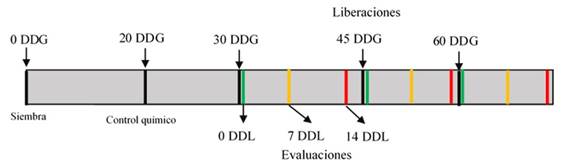
Fig. 2: Esquema del experimento realizado para la evaluación de los tratamientos con dos densidades del parasitoide Trichogramma sp. (100.000 y 200.000individuos∙ha-1), en tres tiempos de liberación después de la germinación de las plantas (30, 45 y 60 DDG).
Los insectos fueron liberados en cartuchos de una pulgada cuadrada, donde cada cartucho contenía en media 3 200 huevos del depredador (Figura 3), cada tratamiento estuvo constituido por la liberación de 32 cartuchos, que equivalen a 100 000 huevos∙ha-1, en los tratamientos dobles se utilizaron 64 cartuchos. Los cartuchos se colocaron en la lígula de la planta como se aprecia en la Figura 3. Al momento de realizar la aplicación del parasitoide se consideró las recomendaciones de BIOSEDINSA.S.A.

Fig. 3: Colocación de los cartuchos conteniendo huevos de Trichogramma sp. en la lígula de la planta de maíz.
Al momento de realizar las liberaciones de los cartuchos del parasitoide Trichogramma sp., se dividió el área experimental en 4 franjas, en cada franja se seleccionaron 2 hileras, en cada hilera 4 puntos y, por último, se dejó un borde de entre 5 a 10 metros entre cada área.
Se evaluaron a los 0,7 y 14 días después de la liberación de los parasitoides (DDLP) las variables Incidencia (%I), Grado de Afectación por Cogollero (GAC) y Masade Huevecillos por Planta (MHP). La incidencia se determinó usando la siguiente formula:
El grado de afectación por cogollero (GAC) se determinó mediante una escala visual de 0 a 4 según lo propuesto por Davis and Williams [19], considerando el 0 como daño ligero sin perforaciones y el 4 con mayor daño. En la Figura 4 se puede observar los valores establecidos en la escala.

Fig. 4: Escala visual para la atribución de valores de0-4 del nivel de daño de S. Frugiperda en el cultivo de maíz [19]
Con la información aportada por la escala visual se procedió a calcular el Grado de Afectación por Cogollero (GAC) utilizando la fórmula propuesta por [20].
Donde:
GA |
: Grado de ataque o severidad. |
∑(a∗b) |
: Sumatoria del número de plantas afectadas según el grado de afectación. |
n |
: Número de plantas evaluadas. |
k |
: Valor o grado de la escala. |
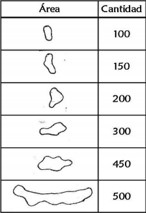
Finalmente, se evalúo la masa de huevecillos de S. frugiperda por planta (MHP) siguiendo la escala propuesta por INSAI, 2011 en [21] (Figura 5).
Se comprobó la normalidad de los datos mediante la prueba de Kruskall-Wallis; el análisis de la varianza de realizó en el programa estadístico SISVAR [23]. Cuando los efectos fueron significativos se realizó el Test de Tukey para comparaciones de medias con un nivel de significancia p<0,05. Los gráficos fueron elaborados en Microsoft Excel 2010.
Resultados y Discusión
3.1. Incidencia
El porcentaje de incidencia deS. frugiperdasobre el cultivo de maíz se relacionó con el tiempo de liberación, independientemente de la densidad deTrichogramma sp.en los tres momentos evaluados. Liberaciones tempranas representaron reducciones del 10, 14 y 16% cuando comparadas con liberaciones tardías para bajas densidades y del 12% para densidades mayores a los 0, 7 y 14 DDL (Figura 6). Por otro lado, la densidad de individuos deTrichogramma sp.tuvo un efecto significativo sobre la reducción del porcentaje de incidencia deS. frugiperdaúnicamente durante la última evaluación a los 14 DDL (Figura 6). En los tres tiempos de liberación la densidad más alta de individuos de Trichogramma sp. (D2) redujo en 4,4%, 4,7% y 9,1% el %I cuando se compara con la densidad más baja (D1).
La eficiencia de las densidades deTrichogramma spestá relacionada con las densidades de la plaga y el número de liberaciones, densidades de 22 500 individuos por hectárea han reportado parasitismo del 92% en México [24].
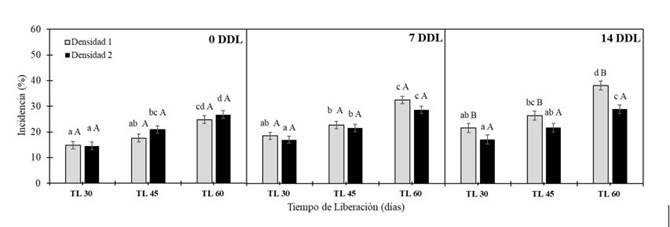
Nota: Medias seguidas de letras mayúsculas iguales entre densidades y minúsculas entre tiempos de liberación no difieren estadísticamente entre sí por el test de Tukey (p<0,05).
Fig. 6.Escala Porcentaje de Incidencia deS. frugiperdaen plantas de maíz bajo el efecto de dos densidades del parasitoideTrichogramma sp.(100 000 y 200 000 individuos∙ha−1) en tres tiempos de liberación (30, 45 y 60 días) evaluados a los 0, 7 y 14 días
3.2. Grado de afectación por cogollero (GAC)
En relación con la variable grado de afectación por cogollero (GAC) resultó que mientras menor sea el tiempo en que se realice las liberaciones del entomófago, esta será independiente al grado de afectación por cogollero (GAC), disminuyendo de manera significativa durante las tres evaluaciones. De los tres tiempos de liberación evaluados, los que disminuyeron de manera significativa el GAC fueron los tratamientos D1TL30 Y D2TL30. En términos relativos significó la reducción en GAC de 10 y 12,2% a los 0 DDL, 14 y 11,6% a los 7DDL y 16,4 y 11,7% a los 14 DDL (Figura 7) para los tratamientos de densidades D1 y D2, siendo estos los mejores resultados comparados con los tiempos de liberación mayores (TL 60).
Durante la última evaluación realizada a los 14 DDL (Figura 7), se apreció que la densidad deTrichogramma sp. tuvo un efecto significativo en la reducción deS. frugiperdacontrolando de óptima manera el GAC. Demostrando así, que los tiempos de liberación del parasitoide más cortos controlan de manera significativa la población deS. frugiperda, es decir que la liberación de 30 días fue más favorecedora en la reducción de esta variable, a la vez, esta se ve intensificada cuando la densidad deTrichogramma sp.es mayor (D2) reduciéndolo en un 4,4%, 4,7% y 9,1% el GAC cuando es comparado con la densidad más baja (D1). El comportamiento observado podría estar relacionado con que altas densidades del parasitoide tendrían mayor posibilidad de infectar mayor cantidad de larvas deS. frugiperdaaun en liberaciones tardías acentuándose ese efecto con los días después de la liberación. Lo cual coincide con lo expresado por Castillo et al. (2006), quienes observaron que altas densidades del parasitoide incrementaron hasta en un 45% el índice de parasitismo en el día 16 después de la liberación [25].
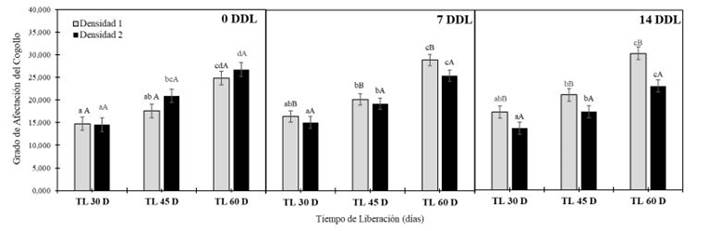
Nota: Medias seguidos de las letras mayúscula iguales entre densidades y minúsculas entre tiempos de liberación no difieren estadísticamente entre sí por el test de Tukey (p<0,05).
Fig. 7.Escala Grado de afectación del cogollo porS. frugiperdabajo el efecto de dos densidades del parasitoideTrichogramma sp.(100 000 y 200 000 individuos∙ha−1) en tres tiempos de liberación (30, 45 y 60 días) evaluados a los 0, 7 y 14 días.
3.3. Masa de huevecillos por planta (MHP)
Con relación a la variable Masa de huevecillos por Planta, se observaron diferencias significativas para el TL 30 durante las tres evaluaciones, mientras que el factor densidad solo fue significativo cuando fue evaluado a los 7 y 14 DDL. Las liberaciones tempranas del parasitoideT. sp.redujeron en un 6,8 y 2,6% en las densidades D1 y D2, siendo esta liberación la ideal en comparación a las liberaciones medias y tardías. En el caso de las liberaciones medias (TL 45) se observa un aumento promedio de 4,83% para ambas densidades, pero la diferencia más notoria se presentó en la liberación tardía en donde la D1 no logra controlar MHP en comparación a la D2.
La mayor densidad del parasitoide (D2) a los 7DDL redujo significativamente la MHP, con valores de 2,5%, 1%, 1,9% para las liberaciones TL30, TL-45 y TL60 (Figura 8) respectivamente, cuando son comparadas con las densidades más bajas (D1).
A los 14 DDL las reducciones significativas de la MHP fueron de 2,6%. 1% y 2,12% para las liberaciones TL30, TL45 y TL60 con la densidad más alta. En cambio, la densidad estándar (D1) termino con una reducción de 6,8%, 8,8% y 13,2% en las liberaciones TL30, TL45 y TL60. Demostrando que durante los tres tiempos de liberación la densidad más alta (D2) redujo el MHP cuando es comparada con la densidad más baja (D1) (Figura 8).
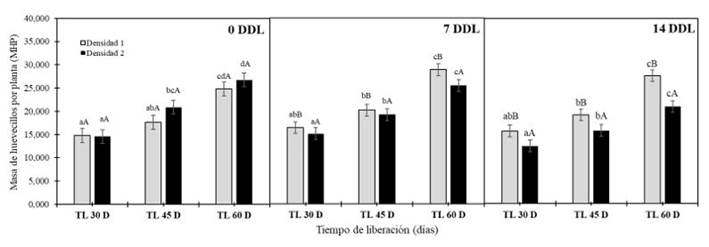
Nota: Medias seguidas de las letras mayúscula iguales entre densidades y minúsculas entre tiempos de liberación no difieren estadísticamente entre sí por el test de Tukey (p<0,05)
Figura 8.Escala Masa de huevecillos por planta S. frugiperda bajo el efecto de dos densidades del parasitoideTrichogramma sp.(100 000 y 200 000 individuos ha−1) en tres tiempos de liberación (30, 45 y 60 días) evaluados a los 0, 7 y 14.
La reducción significativa del PPA y del GAC de plantas de maíz afectada porS. frugiperdaen el presente estudio se relaciona con liberaciones tempranas, ya que permiten al parasitoide parasitar en distintas etapas del desarrollo del insecto plaga [26]. Resultados positivos también se logró con liberaciones tempranas [27,28].
Por otro lado, las densidades fueron significativas en la última evaluación, observándose porcentajes de parasitismo de 74,4% y 82,9% para las densidades D1 y D2, respectivamente, valores considerados altos. Algunos autores consideran que la dosis ideal es aquella cuya densidad logre un rango de 60 a 92% de parasitismo [29,30].
En cambio, la reducción significativa del MHP, tiene una relación significativa con las liberaciones tempranas y altas densidades deTrichogramma sp., observando resultados desde la primera semana después de la liberación [31]. Altas densidades de parasitoides reflejan una mayor eficacia [32,33,34], coincidiendo con la D2 (200 000 individuos ha−1) que denota un parasitismo de 82,9.
Aunque los tiempos de liberación del parasitoide más cortos redujeron la presencia delS. frugiperda, el efecto fue intensificado cuando se acompañó de mayores densidades del parasitoide, sobre todo cuando se evaluó a los 14 DDL donde se observaron diferencia significativa para el tratamiento D2TL30 cuando son comparadas con los otros tratamientos. Coincide con la mayoría de los autores anteriormente citados, ya que al detectar de manera temprana la presencia delS. frugiperdase logra controlar. Esto se llegó apreciar en el campo al observar el corion (masa de huevo) de una tonalidad obscura y el nivel de afectación que tiene el cogollero dentro del cultivo. Pero en cambio al ser detectado de manera tardía el parasitoide se dificultará el control delS. frugiperda.
Conclusiones
Liberaciones tempranas (TL 30) deTrichogramma sp., tienen influencia en el control efectivo deS. frugiperdaindependientemente de la densidad de parasitoides que se usen. En cambio, altas densidades deTrichogramma sp., tienen efecto positivo en el control deS. frugiperdacuando se realizan de manera tardía.












 uBio
uBio