1. Introducción
La obtención de colorantes a partir de vegetales es una de las actividades que se realizaban desde hace muchos siglos como se demuestra en los objetos encontrados en las culturas desde la Grecia. A decir de Yusuf, Shabbir, y Faqeer (2017)
la naturaleza siempre ha dominado a lo sintético o artificial, desde el principio de este mundo ya que la naturaleza era la única opción para el ser humano pueda adquirir elementos, los materiales de origen natural presentas características que son ventajosas sobre los sintéticos, dándoles prioridad (p. 124).
“Las nuevas tecnologías están permitiendo la obtención de pigmentos a partir de colorantes naturales, logrando que estas sean eficientes, ocasionando que los pigmentos sintéticos sean rechazados” (Cuesta, 2018, p. 1). El alto costo de los colorantes en la industria en donde, el valor de la orceína acética que es un pigmento para dar color a la cromatina llega a ser de $31.3 los 60 ml en la industria química. La experiencia científica permite al estudiante dar respuestas a interrogantes afianzando su aprendizaje significativo, duradero y práctico, enriqueciendo su conocimiento científico, en la certeza de poder vivir en este mundo sin destruirlo y manteniéndolo en buen estado para las generaciones venideras. “El constructivismo, involucra al estudiante para que sea el constructor y protagonista de su propio aprendizaje, quien trae sus saberes que les sirve de soporte para fortalecer el nuevo conocimiento” (Miranda-Núñez, 2022, p. 81).
A las actividades experimentales se las ha considerado como un instrumento metodológico y didáctico que apoya el proceso de formación académico-científico de los alumnos. Los docentes que imparten las asignaturas del área de las ciencias naturales, frecuentemente, incorporan las prácticas de laboratorio basados en un modelo pedagógico adecuándolas a las peculiaridades del entorno, a los insumos aprovechables, y a las necesidades de formación, pues, además de apoyar las clases teóricas, despiertan, y desarrollan la curiosidad de los estudiantes motivándolos a resolver problemas (Zorrilla et al., 2022).
El propósito de la investigación es la extracción del colorante de los cálices de la flor de jamaica utilizando como solvente el vinagre para sustituir a la orceína acética que es comúnmente utilizado en las prácticas de laboratorio para la observación de las fases de mitosis y meiosis (cromatina); al igual que el limón y el vinagre sustituirán al ácido clorhídrico en el ablandamiento de los tejidos vegetales de las muestras que se utilizan en dichas prácticas. Este colorante puede ser utilizado en los laboratorios de Biología como recurso didáctico para la realización de las prácticas experimentales, considerando que las experiencias que se obtiene en el laboratorio son fundamentales en el proceso de enseñanza-aprendizaje. Esto permitirá la participación y el desarrollo de los estudiantes como seres activos que construyen su propio conocimiento, obteniendo una vivencia científica, pues desarrollarán el pensamiento investigativo para la comprensión de los fenómenos naturales. Este conocimiento e información puede tener una nueva aplicación en el campo de la educación formal, y, podría contribuir a la creación de herramientas didácticas alternativas para mejorar el proceso educativo de las ciencias biológicas. De ahí que se ha vuelto obligatorio buscar alternativas de obtención de colorantes por métodos experimentales como el que se presenta en esta investigación, en donde a través de los cálices de las flores de jamaica se obtuvo el colorante a un costo de $0.76 los 60 ml del colorante.
En este sentido, es necesario estimular las condiciones biológicas que le permiten al ser humano la construcción del conocimiento. La enseñanza de las ciencias se realiza con base en las prácticas pedagógicas en una interacción que se centra en la enseñanza, y el aprendizaje de contenidos propios de la disciplina científica. Este espacio requiere de una práctica educativa constructivista y contextualizada. Los conocimientos basados en la producción de colorantes vegetales constituyen constructos en las ciencias biológicas, el docente debe profundizar en la indagación lo que le permitirá al estudiante reflexionar y conceptualizar utilizando saberes, y conocimientos que se derivan de la naturaleza.
En cuanto a la estructura del artículo, en el apartado 1, se encuentra la introducción en la que se le familiariza al lector con el contexto del trabajo. En la sección 2 se presenta la referencia teórica aquí se reúne la información documentada sobre el tema de la investigación. En la sección 3, se detalla los métodos e instrumentos utilizados para desarrollar esta investigación. En la sección 4, se puntualizan los resultados obtenidos productos del estudio llevado a cabo de manera teórica y práctica. En la sección 5, se muestra la discusión en la que se extrapolan, interpretan y resumen los resultados. En la sección 6, se establecen las conclusiones de acuerdo con los resultados obtenidos.
2. Referencia teórica
Es posible que el gusto por el color en los seres humanos sea resultado del cambio de las estaciones del año, y se haya plasmado con el uso de los pigmentos obtenidos de plantas y flores e incluso de sangre y cenizas. El desarrollo acelerado según Dupey, y el florecimiento del quehacer artesanal apoyado principalmente por el establecimiento de territorios mexicanos, provocaron y estimularon el salto de los colorantes básicos (elaborados con tierras) a una gama cada vez más amplia de tintes. Por esta razón existía una variedad de recursos con las que se obtenían coloraciones aplicables en alfarería, telas, ideogramas, rituales, alimentos, e incluso en los cuerpos de reyes, sacerdotes y guerreros (Dupey, 2016). Al respecto, Villaño et al. (2016) mencionan que “el origen de los colorantes y su clasificación se deben a sus propiedades biológicas y en base a las características biológicas que poseen los colorantes, se evidencian los rasgos de sus propiedades físicas hasta sus estructuras químicas” (p. 1).
Así, según Valenzuela y Pérez se puede obtener una variedad de colores empleando verduras, frutas y especias que tienen diversas aplicaciones, ya que pueden emplearse para teñir telas, pintar madera, colorear lienzos, colorear jabones caseros entre otras. Los pigmentos vegetales incluyen una amplia variedad de gamas de componentes y colores, entre los más importantes se pueden mencionar los flavonoides, antocianinas, carotenoides, betalaínas, clorofilas entre otras (Valenzuela y Pérez, 2016). “Desde la aparición de los colorantes sintéticos en la industria, los pigmentos naturales han sido relegados, puesto que los sintetizados presentan mayor estabilidad, amplia gama de colores y menor costo” (Rolón, 2018, p. 11).
Amchova et al. (2015) manifiestan que “en la industria se realizan una serie de pruebas para el uso de los distintos colorantes con la finalidad de detectar las distintas formas de toxicidad” (p. 2). “Los colorantes de tipo natural se obtienen de los alimentos como las frutas y vegetales de color intenso y mediante procesos de maceración o ebullición se puede extraer el colorante” (Ulloa, 2017, p. 3). En el cuadro 1 se puede apreciar las clases de colorantes con características y ejemplos.
De esta manera, “Existe escaso conocimiento de las propiedades de los colorantes naturales” (Ulloa, 2017, p. 2). A decir de Galarza (2013)
la producción de pigmentos sintéticos ya no resulta igual de conveniente para los productores ni para los compradores, pues los costos son altos, además el público los percibe como peligrosos para la salud y el medio ambiente, consumiendo los productos que los contienen cada vez en menor cantidad (p. 7).
En palabras de Jácome et al. (2023) actualmente, existe “un gran interés por los aditivos naturales, especialmente los colorantes, debido a que estos compuestos naturales no tienen efectos secundarios asociados y la mayoría de ellos son ingredientes funcionales, actuando como promotores de la salud” (pp.1477-1478). Debido a investigaciones que se han adelantado en referencia de la toxicidad de pigmentos sintéticos “el interés en los colorantes naturales crece a diario como resultado de las continuas eliminaciones de los colorantes artificiales” (Marcano, 2018, p. 8). En la actualidad, las personas prestan mayor atención a los ingredientes de sus alimentos y a los recursos que utilizan diariamente.
Las flores de jamaica también llamadas acedera de Guinea, Obelisco, Rosamorada o Karkadé pertenece a la familia Malvaceae y su nombre científico es Hibiscus sabdariffa (cuadro 2), es originaria de África donde se le considera una planta muy importante tanto en sus propiedades medicinales como alimenticias, puede llegar a medir hasta los 3 metros de altura y su reproducción se efectúa por medio de la autofecundación. La jamaica “es una fuente de compuestos bioactivos tales como polifenoles, flavonoides, ácido ascórbico, entre otros; esta composición le otorga una actividad antioxidante” (Sumaya et al., 2014, p. 2).
Cuadro 2: Caracterización taxonómica de la jamaica Fuente: (Moposa, 2019)
| Reino | Plantae |
|---|---|
| Sub-reino | Tracheobionta |
| División | Magnoliophyta |
| Clase | Magnoliopsida |
| Sub-clase | Dieeniidae |
| Orden | Malvales |
| Familia | Malvaceae |
| Subfamilia | Malvoideae |
| Género | Hibiscus |
| Especie | Hibiscus sabdariffa L. |
| Nombre vulgar | Jamaica |
A decir de Sumaya (2014) “la composición de la jamaica ejerce efectos farmacológicos que producen funciones terapéuticas en el cuerpo que resultan benéficas para la salud” (p. 3). Según Pantoja (2022) “la jamaica tiene diferentes usos, como planta medicinal para bajar el colesterol, los triglicéridos, disminuye el peso corporal, estimula el funcionamiento del hígado y los riñones y contribuye en la absorción de ciertos minerales.” (p. 27). Sumaya (2014) manifiesta que
el cultivo de la jamaica se ha extendido en México, América Central, y del Sur y sudeste asiático, su cultivo y producción resultan de alto costo ya que suele sufrir daños por las lluvias excesivas, sequías o plagas, para su cosecha requiere de una alta cantidad de mano de obra para evitar la contaminación y pérdida de inocuidad (p. 2).
Además, se conoce que posee compuestos fitoquímicos como compuestos flavonoides, fenólicos, b-caroteno, polisacáridos y ácido ascórbico. Cruz-Moreno et al. Señalan que el color rojo persistente en sus cálices es quien le da sabor y color a las infusiones y bebidas preparadas, esto se debe al contenido de antocianinas y el sabor ácido al contenido de ácidos orgánicos como el ácido málico, cítrico, hibisco y tartárico (Cruz-Moreno et al., 2020). Por otra parte, las flores contienen varios compuestos antioxidantes naturales que también actúan contra diversos virus y bacterias. Uno de ellos “es el ácido hisbiscus y sus derivados, en ellos se identificaron componentes químicos con propiedades antimicrobianas” (Portillo-Torres et al., 2019, p. 2). En los cálices se encuentran: antocianinas 1.5 por ciento, ácidos orgánicos 15-30 por ciento, polisacáridos mucilaginosos 50 por ciento, flavonoides, saponinas, fitoesteroles, pectina y fibra. Los ácidos orgánicos y antocianinas han mostrado tener actividad antimicrobiana y antioxidante. Todos estos componentes tienen buena biodisponibilidad y han mostrado potencial terapéutico. Otros componentes fitoquímicos que poseen los cálices “están compuestos por elementos ricos en antocianinas, ácidos fenólicos, flavonoides y ácidos orgánicos.” (Izquierdo-Vega, et al., 2020, p. 3).
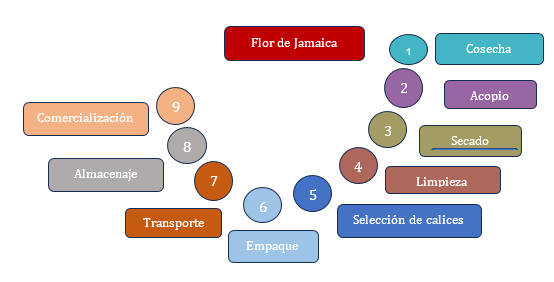
La Jamaica, según Urbina es una planta anual, herbácea, familia de las Malváceas que, frecuentemente, alcanza de 1 a 2 metros de altura, el tallo, el peciolo de las hojas y los cálices tienen un color rojo oscuro o claro con tendencia a morado o lila; las flores, generalmente, nacen solitarias en las axilas de las hojas con pétalos amarillentos, y cáliz rojo que suelen tardar de uno a dos días en caerse entonces aparecen los ápices y el fruto o cápsula de 5 compartimientos. La planta madura envuelta por el cáliz carnoso es de forma ovoide conteniendo numerosas semillas reniformes, pubescentes con hilo rojizo y tardan en desarrollar de 3 a 4 semanas (Urbina, 2009). El gráfico 1 resume el proceso de la flor de Jamaica.
El proceso para la comercialización de la flor de jamaica tiene nueve etapas (gráfico 1). “En el momento de la maduración de los primeros cálices y cápsulas se corta la planta de raíz, luego los cálices son separados y prontamente son llevados a deshidratación” (Rosado, 2020, p. 40). Según Galarza existen diversas técnicas para la separación de sustancias como la extracción que permite al producto orgánico separarlo de una mezcla de reacción o poder aislarlo de sus fuentes naturales observándose la formación de dos fases para que el proceso pueda realizarse: en el primer caso una fase sólida y una líquida, mientras que en el segundo caso se presentan dos fases líquidas inmiscibles (Galarza, 2013).
Existe diversidad de vegetales que “presentan características especiales en su estructura que generan pigmentos como el Geranio rojo (Pelargonium hortorum) que tiene el centro de color verde pálido contrastando con el margen y flores dispuestas en umbela de colores rojos, rosa violeta o blanco” (Estrada, 2021, p. 6). “En cuanto a la Dalia roja (Dahlia pinnata), la ampliación de un número de tipos, colores y tamaños ofrece una sólida posibilidad al incremento de su producción” (Jiménez, 2015, p.). “La Remolacha (beta vulgaris) se cultiva principalmente por su jugo y valor nutritivo y sus raíces son de color rojo sangre con piel delgada” (López et al., 2019, p. 368). “El Pimiento rojo (Capsicum annuum) su olor y color lo hacen atractivo al consumo, provienen de sus componentes bioquímicos: flavonoides, fenoles, epicatequina, rutina, β-caroteno, capsantina, luteina, resveratrol y ácidos: gálico, clorogénico y ascórbico” (Martínez et al., 2016, p. 38). Conocer las propiedades de las plantas ayudan al desarrollo de las prácticas experimentales. De ahí que según López y Tamayo son fundamentales en el proceso de enseñanza y aprendizaje de las ciencias, pues, al relacionar la teoría con la práctica se promueve el desarrollo de habilidades y destrezas, la promoción de capacidades de razonamiento, el pensamiento crítico y creativo brindando al estudiante la construcción del conocimiento y el fortalecimiento de la ciencia con la sociedad y la cultura (López y Tamayo, 2012). Dirigir el proceso de educativo de las Ciencias Naturales en función de satisfacer las demandas expresadas “implica pensar y razonar, pues observa y experimenta las diferentes situaciones, que le permiten actuar y establecer su propia compresión teórica de la realidad circundante y todo lo relacionado con ella” (Paladines-Condoy et al., 2018, p. 59).
La gestión del conocimiento es cada vez mayor por lo que es importante abordar temas relacionados con la innovación y actualización del sistema educativo. Precisamente, la educación debe “establecer estrategias metodológicas para el desarrollo de la clase, con el enorme propósito de obtener resultados positivos para el mejoramiento de la enseñanza en su desarrollo científico” (Calero, 2019, p. 10). Se debe “fomentar las prácticas de laboratorio de biología en los estudiantes aplicando pasos simples y recursos domésticos factibles y fáciles de conseguir para fortalecer la creatividad” (Susantini et al., 2017, p. 216). En el docente de Ciencias Naturales debe “imperar la necesidad de capacitarse para ser el guía del estudiante para que sea un ser más independiente en la búsqueda y asimilación de conocimientos científicos a través de la experimentación” (Ramírez, 2023, p. 6).
A decir de Castellanos (2017) “los docentes buscan diferentes habilidades orientadas a la enseñanza no solo de la teoría, sino también hacia la convergencia de la teoría y la práctica, para que exista un verdadero aprendizaje significativo” (p. 235). En este mismo sentido, Gil-Álvarez et al. (2017) señalan que “el paradigma crítico-social, considera la unidad dialéctica de lo teórico y lo práctico, como un todo inseparable” (p. 74). Se ha hecho visible que la estimulación y la imaginación juegan un rol importante en el aprendizaje y el entender de las ciencias (Gómez, Ortega y Lafaid, 2017; González y Palomeque, 2017).
Para Reyes (2020) el laboratorio es “una gran oportunidad donde el estudiante verifica conceptos teóricos que constituyen el primer contacto con la realidad que el futuro profesional afrontará” (p. 63). El uso de las prácticas experimentales desde el marco constructivista “fortalece el conocimiento y alcanzan el desarrollo de competencias científicas promoviendo la participación del alumnado, para que sean quienes propongan y ejecuten prácticas que aborden dimensiones conceptuales, procedimentales y actitudinales” (Espinoza-Ríos et al., 2015).
Por esta razón, es necesario estimular las condiciones biológicas que le permiten al ser humano la construcción del conocimiento. La enseñanza de las ciencias se realiza con base en las prácticas pedagógicas en una interacción que se centra en la enseñanza y el aprendizaje de contenidos propios de la disciplina científica. Esto requiere de una práctica educativa constructivista y contextualizada. Los conocimientos basados en la producción de colorantes vegetales constituyen constructos en las Ciencias Biológicas; el docente debe profundizar en la indagación lo que le permitirá al estudiante reflexionar y conceptualizar utilizando saberes y conocimientos que se derivan de la naturaleza. Coronado y Arteta indican que se espera que los estudiantes fortalezcan algunas habilidades, por ejemplo, buscar o formular razones a los fenómenos o problemas, crear argumentos lógicos y propositivos de lo percibido, explicar fenómenos iguales usando caracteres conceptuales oportunos a diferentes grados de complejidad, establecer relaciones de causa-efecto, combinar ideas en la construcción de textos, emplear ideas y técnicas matemáticas (Coronado y Arteta, 2015, p. 9). Para ello, se requieren recursos didácticos que son fundamentales en el desarrollo de las prácticas de laboratorio de Ciencias Biológicas como los colorantes ya que, han logrado hacer visible la materia orgánica y poder identificar la estructura celular que permite que la vida exista.
3. Métodos e instrumentos
En la investigación se aplicó el método descriptivo y de observación, ya que se realizaron prácticas experimentales, aplicando el reactivo y colorante obtenidos, mismos que permitieron la visualización de las diferentes fases que conforman la meiosis y mitosis. Dichas prácticas fueron realizadas adaptando los protocolos de Andrade et al. 2005 en los que se observa células sexuales y somáticas vegetales.
3.1. Material y Metodología
El material seleccionado para reemplazar a la orceína acética que en el mercado alcanza un precio de $31.3 los 60 ml, fue la flor de jamaica que produce un colorante muy fuerte utilizado en la fabricación de textiles (Arrascue, 2018), y su costo es de $0.84 los 30g y se usó como solvente el vinagre que tiene un costo de $0.86 los 500 ml. Por lo tanto, el costo total de colorante obtenido en la investigación (sabda acética) es de $0.76 los 60 ml. Por otro lado, el reactivo (ácido clorhídrico) con el que se realiza el ablandamiento de los tejidos vegetales tiene un costo en la industria química de $6 los 500 ml, siendo reemplazado por zumo de limón que posee un valor de $ 2.75 los 700 g y vinagre al 5%, es así como el valor definitivo del reactivo que reemplazó al ácido clorhídrico (Auran acética) es de $2.36 los 500 ml.
3.2. Obtención del colorante
3.2.1. Fase 1 de prueba:
Como se muestra en el cuadro 3, previo a la estandarización final del colorante, se probaron diferentes tejidos vegetales que poseen un color rojo, así se diluyó 20 ml de vinagre al 5% con 6 g de geranio rojo Elargonium hortorum, 20 ml de vinagre al 5% con 2.3 g de dalia roja Dahlia pinnata, 50 ml de vinagre al 5% de con 40 g de remolacha Beta vulgaris y 20 g de Pimiento rojo Capsicum annuum con 20 ml de vinagre al 5% y no se obtuvo un pigmento que permita colorear claramente los cromosomas en el núcleo.
3.2.2. Fase 2 de preparación del extracto vegetal
Se adquirieron los cálices de las flores de jamaica disponibles en los mercados de la ciudad, de ellos se escogieron los que se encontraban en buen estado. Luego, para extraer el colorante se sometieron 6 g de cálices a 2 pruebas, una con alcohol al 70% y con vinagre al 5% que fueron usados como disolventes, dejándoles reposar al ambiente por 48 horas en un frasco de color ámbar. A continuación, se procedió a filtrar el colorante observándose que el vinagre extrae el pigmento de los cálices con una mayor concentración.
3.2.3. Fase 3 de estandarización de la muestra
Se procedió a probar distintas cantidades de vinagre al 5% con diferentes gramos de cálices de flores de Jamaica (cuadro 4) apreciándose que, con 6 g de cálices y 20 ml de vinagre al 5% resultó un color violáceo óptimo para colorear los cromosomas en mitosis y meiosis. Esta substancia se dejó reposar al ambiente por 48 horas en un frasco de color ámbar, a continuación, se filtró el colorante para quitar los residuos orgánicos.
3.3. Obtención del reactivo
3.3.1. Fase 1 de modificación de cantidad y tiempo 1
Se extrajo 1 ml de zumo de limón y se lo mezcló con 1.5 ml de vinagre al 5%, este reactivo fue agregado sobre los ápices radiculares de Allium cepa y las anteras de Lilium candidum colocando estos elementos sobre diferentes vidrios reloj durante 10 minutos, en esta fase no se utilizó flameado y no existió ablandamiento de tejido vegetal (véase cuadro 5).
3.3.2. Fase 2 de modificación de cantidad y tiempo 2
Se extrajo 1.5 ml de zumo de limón y se mezcló con 1.5 ml de vinagre al 5%, este reactivo fue colocado sobre los ápices radiculares de Allium cepa ubicados sobre un vidrio reloj durante 18 minutos. El mismo proceso se realizó con las anteras de Lilium candidum. No se utilizó flameado y no existió ablandamiento de tejidos vegetales (véase cuadro 5).
3.3.3. Fase 3 de pre-estandarización
Se extrajo 1.5 ml de zumo de limón y se mezcló con 1 ml de vinagre al 5%, esta mezcla fue colocada sobre los ápices radiculares de Allium cepa ubicados sobre un vidrio reloj, se realizaron 2 intervalos de flameado por 1 minuto y 2 intervalos de reposo de 1 minuto, similar proceso se realizó con las anteras de Lilium candidum, únicamente se ablandó el tejido externo (véase cuadro 5).
3.3.4. Fase 4 estandarización del reactivo
En 1 ml de zumo de limón y se colocó un 1 ml de vinagre al 5%, este reactivo fue colocado sobre los ápices radiculares de Allium cepa ubicados sobre un vidrio reloj en donde se realizaron 4 intervalos de flameado por 1 minuto y 4 intervalos de reposo de 1 minuto, con las anteras de Lilium candidum se siguió los mismos pasos. Existió el ablandamiento total del tejido radicular y anteras (véase cuadro 5).
4. Resultados
En los gráficos 2, grafico 3, grafico 4 y grafico 5 se aprecia que el colorante obtenido (Sabda acética) colorea de una forma similar a la orceína acética, la obtención de este pigmento se realizó a través de la disolución de 6 g de cálices de la flor de jamaica en 20 ml de vinagre al 5% (véase cuadro 4) y para reemplazar al ácido clorhídrico que permite el ablandamiento de los tejidos vegetales se utilizaron 1 ml de jugo de limón con 1 ml de vinagre al 5% (Auran acética) por un total de 8 minutos. Al combinar el flameado (4 intervalos de 1 minuto) con el tiempo de reposo (4 intervalos de 1 minuto), el cual se debe intercalar 1 minuto de flameado y 1 un minuto de reposo hasta completar los 8 minutos establecidos para ablandamiento (véase cuadro 5). Este proceso permitió colorear y ablandar los tejidos vegetales de una forma similar al procedimiento que se desarrolla con orceína acética y ácido clorhídrico en la observación de las fases de mitosis y meiosis (gráficos 2, grafico 3, grafico 4 y grafico 5).
Cuadro 3: Obtención del material
| Especie | Gramos de la especie | Vinagre al 5% |
|---|---|---|
| Geranio rojo Elargonium hortorum | 6 gramos | 20 ml |
| Dalia roja Dahlia pinnata | 2.5 gramos | 20 ml |
| Remolacha Beta vulgaris | 40 gramos | 50 ml |
| Pimiento rojo Capsicum annuum | 20 gramos | 20 ml |
El cuadro 3 evidencia el procedimiento experimental en el cual se describe como se escogió el material biológico óptimo para la elaboración del colorante, el mismo que se obtuvo relacionando el peso de las diferentes flores de las diversas especies con distintos ml de vinagre al 5%.
Cuadro 4: Proceso de estandarización de la concentración del colorante
| Jamaica | Vinagre al 5% | Color |
|---|---|---|
| 3 gramos | 35 ml | Rojo pigmentado |
| 4 gramos | 35 ml | Rojo Munsell |
| 4 gramos | 30 ml | Rojo Pantone |
| 5 gramos | 25 ml | Rojo Carmesí |
| 6 gramos | 20 ml | Rojo violáceo |
En el cuadro 4 se puede apreciar el procedimiento experimental en el cual se describe la estandarización del colorante, mismo que se obtuvo relacionando el peso de jamaica con los ml de vinagre al 5%.
Cuadro 5: Proceso de ablandamiento del tejido vegetal para la observación de meiosis y mitosis
| Prueba de experimentación | Limón | Vinagre al 5% | Flameado | Tiempo de reposo | Resultado |
|---|---|---|---|---|---|
| 1 | 1 ml | 1.5 ml | 0 minutos | 10 minutos | No se utilizó flameado. No hay ablandamiento del tejido. |
| 2 | 1.5ml | 1.5 ml | 0 minutos | 18 minutos | No se utilizó flameado. No hay ablandamiento del tejido. |
| 3 | 1.5 ml | 1ml | 2 intervalos de 1 minuto | 2 intervalos de 1 minuto | Se unió los intervalos de flameado con los intervalos de reposo. Ablandamiento solo del tejido externo. |
| 4 | 1 ml | 1ml | 4 intervalos de 1 minuto | 4 intervalos de 1 minuto | Se unió los intervalos de flameado con los intervalos de reposo. Ablandamiento total del tejido vegetal. |
En el cuadro 5 se aprecia el procedimiento experimental. Allí se describe la estandarización de la substancia que permitió el ablandamiento de las raíces de cebolla Allium cepa y anteras de lirio Lilium candidum para observar las fases mitosis y meiosis respectivamente.
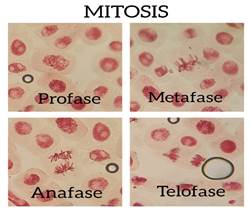
Gráfico 2: Aplicación del colorante Sabda acética para la observación de las fases de Mitosis en tejido radicular de Allium cepa
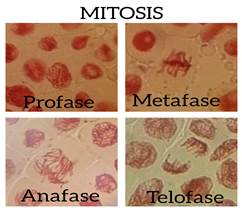
Gráfico 3: Aplicación del colorante Orceína acética para la observación de las fases Mitosis en tejido radicular de Allium cepa
En el gráfico 2 se puede apreciar claramente la mitosis realizada con raíces de cebolla (Allium cepa) empleando el colorante orgánico de jamaica (Sabda acética) y el ablandamiento del tejido vegetal que se realizó con la mezcla del zumo de limón y vinagre al 5% (Auran acética) lo que permitió la visualización de las fases. En el gráfico 3 se observa la mitosis usando la colorante orceína acética y el ácido clorhídrico para ablandar el tejido vegetal, evidenciando que el colorante producido con cálices de flores de jamaica pigmenta de la misma forma que con orceína acética y la mezcla del zumo de limón con vinagre ablanda los tejidos vegetales al igual que el ácido clorhídrico.
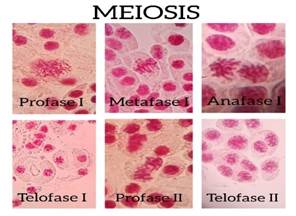
Gráfico 4: Aplicación del colorante Sabda acética para la observación de las fases de meiosis en anteras de Lilium candidum
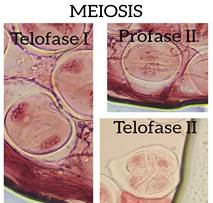
Gráfico 5: Aplicación del colorante Sabda acética para la observación de las fases de meiosis en anteras de Lilium candidum
En el gráfico 4 se puede apreciar claramente la meiosis realizada con anteras de lirio de cebolla (Lilium candidum) empleando el colorante orgánico de jamaica (Sabda acética) y el ablandamiento del tejido vegetal que se realizó con la mezcla del zumo de limón y vinagre al 5% (Auran acética) lo que permitió la visualización de las fases. En el gráfico 5 se observa la meiosis usando la colorante orceína acética y el ácido clorhídrico para ablandar el tejido vegetal, demostrando que el colorante producido con cálices de flores de jamaica pigmenta de la misma forma que con orceína acética y la mezcla del zumo de limón con vinagre ablanda los tejidos vegetales al igual que el ácido clorhídrico.
5. Discusión
Los colorantes que se encuentran en la industria química empleados para las prácticas de laboratorio son de alto costo, lo que impide la ejecución de las prácticas experimentales en las instituciones educativas tanto de nivel medio como superior. Por lo que, se hace necesario buscar nuevas alternativas de elaboración de colorantes de bajo costo que sean asequibles como el desarrollado en esta investigación (Sabda acética) para que se pueda llevar a cabo el componente práctico en asignaturas como la Biología en instituciones educativas que no cuenten con los recursos económicos necesarios.
De igual forma, para el procedimiento de ablandamiento de los tejidos vegetales comúnmente se utiliza el ácido clorhídrico para las prácticas de experimentación, sin embargo, se propuso obtener un sustituto que cumpla la misma función de este reactivo a partir de la mezcla del limón con el vinagre (Auran acética), demostrando que su aplicación tiene la misma función que el ácido clorhídrico. Se debe destacar que los métodos utilizados en la parte experimental establecieron las bases para la recolección de los datos y posteriormente analizar la información obtenida. Al momento de la experimentación se realizaron varias pruebas hasta llegar a una estandarización efectiva, una vez establecido el proceso de ablandamiento y tinción, se logró observar la división de células vegetales.
6. Conclusiones
Los colorantes vegetales son recursos indispensables que tienen diversas aplicaciones en la industria y como recursos didácticos en las prácticas experimentales en el proceso de enseñanza-aprendizaje de la Biología, por lo cual, es importante fortalecer las investigaciones sobre la obtención de este tipo de colorantes. El estudio empleó una técnica que reduce significativamente los recursos económicos que se invierten para obtener los insumos que se utilizan para realizar las prácticas de laboratorio en tejidos vegetales y animales en los cuales se pueden observar claramente la cromatina (cromosomas en mitosis, meiosis, cromosomas politénicos y cuerpos de Barr).
Generalmente para el proceso de ablandamiento de los tejidos vegetales se requiere del ácido clorhídrico reactivo que tiene un alto costo y presenta riesgo en su manipulación durante la experimentación. Mientras que, con la mezcla de 1ml del jugo de limón más 1 ml de vinagre al 5% durante 8 minutos y el flameado de este compuesto por 4 minutos minimiza el peligro y el costo de su uso. La orceína acética es un colorante de alto costo utilizado en las prácticas experimentales para teñir la cromatina, esto obliga a buscar alternativas de obtención de colorantes que se ajusten al presupuesto de las instituciones educativas. En la investigación realizada después de desarrollar varias pruebas se estandarizó el colorante diluyendo 6 g de cálices de flores de jamaica con vinagre al 5% que permitieron una similar o mejor visualización de la cromatina en los tejidos vegetales en comparación con la orceína acética.
Los recursos empleados para reemplazar a la orceína acética que en el mercado alcanza un precio de $31.3 los 60 ml, fueron los cálices de la flor de jamaica que producen un colorante muy fuerte y su costo es de $0.84 los 30g y se usó como solvente el vinagre que tiene un costo de $0.86 los 500 ml, el costo total de colorante obtenido en la investigación (sabda acética) es de $0.76 los 60 ml. Por otro lado, el reactivo (ácido clorhídrico) utilizado para realizar el ablandamiento de los tejidos vegetales tiene un valor referencial en la industria química de $6 los 500 ml, siendo sustituido por zumo de limón que posee un valor de $ 2.75 los 700 g y vinagre al 5%. El valor definitivo del reactivo que reemplazó al ácido clorhídrico (Auran acética) es de $2.36 los 500 ml.