Introducción
Actualmente las reservas ecológicas o naturales son la base primordial para la subsistencia de la biodiversidad. Constituyen un escenario propicio para el desarrollo de especies florísticas y faunísticas, contribuyendo al equilibrio de los recursos naturales como; el suelo, agua, aire y el bienestar de las comunidades aledañas (Neira et al., 2022).
Por otra parte, las reservas ecológicas o también conocidas como áreas protegidas desempeñan funciones cruciales para el mantenimiento de los ecosistemas, especialmente, en la preservación de los servicios ecosistémicos de regulación del clima y suministro de agua, permitiendo el aseguramiento de la captura de carbono a través de la conservación de bosques y la calidad y cantidad del recurso agua a través de la protección de las cuencas hidrográficas (López-Hernández et al., 2017).
En el Ecuador, actualmente existe poca información sobre el funcionamiento de las áreas protegidas en relación a los servicios ambientales, especialmente en el almacenamiento de carbono orgánico en el suelo (COS), proceso que depende del equilibrio entre la cantidad de carbono (C) que entra en el suelo y la que sale como gases de respiración, procedentes de la mineralización microbiana (Organización de las Naciones Unidas para la Agricultura y la Alimentación-FAO y Panel Técnico Intergubernamental para suelos-ITPS, 2015).
Los bosques tropicales secos como parte del Sistema Nacional de Áreas Protegidas (SNAP) son de gran importancia biológica para el país, caracterizada por conservar un gran número de especies endémicas (Longwei et al., 2022), En la región del Pacifico Ecuatorial existen 16 áreas protegidas que contienen ecosistemas secos (Espinosa et al., 2012), significando el 5% de los 55000 km2 de bosque que quedan en el país (Linares-Palomino et al., 2022).
La creación de reservas naturales en estos tipos de bosque ha sido trascendental para la preservación de la biodiversidad. Sin embargo, con frecuencia, estos paisajes se ven afectados por la intervención humana, con el fin de aprovecharlos, convirtiéndolos en fragmentos de vegetación remanente delimitados por distintos tipos de vegetación y usos de suelo.
Según Luzuriaga y Cisneros (2023), menos del 10% de los bosques secos ecuatorianos permanecen cubiertos de vegetación en la actualidad, tal como ha venido sucediendo en la Reserva Ecológica Arenillas (REAR) situada al suroeste del Ecuador, provocado por la invasión para asentamientos agrícolas y por la tala ilegal especialmente del Guayacán, árbol que ha sido deforestado durante años para fines comerciales maderables.
En las áreas protegidas del Ecuador existe un gran potencial para la captación de carbono en el suelo, solo en las áreas protegidas amazónicas se almacenan 708 millones de toneladas de C en una extensión de 19364.14 km2(Ministerio del Ambiente del Ecuador-MAE, 2016). Para comprobar los contenidos de COS y su variabilidad en el tiempo, es importante mantener la cubierta vegetal.
En las últimas décadas, se estima que el país ha experimentado una considerable pérdida de superficie de bosques naturales, especialmente en las zonas tropicales, con un promedio anual de deforestación de 94353 ha (MAE, 2019), ocasionando un aumento en la emisión de CO2 a la atmósfera y reducción de las reservas de COS (Convención de las Naciones Unidas de Lucha contra la Desertificación-UNCCD, 2017).
Ante esta situación y bajo el compromiso de conservar y establecer un modelo de gestión sostenible en los bosques nativos, en el país se han venido desarrollando iniciativas socioambientales como los programas de; reducción de las emisiones derivadas a la Deforestación y la Degradación Forestal (REED+) y Socio Bosque, a pesar de los significativos resultados generados en ciertas regiones, es necesario la complementación de información específica en torno a la variación de sus reservas de COS en los diferentes ecosistemas.
El suelo como recurso principal de los ecosistemas es considerado uno de los más importantes depósitos de C en la tierra (FAO, 2017). A nivel global, se estima que el contenido de COS alcanza entre 1500 y 2450 gigatoneladas a una profundidad de 2 m, superando a las concentraciones de la atmosfera y la vegetación con 650 y 750 Pg respectivamente (Lal et al., 2021), es decir, representaría alrededor del 70% de todo el carbono orgánico de la biósfera. En el caso de la REAR los valores de almacenamiento de COS varían entre 31 y 64 t C ha-1 a una profundidad de hasta 30 cm (Loayza et al., 2020). Sin embargo, se desconoce de las cantidades en las capas superficiales de (0-5 cm y 5-10 cm) y además del efecto que el contenido de COS puede tener sobre las propiedades físicas y químicas en el suelo.
Por lo anterior, el presente estudio tiene como objetivo determinar la capacidad de acumulación del COS en tres ecosistemas de la REAR y la influencia que tienen con los factores de profundidad y tipo de suelo. Partimos de la hipótesis de que las características de dichos factores ejercen un efecto sobre las propiedades físicas y químicas en el suelo, lo cual provoca variaciones en los niveles de C, un indicador fundamental de la fertilidad y calidad del suelo, así como un agente mitigante del cambio climático.
Metodología
El área de estudio se localiza en la REAR, situada en la cuenca del río Zarumilla, cantón Arenillas, provincia de El Oro, en el Litoral Sur del Ecuador (ver Figura 1). De acuerdo con la cartografía oficial del Ministerio del Ambiente Agua y Transición Ecológica del Ecuador (MAATE), la reserva posee una superficie de 13170.03 ha y se encuentra conformada por cinco ecosistemas; Manglar del Jama-Zapotillo, Bosque bajo y arbustal deciduo del Jama-Zapotillo, Bosque deciduo de tierras bajas del Jama-Zapotillo, Herbazal inundable ripario de tierras bajas y una zona definida como intervenida. Su nivel altitudinal comprende de 0 hasta 300 msnm, su clima corresponde a cálido-seco, con una temperatura media de 24°C y variadas precipitaciones; zona cálida-árida; menor a 350 mm/año, zona cálida-muy seca; 300-500 mm/año y zona cálida-seca; 500-1000 mm/año (MAE, 2015).
El trabajo de investigación se centra en tres ecosistemas con diferente tipo de vegetación; 1) Bosque bajo y arbustal deciduo del Jama-Zapotillo (Bosque arbustal deciduo), localizada en la zona centro norte y parte sur de la REAR, abarcando el 51.44 % de superficie, siendo la vegetación arbustiva de mayor frecuencia, asociado de árboles dispersos como: Eríotheca ruizii, Ceiba trichistandra, Tabebuia billbergii, T. chrysantha y Bursera graveolens, su formación vegetal muestra un buen estado de conservación, a pesar de la presión de tala ejercida por las comunidades aledañas, 2) Bosque deciduo de tierras bajas del Jama-Zapotillo (Bosque deciduo), este ecosistema se direcciona hacia el sector sur de la reserva, constituyendo el 27.32 % de superficie, su estructura vegetal se presenta en terrenos moderadamente colinados o en pendientes inclinadas y base de montaña, se ha visto afectada en ciertas áreas, producto de la extracción forestal del Guayacán, Cascol y Hualtaco y 3) Zona intervenida, localizada una parte al norte y sur de la reserva, ocupando el 9.25 % de superficie. Más del 5 % de su cobertura arbórea ha sido alterada por el aprovechamiento humano, a través de actividades antrópicas; acuícolas, agrícolas, ganaderas, forestal y caza (MAE 2015; Gobierno Autónomo Descentralizado de Arenillas, 2015).
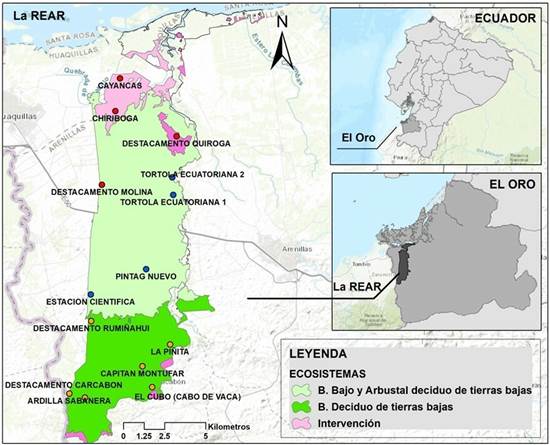
Figura 1: Área de estudio; Reserva Ecológica Arenillas (REAR); 1) Bosque arbustal deciduo; 2) Bosque deciduo; 3) Zona intervenida
Selección y muestreo
Para la determinación del COS y otros parámetros físico-químicos se seleccionaron 14 puntos de muestreos de suelo. La localización se realizó mediante georreferencia de forma aleatoria simple, determinándose 4 puntos para el Bosque arbustal deciduo y 6 para el Bosque deciduo. En cambio, para la zona Intervenida la georreferenciación se la realizo en 4 sectores con características de mayor cambio paisajístico, provocado por la invasión y el establecimiento de actividades agrícolas y acuícolas hace más de una década. Los nombres propuestos en cada punto de muestreo fueron en base a los objetos de conservación descritos en el Plan de Manejo de la REAR (MAE, 2015), en complementación a los lugares descritos, se detallan las coordenadas, los tipos de orden de suelos y el clima (ver Tabla 1), información obtenida de la cartografía geo-pedológica de SIGTIERRAS y Plan de ordenamiento territorial de Arenillas (Ministerio de Agricultura, Ganadería y Pesca-MAGAP 2015; Gobierno Autónomo Descentralizado de Arenillas,, 2015).
Tabla 1: Caracterización de las zonas de muestreo
| Ecosistemas | Zona de muestreo | Coordenadas | Orden de suelo (USDA) | Clima | |
|---|---|---|---|---|---|
| S | O | ||||
| Intervenido | Cayancas Chiriboga Destacamento Quiroga Destacamento Molina | 593609 593325 597038 592510 | 9617566 9611097 9594040 9615907 | Aridisol Aridisol Aridisol Inceptisol | Semiárido |
| Bosque arbustal deciduo | Tórtola Ecuatoriana 1 Tórtola Ecuatoriana 2 Pintag Nuevo Estación Científica | 596836 596782 595193 591834 | 9610475 9611544 9605963 9604425 | Alfisol Vertisol Alfisol Alfisol | Seco |
| Bosque deciduo | Destacamento Rumiñahui Ardilla Sabanera Destacamento Carcabon La Piñita El Cubo (cabo de vaca) Capitán Montufar | 591859 590531 591470 596654 595562 594972 | 9602818 9598403 9598156 9601390 9598794 9600068 | Vertisol Alfisol Alfisol Entisol Alfisol Alfisol | Seco |
USDA: Departamento de Agricultura de los Estados Unidos; S: Sur; O: Oeste
En el ecosistema Intervenido el suelo está mayormente representado por el orden Aridisol, en especial las zonas de Cayancas, Chiriboga y Destacamento Quiroga, para el sector de Destacamento Molina el orden es Inceptisol, suelo poco desarrollado y moderadamente profundo, el clima presente en este ecosistema es Semiárido. Para el Bosque arbustal deciduo el clima se presenta como seco, el orden de suelo dominante es el Alfisol con característica de suelo joven y estable, compuesto de arcilla y retenedor de minerales primarios, y que la conforman las zonas de; Tórtola Ecuatoriana 1, Pintag Nuevo y Estación Científica. En cambio, para el sector de Tórtola Ecuatoriana 2 el orden de suelo es Vertisol, rico en arcillas que con la humedad se hidratan y expanden y al secarse se agrietan. El ecosistema de Bosque deciduo presento diferentes tipos de suelo en las zonas de muestreo, el orden Alfisol se situó en los sectores de Ardilla Sabanera, Destacamento Carcabon, El Cubo (cabo de vaca) y Capitán Montufar, los sectores de Destacamento Rumiñahui y La Piñita su orden de suelo correspondió a Vertisol y Entisol respectivamente, este último no muestra desarrollo de perfiles, siendo catalogado suelos muy fértiles. El clima que presenta este bosque es seco.
Para la toma de muestras de suelo, se recolectaron 14 muestras compuestas a dos niveles de profundidad de 0-10 y 10-30 cm, dando un total de (n=28). De cada muestra compuesta se extrajo aproximadamente 1 Kg de suelo, para luego ser llevada a laboratorio de suelos de la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Machala (UTMACH), donde se secaron a temperatura ambiente por 7 días, se molió y tamizo con malla de orificio de 2 mm. El trabajo de campo inició en el mes febrero y finalizó en el mes de abril de 2018.
Análisis físico-químico del suelo
Se evaluó la densidad aparente (Da) a través del método de la parafina (Sandoval et al., 2012), que consistió en elegir cuatro agregados de tierra como repeticiones, con un tamaño entre 2 a 4 cm de diámetro. Un agregado fue llevado a la estufa a 105°C por 24 horas para medir la humedad, los demás agregados fueron cubiertos con parafina y pesados posteriormente. Para el análisis de las propiedades químicas se determinaron; el pH, mediante la medida de disoluciones de suelo-agua destilada (sin contenido de minerales) en proporción 1:2.5 (Sánchez-Cortes et al., 1998). El C, mediante oxidación con ácidos por el método de Walkley y Black (1934), sobre un balón aforado de 100 ml se añadió 1 g de suelo y se agregó 10 ml de una solución 1 N de dicromato de potasio (K2 Cr2 O7) en medio ácido (10 ml de H2SO4). Luego se agito por 15 minutos y se dejó en reposo por 24 horas, posterior se aforo el balón con agua destilada y se extrajo 20 ml de solución y se colocó en un Erlenmeyer de 250 ml, luego se agregó 3 ml de ácido fosfórico (H2PO4) al 85% y seis gotas de difenilamina ((C6H5)2NH). Se realizó la titulación con Sulfato ferroso amoniacal (Fe (NH4)2 (SO4)2.6H2O) al 0.2 N hasta el viraje a color del verde claro. Del resultado obtenido de C, se procedió a calcular la materia orgánica (MO) utilizando el factor de conversión (fc) de 1,724 (Van Bemmelen, 1890), como se explica en la ecuación (1).
MO = C x 1.724 (1)
Donde, MO: Materia orgánica (%); C: Carbono orgánico (%); 1.724: Factor que supone que la materia orgánica del suelo contiene un 58 % de C (1/0.58 =1.724)
Estimación de carbono orgánico en el suelo (COS)
Para el cálculo del contenido de COS, se aplicó previamente la ecuación (2), determinando el peso del volumen de suelo por cada horizonte de muestreo convertido en valores de (t ha-1) (Díaz et al., 2016). Para este cálculo, debido a las diferencias de espesor que tienen las dos profundidades de estudio, se consideró una misma profundidad de 10 cm.
PVs (t. ha-1) = Da x Ps x 10000 (2)
Donde, PVs: Peso del volumen del suelo (t. ha-1); Da: Densidad aparente (t/m3); Ps: Espesor o profundidad del horizonte del suelo; 10000: Valor de conversión.
Posteriormente se aplicó la ecuación (3), el resultado del PVs se multiplico con el valor del C.
COS (t. ha-1) = (PVs x C) / 100 (3)
Donde, COS: Contenido de carbono orgánico en el suelo (t. ha-1); PVs: Peso del volumen de suelo (t. ha-1); C= Carbono orgánico (%); 100= Factor de conversión.
Análisis estadístico
Se utilizó el software Statistical Package for the Social Sciences (SPSS versión 26, de marca registrada por IBM Corporation en Armonk estado de Nueva York, EEUU), se compararon los valores de los parámetros físicos y químicos a través del análisis descriptivo de medias y desviación estándar. Así mismo se probó a través del modelo lineal general univariado el comportamiento de relación entre la variable dependiente de COS con los factores fijos de ecosistemas, profundidad y tipo de suelo. Se aplicaron pruebas de igualdad de Levene para comprobar la igualdad de las varianzas entre niveles de factores. Para comparar las medias de los tratamientos se utilizó la prueba de Tukey (p≤0.05). Se aplicó la prueba de normalidad de Kolmogorov-Smirnov, dando como sugerencia la aplicación de la prueba estadística paramétrica de correlación de Pearson. Posteriormente, probada la presencia de correlación (p≤0.05) se estableció el grado de relación a través del coeficiente de correlación (r), valor que fluctúa de -1 a 1, donde los valores negativos señalan una relación lineal inversa, diferente a los positivos donde su comportamiento es lineal directa. Para una mejor interpretación de r se estimó un rango de correlación; de 0.00-0.10 nula, 0.11-0.30 débil, 0.31-0.50 moderada y de 0.51-1.00 fuerte (Hernández-Lalinde et al., 2018).
Resultados
Características físico-químicas del suelo
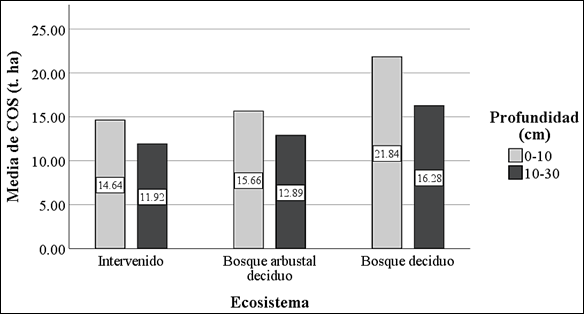
En los primeros 10 cm del suelo, la Da mostró valores altos en los tres ecosistemas, alcanzando registros de 1.60 t/m3 para el Bosque deciduo, 1.65 t/m3 la zona Intervenida y 1.90 t/m3 para el Bosque arbustal deciduo. Con respecto al contenido de COS revelo un aumento en el Bosque deciduo al igual que la MO y C, alcanzando valores de media de 21.84 t. ha-1, 2.36% y 1.37% respectivamente. En cambio, para el pH los valores de media oscilaron de 6.30 a 6.82, calificando como ligeramente ácido a neutro, siendo el Bosque arbustal deciduo el de mayor valor de pH (Tabla 2).
Tabla 2: Análisis estadístico descriptivo de las propiedades fisicoquímicas del suelo en tres ecosistemas de la REAR a una profundidad de 10 cm.
| Variable | Ecosistema | Media | Desviación Estándar | Min | Max |
|---|---|---|---|---|---|
| COS (t. ha-1) | Intervenido | 14.64 | 0.87 | 13.61 | 15.50 |
| Bosque arbustal deciduo | 15.66 | 4.51 | 11.21 | 21.95 | |
| Bosque deciduo | 21.84 | 6.13 | 15.81 | 31.77 | |
| MO (%) | Intervenido | 1.54 | 0.17 | 1.38 | 1.75 |
| Bosque arbustal deciduo | 1.42 | 0.38 | 1.01 | 1.93 | |
| Bosque deciduo | 2.36 | 0.61 | 1.6 | 3.24 | |
| C (%) | Intervenido | 0.89 | 0.10 | 0.80 | 1.02 |
| Bosque arbustal deciduo | 0.83 | 0.22 | 0.59 | 1.12 | |
| Bosque deciduo | 1.37 | 0.35 | 0.93 | 1.88 | |
| Da (t/m3) | Intervenido | 1.65 | 0.18 | 1.52 | 1.90 |
| Bosque arbustal deciduo | 1.90 | 0.10 | 1.75 | 1.97 | |
| Bosque deciduo | 1.60 | 0.10 | 1.43 | 1.70 | |
| pH | Intervenido | 6.78 | 0.37 | 6.28 | 7.10 |
| Bosque arbustal deciduo | 6.82 | 0.71 | 6.28 | 7.80 | |
| Bosque deciduo | 6.30 | 0.47 | 5.70 | 6.80 |
Da: Densidad aparente; MO: Materia orgánica; C: Carbono orgánico; COS: Contenido de Carbono orgánico en el suelo; pH: potencial de Hidrógeno; Min = Mínimo; Max = Máximo
Para las profundidades de 10 a 30 cm, la Da revelo valores de media superiores a los registrados en la capa superficial de los tres ecosistemas, los cuales oscilan, entre 1.67 t/m3 para el Bosque deciduo, 1.84 t/m3 la zona Intervenida y 1.94 t/m3 para el Bosque arbustal deciduo. En cambio, los valores de media de contenido de COS, MO y C mostraron registros inferiores a los primeros 10 cm de profundidad, siendo de los tres ecosistemas el Bosque deciduo quien registra mayores valores de COS 16.28 t. ha-1, 1.82% de MO y 1.05% de C. En el caso del pH se revela un ligero aumento en los tres ecosistemas, siendo el suelo Intervenido el de mayor valor, con un registro de media de 6.99 (Tabla 3).
Tabla 3: Análisis estadístico descriptivo de las propiedades fisicoquímicas del suelo en tres ecosistemas de la REAR a una profundidad de 10-30 cm.
| Variable | Ecosistema | Media | Desviación Estándar | Min | Max |
|---|---|---|---|---|---|
| COS (t. ha-1) | Intervenido | 11.92 | 0.60 | 11.31 | 12.53 |
| Bosque arbustal deciduo | 12.89 | 2.48 | 10.40 | 15.47 | |
| Bosque deciduo | 16.28 | 5.17 | 8.43 | 21.73 | |
| MO (%) | Intervenido | 1.12 | 0.05 | 1.05 | 1.38 |
| Bosque arbustal deciduo | 1.15 | 0.25 | 0.90 | 1.46 | |
| Bosque deciduo | 1.82 | 0.90 | 0.75 | 3.35 | |
| C (%) | Intervenido | 0.65 | 0.03 | 0.61 | 0.80 |
| Bosque arbustal deciduo | 0.67 | 0.15 | 0.52 | 0.85 | |
| Bosque deciduo | 1.05 | 0.52 | 0.43 | 1.94 | |
| Da (t/m3) | Intervenido | 1.84 | 0.07 | 1.74 | 1.90 |
| Bosque arbustal deciduo | 1.94 | 0.08 | 1.82 | 2.00 | |
| Bosque deciduo | 1.67 | 0.29 | 1.12 | 1.96 | |
| pH | Intervenido | 6.99 | 0.55 | 6.40 | 7.50 |
| Bosque arbustal deciduo | 6.94 | 0.77 | 6.23 | 8.00 | |
| Bosque deciduo | 6.40 | 0.26 | 6.12 | 6.70 |
Da: Densidad aparente; MO: Materia orgánica; C: Carbono orgánico; COS: Contenido de Carbono orgánico en el suelo; pH: Potencial de Hidrógeno; Min = Mínimo; Max = Máximo
Contenido de carbono orgánico del suelo por niveles de profundidad
La prueba de homogeneidad de Levene en la Tabla 4, determina que cuando los valores de (p-valor) son mayores a los niveles de significancia a 0.05, se asume una variabilidad homogénea en las variables de estudio, y cuando el p-valor es inferior a 0.05 se supone que las varianzas son distintas. El resultado obtenido para este análisis revelo un p-valor de 0.01, significando que no se cumple el supuesto de igualdad de varianza. A través del análisis de varianza, se pudo comprobar que existen diferencias significativas entre los valores de las medias de la variable dependiente de COS con las variables independientes de ecosistemas y profundidad, es decir, los valores de F utilizados para probar la igualdad entre varianzas obtenidas de dos muestras independientes (ecosistemas y profundidad) fueron altos 5.32 y 4.97 respectivamente, significando que los p-valores sean inferiores a 0.05. La interacción de las dos variables independientes reveló un valor bajo de F de 0.37, lo que represento que el p-valor (0.69) sea superior al nivel de significancia de 0.05, y que la probabilidad se declare como no significativa.
Tabla 4: Prueba de homogeneidad de Levene y análisis de varianza en el contenido de COS para las variables de ecosistema y profundidad
| Prueba de igualdad de Levene | Estadístico de Levene | gl1 | gl2 | (p-valor) | |||
|---|---|---|---|---|---|---|---|
| Contenido de COS (t. ha-1) | 3.96 | 5 | 22 | 0.01* | |||
| Análisis de varianza | Suma de cuadrados | gl | Media cuadrática | F-valor | Pr (>F) (p-valor) | ||
| Ecosistemas Profundidad Interacción 2 variables | 195.57 91.41 13.65 | 2 1 2 | 97.78 91.41 6.82 | 5.32 4.97 0.37 | 0.01* 0.04* 0.69 | ||
* Código de significancia en el nivel 0.05; gl (grados de libertad)
La Figura 2, permite evidenciar las diferencias significativas entre los tres tipos de ecosistemas, permitiendo afirmar que, en la REAR, el contenido de COS es mayor en el ecosistema de Bosque deciduo, que en los denominados Bosque arbustal deciduo y la zona Intervenida. La variación del COS depende en gran parte de las condiciones de la superficie. En efecto, para el suelo Intervenido desprovisto de vegetación se estimó una media total de COS de 26.56 t. ha-1 para las dos profundidades, mientras que la zona de Bosque arbustal deciduo con mayor colonización de vegetación, la media total de COS fue de 28.55 t. ha-1. En cambio, el bosque deciduo alcanzo la mayor concentración de COS con una media total de 38.12 t. ha-1, debido al saludable estado que presenta la vegetación, producto de las favorables condiciones del clima y de las mayores reservas de nutrientes en el suelo.
Contenido de carbono orgánico por diferente tipo de suelo
En la Tabla 5. La estadística de Levene, supone varianzas distintas entre los valores de las medias de COS para las variables de ecosistemas y tipo de suelo, el p-valor de 0.003 obtenido en este análisis determino que no se cumple la homogeneidad de varianzas. Por otro lado, los resultados de la tabla de análisis de varianza determinaron probabilidades significativas entre los valores de medias de COS con la variable de tipo de suelos. El valor de F fue el más alto con 4.69 significando un p-valor para F de 0.05. En cambio, para los factores de ecosistemas/profundidad e interacción de 2 variables, los resultados revelan probabilidades de diferencias no significativas entre los valores de medias de COS. Los valores de F para las variables de (ecosistemas/profundidad e interacción de 2 variables) fueron bajos con 2.71 y 0.54 respectivamente, lo que significaría que los p-valores sean superiores a 0.05. Con respecto a la variable de ecosistema/profundidad el p-valor para la prueba de F fue 0.14. En cambio, para las interacciones de 2 variables el p-valor fue de 0.74.
Tabla 5: Prueba de homogeneidad de Levene y análisis de varianza del contenido COS en los ecosistemas y tipo de suelo
| Prueba de igualdad de Levene | Estadístico de Levene | gl1 | gl2 | (p-valor) | |||
|---|---|---|---|---|---|---|---|
| Contenido de COS (t. ha-1) | 6.08 | 5 | 14 | 0.003* | |||
| Análisis de varianza | Suma de cuadrados | gl | Media cuadrática | F-valor | Pr (>F) (p-valor) | ||
| Tipo de suelo Ecosistemas/Profundidad Interacción 2 variables | 109.96 105.48 47.64 | 3 4 5 | 36.65 26.37 9.53 | 4.69 2.71 0.54 | 0.05* 0.14* 0.74 | ||
* Código de significancia en el nivel 0.05; gl (grados de libertad)
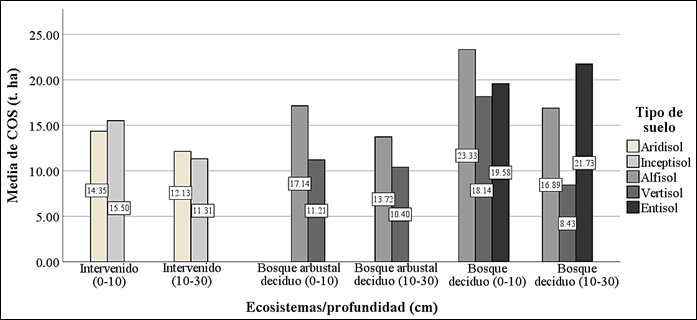
El COS agrupado por orden del suelo varió según el ecosistema y nivel de profundidad (Figura 3). En promedio, los Alfisoles y Entisoles tendieron a tener mayor contenido de COS en el Bosque deciduo para los dos niveles de profundidad de 0-10 y 10-30 cm, alcanzando valores desde los 16.89 hasta 23.33 t. ha-1, situación contraria a los Vertisoles, donde se revela una disminución del COS de 8.43 t. ha-1 a medida que se profundiza en el suelo, debido a que son suelos que se agrietan periódicamente por la contracción y expansión de las arcillas, afectando la propiedad física del suelo. En el caso de los Aridisoles e Inceptisoles los contenidos de COS fueron muy bajos en la zona Intervenida, con valores por debajo de 15.50 t. ha-1. En efecto, la escasa humedad en los Aridisoles y el incipiente desarrollo de horizontes patogenéticos en los Inceptisoles, podrían estar infiriendo de manera directa sobre el contenido de COS.
Efecto del contenido de COS con las propiedades físico-químicas
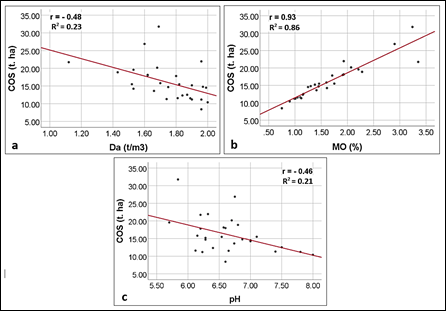
En la tabla 6, La matriz de correlación de Pearson en un nivel de significancia de 0.05, se evidencia una correlación positiva directa fuerte entre el COS y MO, diferente a los resultados entre las variables de COS-Profundidad, COS-Da, y COS-pH, con una correlación negativa inversa moderada.
Tabla 6: Correlación de Pearson entre el contenido de COS con el pH, Da y MO
| Correlación entre: | p-valor | Coeficiente de correlación r | Grado de relación |
| COS y Profundidad | 0.04 | -0.40 | Relación inversa moderada |
| COS y MO | 0.00 | 0.93 | Relación directa fuerte |
| COS y Da | 0.009 | -0.48 | Relación inversa moderada |
| COS y pH | 0.02 | -0.46 | Relación inversa moderada |
La figura 4, presentan graficas de dispersión para el COS versus la Da, MO y pH. En las figuras 4a y 4c correspondiente a la Da y pH, se puede apreciar que las nubes de puntos son muy dispersas en ciertos rangos de valores, aduciendo que para los suelos analizados existe una moderada correlación entre el COS y la Da o el pH. En la figura 4b, que relaciona el COS con la MO, se observa una mejor agrupación de los puntos de aproximación lineal, significando una fuerte correlación entre los dos parámetros.
Discusión
En la Tabla 2 y 3, los contenidos más alto de COS se ubicaron en el ecosistema de Bosque deciduo con valores medios de 21.84 y 16.28 t. ha-1. Este incremento se atribuye al efecto de la disminución de la temperatura y al incremento de la precipitación (Pastor-Mogollón et al., 2015), principal impulsor de los procesos de meteorización de los suelos (fisicoquímicos y microbianos), que al interactuar con las especies abundantes del bosque generan residuos de hojarasca de acelerada descomposición (Wu et al., 2022). Sin embargo, otros autores como Mesías-Gallo et al (2018), consideran los valores de 20 a 30 t. ha-1 como reservas de bajo contenido de COS. Los valores de la desviación estándar en este ecosistema fueron muy altos 6.13 y 5.17 en las dos profundidades, significando una mayor dispersión de los datos con respecto a la media, siendo el valor mínimo 8.43 t. ha-1 y el valor máximo de 21.73 t. ha-1.
En los ecosistemas de Intervenido y Bosque arbustal deciduo los valores de COS se concentraron en un rango de 11.92 a 15.66 t. ha-1, disminución que puede atribuirse a la característica de tierra semiárida, zona limitada por la humedad, con efecto adverso sobre las concentraciones de MO. Sin embargo, dado que la precipitación es estacional en estas zonas, puede ser menos significativo para el contenido de reservas de COS a escala local (González-Domínguez et al., 2019). Con respecto a la desviación estándar, los valores más bajos se ubicaron en el ecosistema Intervenido con un promedio de 0.74, significando una menor dispersión de los valores hacia la media. Para el Bosque arbustal deciduo la desviación estándar presento una moderada a alta dispersión de los datos con la media, teniendo como resultado valores de 4.51 y 2.48 a un nivel de profundidad de 0-10 y 10-30 cm respectivamente.
A pesar de la diferencia de los valores de MO y C en cada uno de los ecosistemas de estudio, los resultados revelaron valores bajos en los dos niveles de profundidad. En el Bosque deciduo los valores alcanzaron una media de 2.36 y 1.82 % de MO, ubicándose la mayor concentración en el nivel de 0-10 cm. De la misma forma, para el C los valores fueron 1.37 y 1.05 %. Por el contrario, el Bosque arbustal deciduo y el Intervenido revelaron valores más bajos de MO y C, correspondiendo a MO (1.42 y 1.15 %), (1.54 y 1.12 %) y C (0.83 y 0.67 %), (0.89 y 0.65 %) respectivamente.
Los valores demostraron que a mayor profundidad menor concentraciones de MO y C. Estos valores se asemejan con los resultados obtenidos por Bruck y Buitrón (2021) en la Reserva Ecológica “Los Ilinizas”, en donde, el bosque conservado consiguió una mayor concentración de MO y C, seguido del ecosistema intervenido y el Bosque arbustivo. Con respecto a estos dos últimos escenarios de características parecidas a la REAR, la reducción de los dos elementos se le puede atribuir a la escasa vegetación presente en las zonas, producto del manejo y abandono de las tierras, lo que ha provocado la accesibilidad de factores externos como la temperatura y precipitación causen alteración en el interior del suelo (Cantón et al. 2014), a esto se podría complementar la escasa cobertura vegetal con residuos de hojarasca de lenta descomposición (Akinde et al. 2020; Monge et al. 2019). Para Muñoz-Rojas et al (2021), la MO y el C son elementos que están íntimamente relacionados en los procesos de suelo, siendo claves y fundamentales en la regulación y sostenimiento de los ecosistemas. Según la distribución de sus valores en los dos niveles de profundidad, se evidencio en el Bosque deciduo una mayor dispersión de los datos hacia la media, alcanzando una desviación estándar en la MO de 0.61 y 0.90 con un mínimo de 0.75 % y un máximo 3.35 %, para el C (0.35 y 0.52) con valor mínimo de 0.43 % y máximo de 1.94 %. En cambio, para los ecosistemas de Bosque arbustal deciduo y el Intervenido, la dispersión de los valores de MO y C se mantuvieron cercanos hacia el valor de media, con resultados de desviación estándar menor a 0.38 para la MO y menor a 0.22 para el C respectivamente.
Se evidencio un mayor valor de la Da en el ecosistema de Bosque arbustal deciduo, con registros de 1.90 a 1.94 t/m3 para las dos profundidades de estudio. En cambio, los valores más bajos de Da se ubicaron en el Bosque deciduo en un rango de 1.60 a 1.67 t/m3, seguido del ecosistema Intervenido con valores de 1.65 a 1.85 t/m3. Según, Maza-Maza et al (2021) en su estudio realizado en las zonas de restauración activa de la REAR, manifiestan que los valores promedios de 1.65 t/m3 están asociado a la falta de condiciones estructurales del suelo con bajo contenido de MO y valores superiores a 1.90 t/m3 un alto grado de compactación, promovidos por el transporte de material parental arcilloso, clima, topografía, y uso del suelo. Por otro lado, Arnáez et al (2023), señalan que valores altos de Da suelen ser indicativos de suelos con bajo contenidos de MO y COS, característica que podría limitar la infiltración del agua sobre el suelo. De hecho, en los resultados obtenidos se comprueba que, ciertamente, a medida que aumenta la Da, disminuye las concentraciones de MO y COS. Para Medina et al (2018), este efecto inverso está relacionado con la baja porosidad del suelo, debido a la disminución de macroporos y aumento de los microporos, causado por el déficit de humedad y manejo en el suelo. Con respecto a la distribución de los valores de Da, se determinó que la mayor parte de los datos tienden estar agrupados cerca del valor de la media en cada uno de los ecosistemas de estudio, lo que significó que la desviación estándar alcanzara valores por debajo del 0.29.
La variable del pH en los ecosistemas de estudio para los dos niveles de profundidad, revelo tendencias de suelos ligeramente ácido en el Bosque deciduo con valores de 6.30 y 6.40, y de pH neutro en el Bosque Intervenido y Bosque arbustal deciduo con valores de 6.78-6.99 y 6.82-6.94 respectivamente. Para Tao et al (2019), el pH del suelo es un parámetro de mucha significancia en la composición y actividad microbiana, sostienen que en un bosque la descomposición de la hojarasca tiende a ser mayor cuando existe un dominio de la comunidad bacteriana con pH alto del suelo. Al comparar con los valores de pH y las reservas de COS de los ecosistemas de estudio, se podría deducir que la descomposición de la hojarasca en los procesos del suelo está controlada a parte de las bacterias por la comunidad de hongos, es decir, bajo el control de una descomposición ligera con tendencia de pH neutro en el suelo. Según Tao et al (2019), en suelos con un pH más cercano a la neutralidad, la disponibilidad de nutrientes puede ser óptima, fomentando una eficaz descomposición de la materia orgánica y absorción de nutrientes por las plantas. Así mismo, las tasas de descomposición suelen ser más altas, lo que podría provocar una menor acumulación de MO en el suelo. Estas características se ajustan mayormente a los ecosistemas de Bosque arbustal deciduo he Intervenido con medias de pH que van de 6.78 a 6.99 para los dos niveles profundidad de 0-10 y 10-30 cm.
En la figura 2, se evidencia que el contenido de COS es inversamente proporcional con la profundidad en el suelo, es decir, la concentración de COS a medida que se almacena a una mayor profundidad su contenido disminuye. Estos resultados concuerdan con Burbano-Orejuela (2018) alegando, que los fuertes cambios de reserva de carbono en los primeros 20 a 30 cm, proceden de la modificación en la cobertura terrestre, que se verán reducidas a mayor profundidad a medida que los residuos orgánicos desaparecen, al igual que la actividad microbiana. Sin embargo, Zhao et al., (2021), sostienen que las diferencias de respuestas de COS entre la capa superficial y el subsuelo, se debe a que los procesos bióticos sobre el ciclo del COS se vuelven más lento y débiles a medida que los procesos minerales prevalecen con la profundidad.
Estas reservas se mantienen en el mismo rango establecido por Loayza et al (2020), quienes sostienen valores bajos de COS (<40 t. ha-1) en la región semiárida de la costa ecuatoriana. Las existencias de COS en la capa superficial de 0-10 cm presentaron un promedio de 56% para todos los tipos de ecosistemas. Estos resultados coinciden con lo establecido por la FAO (2017), donde se menciona que el mayor contenido de COS se encuentra en la capa superior, lugar de alta concentración y descomposición de la MO, y que podrían llegar a reducirse por la mineralización y los procesos de erosión con pérdidas en casos intensos de hasta 50 t/ha/año (Pérez et al., 2021).
Algunos estudios realizados en zonas semiáridas, manifiestan el impacto de la alta cobertura vegetal y dominancia de algunas especies sobre las reservas del COS (Zdruli et al., 2017), así mismo, las reservas varían entre ecosistemas debido a los contrastes que ocurren en el clima, el tipo de suelo, la fisiografía, la vegetación y el uso de la tierra (Bell et al., 2021). Al separar al suelo de los inesperados factores climáticos, y junto a la densidad de las raíces boscosas se estaría asegurando un mayor almacenamiento de C en el suelo (Ma et al., 2019; Hernández-Núñez et al., 2021). Es importante indicar que las amplias desigualdades de presencia de COS en los diferentes ecosistemas se presentan en correlación a la temperatura y la lluvia, es decir, niveles de precipitación <450 mm podría limitar la productividad de la vegetación, promoviendo menor aportes y concentración de MO y C (Gabarrón- Galeote et al., 2015). Según Shukla et al (2020), las reservas de carbono a un metro de profundidad varían de 4 kg/m2 en las zonas áridas, de 8 a 10 kg/m2 en las zonas tropicales y de 21 a 24 kg/m2 en regiones boreales.
En la figura 3, se observa al COS en 0-10 y 10-30 cm ligeramente mayor en los suelos de tipo Alfisol con variación entre 23.33 y 16.89 t. ha-1 respectivamente, seguido del suelo Entisol con variación entre 19.58 y 21.73 t. ha-1 bajo el ecosistema de Bosque deciduo. Los resultados obtenidos en los suelos Alfisol se aproximan a los determinados por Soong et al (2018), quienes reportan una acumulación de 19 a 20 t. ha-1 a un nivel de profundidad de 0-15 cm. Según, Yost y Hartemink (2019), este ligero aumento se debe a la posición altitudinal que presentan los suelos, en el caso del Bosque deciduo la altitud alcanzo los 140 msnm, con temperaturas medias entre 19 y 23°C, y también al manejo y conservación de la cobertura vegetal, primordial para el funcionamiento de los microorganismos en la transformación de la materia orgánica en COS (Loayza et al., 2020). Por otra parte, a pesar de las características de formación lenta y baja fertilidad que tienen los suelos Entisol, estos podrían verse alterados positivamente en el Bosque deciduo debido a los diferentes aluviones recibidos, garantizando la fertilidad del suelo, primordial para el crecimiento de la vegetación y mayor existencia de COS (SIGTIERRAS, 2017).
En cambio, las menores existencia de contenido de COS en 0-10 y 10-30 cm se ubicó en el ecosistema de Bosque arbustal deciduo, con variaciones entre 11.21 y 10.40 t. ha-1 en los suelos Vertisol, seguidos de las variaciones entre 14.35 y 12.13 t. ha-1 de suelos Aridisol; 15.50 y 11.31 t. ha-1 de suelos Inceptisol bajo el Bosque intervenido. Este último rango de valor se asemeja a lo establecido por Fan et al (2014), quienes, a través del estudio de secuestro de carbono para suelos intervenidos en la provincia de Henan, China, determinaron contenidos de COS de hasta 16 t. ha-1 en suelos Inceptisoles con aplicación de fertilizantes en los 20 cm superiores y que fue disminuyendo por falta de nutrientes a una tasa de 0.2 t. ha-1 por año. Algunos estudios han demostrado que la conversión de bosque a la agricultura tienden a disminuir los niveles de COS, alcanzando hasta un 40% de perdida (Deng et al., 2016), siendo probablemente una de las razones de los bajos valores de COS en las zonas semiáridas de los suelos tipo Inceptisol y Aridisol en los ecosistemas del Ecuador (Loayza et al., 2020), este último se distingue por el régimen de humedad arídico con altas temperaturas, presencia de sales solubles y poca fertilidad en la superficie que limitan el crecimiento de la vegetación. En el caso de los Vertisoles, la baja acumulación de COS se debe al alto contenido de arcilla presente en el suelo (>30 %), dificultando la circulación del agua y volviéndolo compacto en época seca, escenario complicado para la adaptación de la vegetación de los organismos edáficos (SIGTIERRAS, 2017).
El resultado de correlación del COS y MO señalan una relación directa fuerte (R2 = 0.86). Similares hallazgos fueron obtenidos por Rocci et al (2021), aduciendo que para alcanzar un máximo contenido de COS demandarán de mayor contenido de MO, y que su equilibrio estará sujeto a la reducción de cobertura vegetal y los diferentes cambios ambientales (Paz et al., 2016; Bell et al., 2021).
Con respecto a la correlación de COS con la Da se evidencia una relación inversa moderada (R2 = -0.23), el resultado se interpreta como poco significativo, es decir, a mayor acumulación de COS en el suelo muy poco disminuye el valor de la Da, lo cual tiene un efecto de aumentar conforme se penetra en el suelo. Este análisis coincide con los resultados de Gogoi et al (2022), quienes aducen que en los bosques primarios la Da es más baja que los bosques secundarios, la continua interferencia del hombre sería el promotor del aumento de la densidad aparente del suelo y disminución de las reservas de COS, lo que revela una menor cantidad de poros en el suelo desfavorable para la filtración de agua, circulación de oxígeno y espacio de microorganismos encargados de la mineralización de la MO (Robinson et al., 2022). Así mismo, Andrade-Castañeda et al (2017), señalan que el aumento de la Da es causado por el peso y la presión de las capas superiores del suelo volviéndolo más compacto en el subsuelo.
El mismo grado de relación a lo anterior se evidencio entre el COS y el pH, lo que indica que a mayor contenido de COS (r = -0.46 y R2 = 0.21) se obtiene menor grado de pH, con respecto al diagrama de dispersión los valores se sitúan entre 6 y 7 (ligeramente acido a neutro). Similar resultado se determinó en el estudio de Ferdush et al (2023), señalando que, en suelos próximos a la neutralidad el pH se reduce debido al aumento de la MO y la presión parcial de CO2 en el suelo, es decir, la presencia de MO actúa como un regulador cuando el suelo es ácido o alcalino (Bennardi et al., 2018). Por otro lado, Wei et al (2022) sostienen que en suelos con bajo contenido de COS podrían provocar grandes cambios en la capacidad tampón del pH del suelo, lo contrario a suelos con alto contenido de COS donde los cambios son menores en la capacidad tampón.
Conclusiones
Los resultados de contenido de COS mostraron diferencias significativas entre los sitios evaluados de los tres diferentes ecosistemas seco y semiáridos de la REAR, lo mismo para el nivel de profundidad. Los sitios del bosque deciduo de tierras bajas presentaron mayor capacidad de almacenamiento de COS, pudiendo deberse a las características y al rol importante que presentan la vegetación boscosa, asociado al aumento de las precipitaciones y las bajas temperaturas. Por el contrario, se evidencio una menor capacidad de contenido de COS en los ecosistemas intervenido y bosque arbustal deciduo de tierras bajas, atribuyéndose dicha reducción a los factores condicionantes del clima como las bajas precipitaciones, el aumento de la temperatura y la esporádica vegetación producida por actividades antrópicas, los cuales, afectan el almacenamiento de COS, limitando la prestación de servicios ecosistémicos relacionados con la captura de carbono edáfico.
En cuanto, a los valores de COS encontrados en los dos niveles de profundidad de 0-10 y 10-30 cm, se demuestra que a mayor profundidad en los horizontes el contenido de COS disminuye. Sin embargo, a pesar de que los valores de contenido de COS fueron altos en la capa superficial, al relacionar con los resultados del mapa de carbono orgánico de suelos del Ecuador, los tres ecosistemas de estudio presentaron valores bajos de contenido de COS hasta 30 cm de profundidad con respecto a otras zonas del país, correspondiendo un promedio de 39 t C. ha-1 en el ecosistema intervenido, 42 t C. ha-1 bosque arbustal deciduo y 57 t C. ha-1 para el bosque deciduo.
La formación de los suelos Alfisol y Entisol influyeron positivamente en la acumulación de COS para el Bosque deciduo en los dos niveles de profundidad, esto debido al buen grado de desarrollo edafogenético presente en las capas superficiales y a los diferentes aluviones recibidos, convirtiéndolos en suelos altamente fértiles para el desarrollo vegetativo. Por el contrario, los bajos contenidos de COS se presentaron en los suelos Inceptisol y Aridisol en la zona intervenida y el Vertisol en el Bosque arbustal deciduo, siendo probablemente la variabilidad de las propiedades físicas y químicas, el reducido movimiento del agua, su régimen de humedad y la escasa materia orgánica los principales propulsores de la reducción de COS en estos suelos.
El contenido de COS aumentó con el aumento de la MO en los tres ecosistemas de estudio, siendo mayor este incremento en el Bosque deciduo. En cambio, para la Da y pH la relación fue inversa, es decir, a medida que el COS aumenta la Da y el pH disminuye. Este resultado demuestra una mayor influencia del equilibrio de las propiedades físicas y químicas del suelo con la disponibilidad del COS en cada uno de los ecosistemas de la reserva. De esta manera, se considera el papel importante que pueden tener las reservas ecológicas en el secuestro y retención de carbono, más aún en zonas áridas.
Es importante destacar ciertos aspectos a tomar en cuenta dentro de la REAR como; la falta de estudios específicos de contenido de carbono en todas las zonas consideradas de conservación, información actual del estado de los suelos y la vegetación e información de los factores condicionantes de la dinámica de COS en el tiempo.
Contribuciones de los autores
En concordancia con la taxonomía establecida internacionalmente para la asignación de créditos a autores de artículos científicos (https://casrai.org/credit/). Los autores declaran sus contribuciones en la siguiente matriz:
Conflicto de Interés
Los autores declaran que no existe conflicto de interés de naturaleza alguna en la presente investigación.
Fuente de financiamiento
Los autores agradecen al Vicerrectorado de Investigación de la Universidad Técnica de Machala por el financiamiento de recursos en el proyecto de investigación denominado “Estimación de las propiedades físicas y químicas de suelos con enfoque ecosistémico de la zona de restauración en la Reserva Ecológica Arenillas”