El plomo, Pb²⁺ es un elemento químico que ha tenido diferentes aplicaciones en la vida cotidiana de los seres humanos. En la antigua Roma se usó para articular la compleja red de tuberías, como edulcorante, como componente de ungüentos o cremas para la elaboración de utensilios domésticos, entre otros usos.1,2 A inicios de 1920 se utilizó el tetraetilo de plomo como aditivo en el combustible de motores de combustión. 3 Pese a las diversas aplicaciones dadas por el ser humano el plomo forma parte del conjunto de metales altamente tóxicos que coloquialmente se conocen como “metales pesados”. 4 Debido a los diferentes efectos adversos que ocasionan los metales tóxicos en la salud de seres humanos y el ambiente, las entidades gubernamentales de regulación han establecido una serie de normas donde se indican concentraciones máximas permisibles de metales tóxicos en alimentos. A finales del 2023, Ecuador se enfrentó a un problema sanitario debido a la contaminación de productos comestibles con plomo, 5 para cuantificar este metal en matrices alimentarias, se cuenta con varias técnicas, por ejemplo: Espectroscopía Ultravioleta-visible, 6 Cromatografía Líquida, 7 Espectroscopía de Absorción Atómica con horno de Grafito, 8 Espectroscopia de Plasma Acoplado Inducido, 9 Electroquímicas. 10 Estas últimas técnicas no son nuevas, sin embargo, a inicios de los 2000 el electroanálisis de metales experimentó un gran avance debido al uso de electrodos de bismuto, 11,12 que reemplazó al mercurio, otro metal altamente tóxico, con repercusiones ambientales y sanitarias. 13 Con estos antecedentes, se desarrolló un método electroquímico para medir plomo y cadmio usando electrodos de película de bismuto formadas in-situ. Se reporta una metodología sencilla para el tratamiento de muestras alimenticias y la determinación de metales tóxicos en muestras comerciales de: canela en polvo, harina de trigo, leche en polvo, avena en hojuelas, salsa de tomate y café.
II. MATERIALES Y MÉTODOS
Equipos
Potenciostato-galvanostato Autolab (PGSTAT modelo MAC 40183), controlado con el software Nova 2.1. En todos los ensayos electroquímicos se utilizó una celda de tres electrodos que consistió en: un electrodo de trabajo de carbono vítreo (CH Instruments, Inc.), un electrodo de referencia de plata-cloruro de plata (Ag/AgCl, CH Instruments, Inc.) y una barra de grafito como contraelectrodo de 2,00 y 140 mm de diámetro y longitud respectivamente. La celda se agitó con la ayuda de una plancha magnética (IKA, modelo C-MAC-HS7).
La Espectrofotómetro de Absorción Atómica de llama, aire-acetileno, método de referencia Standard Methods, edición 21.2005 3111- B modificado, servicio proporcionado por el Laboratorio OSP, Universidad Central del Ecuador.
Reactivos y preparación de muestras
Los reactivos empleados en la preparación de las disoluciones son de grado analítico, marca Merck salvo que se indique lo contrario. Las disoluciones de bismuto y cadmio se prepararon a partir estándares comerciales con una concentración 4,78 mM y 8,89 mM (Inorganic ventures Inc.) respectivamente. La disolución patrón de Pb²⁺ se obtuvo a partir de acetato de plomo trihidratado (Pb(CH3COO)2•3H2O) diluido en ácido nítrico 2,00 %. Como electrolito soporte se utilizó ácido clorhídrico 0,100 M.
Procedimiento
En cada experimento se formaron películas de bismuto in situ a partir de una disolución 50,0 μM de Bi3⁺. Las mediciones se realizaron utilizando voltamperometría de onda cuadrada con redisolución anódica. A continuación, se detallan los parámetros experimentales adaptados de: amplitud de 30,0 mV, frecuencia 25,0 Hz, ancho de pulso de 5,00 mV, tiempo de depósito 500 s, tiempo de acondicionamiento 5,00 s, agitación de la celda 350 rpm y barrido de potencial de -1,10 hasta 0,300 V vs Ag/AgCl.
Curva de calibración
Se partió de 5,00 mL de una disolución 0,100 M de HCl con 50 µM de Bi3⁺ en la celda, que se agitó durante 500 segundos, inmediatamente se detuvo la agitación y se esperaron 5,00 s de acondicionamiento estableciendo la lectura del blanco. A continuación, se agregó volúmenes adecuados de disoluciones patrón 1,00 mM para obtener en la celda concentraciones de 0,200; 0,400; 0,600; 1,00; 2,00; 3,00; 5,00 y 10,0 micro molar de cada ion metálico. Se determinó la altura de pico de cada medición, con la ayuda del software Nova 2.0.
Se inició con 5,00 mL de una disolución de HCl 0,100 M y 50 µM de Bi3⁺, esta mezcla se agitó por 500 segundos, tiempo durante el cual se aplicó un voltaje de reducción de -1,00 V vs Ag/AgCl, con el objetivo de depositar la mayor cantidad de metales presentes en el electrodo de trabajo. Trascurrido el tiempo de depósito se acondicionó la celda por 5,00 segundos. Inmediatamente se realizó un barrido de potencial y se obtuvo el registro del blanco. A continuación, se agregó volúmenes de disoluciones patrón de Pb2⁺ y Cd2⁺ de concentración 1,00 mM buscando obtener concentraciones adecuadas de cada ion metálico en la celda. Se determinó la corriente de pico en cada medición, con la ayuda del software Nova.
Pretratamiento de las muestras
De un supermercado local se tomó aleatoriamente muestras de: canela pulverizada, leche en polvo, harina de trigo, avena en hojuelas, café molido y salsa de tomate. En un crisol de porcelana, se pesó por duplicado alrededor de 1,00 g de cada muestra. A un juego de muestras se añadió cantidad suficiente de plomo con el fin de obtener una concentración de 9,65 µmol/kg. Las muestras se calcinaron a una temperatura de alrededor de 950 °C con la ayuda de un mechero Fisher hasta la obtención de cenizas. Posteriormente, se añadió 1,00 mL de HNO3 concentrado al 67,0%, para oxidar la materia orgánica de las muestras mediante digestión ácida, a continuación los crisoles se calentaron en una plancha a una temperatura promedio de120 °C para acelerar la reacción de oxidación y secar la muestra.
A continuación, las muestras se enfriaron y filtraron a través de papel (Reagent), los residuos se lavaron con una disolución de HCl 0,100 M. Finalmente, la disolución resultante, así como los volúmenes de lavado se recolectaron y se llevaron a un volumen constante de 10,0 mL. Para las mediciones electroquímicas, se transfirieron 5,00 mL de disolución pretratada a la celda de tres electrodos, donde se agregó un volumen adecuado de Bi³⁺, para obtener en la celda una concentración de 50 µM. Al final, se midió la concentración de Pb2⁺ usando la curva de calibración antes construida, las mediciones se realizaron por triplicado.
III. RESULTADOS
Metodología
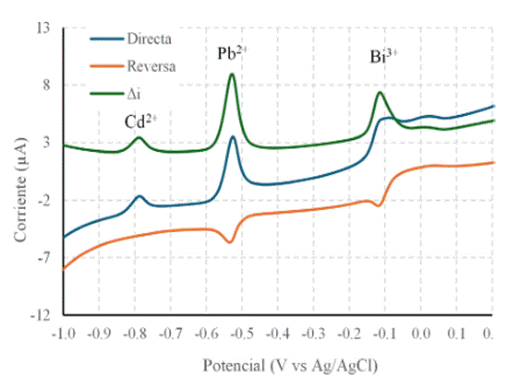
Para la determinación de plomo y cadmio se utilizaron electrodos de película de bismuto, con SWASV, como se observa en la figura 1.
Curva de calibración
Una vez establecidos los parámetros experimentales, se construyó la respectiva curva de calibración que se muestra en la Figura 2.

Figura 2 (a) Familia de voltamperogramas de onda cuadrada a diferentes concentraciones de iones Pb2⁺ y Cd2+ con electrodos de película de bismuto generados in-situ sobre carbono vítreo. (b) Curvas de calibración para Pb2+ líneas rojas y Cd2+, línea azul.
Con los datos obtenidos de la curva de calibración, se determinaron los parámetros de calidad de este método, como se detalla en la Tabla 1.
Tabla 1 Parámetros de calidad del método electroquímico para la determinación de plomo y cadmio.

‡Primer intervalo lineal
A continuación, se preparó una muestra enriquecida (spiked sample) de canela que fue analizada por un laboratorio externo acreditado, usando espectroscopía de absorción atómica de llama, AAS (por sus siglas en inglés, Atomic Absortion Sprectoscopy), los resultados obtenidos en este ensayo se muestran en la Tabla 2.
IV. DISCUSIÓN
Metodología
El análisis de plomo y cadmio se llevó a cabo mediante SWASV sobre electrodos de película de bismuto. En esta técnica se compone de dos pasos, el primero corresponde al depósito, donde mediante agitación y un tiempo determinado, se impone un valor de potencial que reduce las especies presentes sobre el electrodo de trabajo, en este paso se forma la película de bismuto sobre la cual se forman aleaciones de bismuto con los otros metales presentes en disolución. 15 En el segundo paso se aplica una técnica basada en secuencia de pulsos para oxidar y disolver los metales previamente depositados. Se realizaron ensayos exploratorios para seleccionar la mejor secuencia de pulsos a usar durante el proceso de redisolución. Se optó por usar voltamperometría de onda cuadrada, SWV, sobre voltamperometría diferencial de pulsos DPV(por sus siglas en inglés, Differential Pulse Voltammetry), por la rapidez de análisis, que es de alrededor de un tercio respecto de DPV. La señal de corriente obtenida con SWV es cerca de 1.5 veces más grande con respecto a DPV. 17 En la Figura 1, se presentan registros de corriente vs potencial, i vs E, correspondientes a la voltamperometría de onda cuadrada, donde se observan señales de oxidación línea azul y de reducción línea roja. La resta de las corrientes de oxidación menos la de reducción se presenta de color verde donde se observan potenciales de pico a -0,797; -0,526 y -0,113 V vs Ag/AgCl, que corresponden iones cadmio, plomo y bismuto respectivamente. 18,19 En esta Figura 1, también se aprecia que las tres especies, tienen picos en los registros de corriente de oxidación y reducción indicando la reversibilidad química y electroquímica de los iones en estudio.20
Curva de calibración
Con los parámetros experimentales de la SWASV se obtuvieron una familia de registros a diferentes concentraciones de iones plomo y cadmio, como se observa en la Figura 2 a). Se midieron las corrientes de pico, encontrando relaciones lineales, de modo que se construyeron las respectivas curvas de calibración, que se presentan en la Figura 2 b). Se realizó un ajuste de mínimos cuadrados para obtener la mejor recta que describe los datos experimentales, a partir de este ajuste se obtuvieron los parámetros de calidad del método, que se resumen en la Tabla 1. El límite de detección LOD (por sus siglas en inglés Limit Of Detection), se calculó sumado a la señal del blanco tres veces la desviación estándar sy/x, LOD =ip,blanco +3 sy/x. La desviación sy/x, es un parámetro estadístico que estima los errores cometidos en el eje de las ordenadas, (ip, experimental - ip, ajustada) a lo largo de la curva de calibración, es decir todos los valores de las abscisas.(21) El límite de cuantificación se calculó multiplicando por un factor de diez el valor sy/x y sumarlo al de la ordenada al origen.
Para el ion Pb2⁺, en el rango de concentración en estudio, se encontraron dos intervalos lineales, los parámetros del primer intervalo se presentan en la tabla 1, mientras que para el segundo intervalo lineal que va desde 2,0 hasta 7,0 μM, se determinó una sensibilidad de 1,24 A•mol-1•L, una ordenada al origen de 1,79 μA y un coeficiente de correlación r de 0,99. Este método de análisis, permite determinar de manera simultánea plomo y cadmio, sin la necesidad de cambiar lámparas o introducir en el equipo nuevas disoluciones, como ocurre en AAS de llama. 22 Es importante resaltar que las técnicas electroquímicas no requieren de consumibles costosos como acetileno, el volumen de muestra que se requiere es de alrededor de 5,00 mL.
A continuación, se realizó un ensayo de intercomparación, para ello se preparó una muestra de canela enriquecida con iones plomo, agregando 10,0 μL de disolución 1,00 mM de Pb2⁺ a 1,00 g de canela en polvo. Se calcinó, y se trató la muestra sintética, como se describe en la metodología experimental, al final del pretratamiento se envió a un laboratorio certificado para determinar la cantidad de plomo con la técnica de espectroscopía de absorción atómica de llama. Los resultados de este ensayo se presentan en la Tabla 2. Se obtuvo un error relativo menor al 1,00%, mostrando que el método desarrollado es fiable y aplicable a muestras reales.
Muestras
Uno de los principales inconvenientes en usar técnicas electroquímicas para la medición de metales tóxicos en muestras alimenticias reales es el pretratamiento de muestras. 23,24 En la celda electroquímica, se debe procurar la inexistencia de residuos orgánicos o inorgánicos, puesto que estos compuestos suelen tener actividad electroquímica con potenciales redox que se solapan con las señales del analito. Por este motivo se decidió calcinar las muestras usando un mechero, dada su simplicidad de manejo y fácil acceso, en lugar de una mufla. Para eliminar por completo compuestos de carbono, se usó disolución piraña, que es una mezcla de H2SO4 y H2O2. Se observó que al añadir ácido clorhídrico que actúa como electrolito soporte, este reaccionó con restos de la disolución piraña, obteniendo compuestos derivados del cloro, que interfieren con las mediciones electroquímicas.
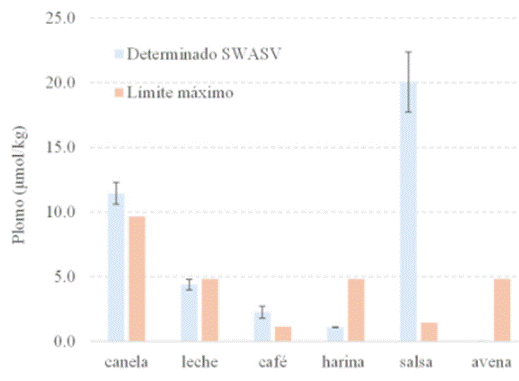
En consecuencia, para eliminar los residuos orgánicos se utilizó ácido nítrico concentrado al 67,0 %, que se calentó con la ayuda de una plancha calefactora hasta sequedad, con este tratamiento se aseguró la oxidación de la muestra. 25 La combinación de calcinación y digestión ácida permitió obtener un fondo electroactivo libre de ruido, para las mediciones de SWASV, como se observa en la Figura 2a. El eje de las ordenadas de la Figura 3, corresponde a la concentración de plomo expresado en micromoles de metal por cada kilogramo de alimento, en esta figura, las barras en azul indican la concentración de plomo en alimentos, mientras que las barras en rojo representan las concentraciones máximas recomendadas (CMR) por diferentes organismos de control, 26,27 cuyo detalle se describe en la Tabla 3.
Tabla 3 Valores de plomo encontrados en seis muestras alimenticias y las corespondientes concentraciones maximas recomedadas CMR

CMR= concentración máxima recomendada, NTE = Norma Técnica Ecuatoriana, INEN= Instituto Ecuatoriano de Normalización JECFA= Joint FAO/WHO Expert Committee on Food Additives,(26) ESFA= European Food Safety Autority, Scientific Opinion on Lead in Food.27
En ninguno de los alimentos estudiados se encontró cantidades medibles de Cd2⁺, únicamente se encontró recobros de plomo de alrededor del 80%. En las hojuelas de avena no se detectó plomo en cantidades medibles por este método, mientras que en la salsa de tomate se encontró una concentración alarmante de plomo, 20 veces más alta que la CMR reportada en la norma técnica ecuatoriana, número 0271. El café tostado y molido también presentó cerca del doble de la concentración máxima permitida de plomo. La cantidad de plomo en harina es alrededor de 4 veces menor que la CMR para ese tipo de alimento. En la muestra de canela en polvo, que es uno de alimentos que el ARCSA ha reportado estar contaminado con plomo, se encontró cerca de 18% más Pb2⁺, que la concentración máxima recomendada en la norma técnica ecuatoriana 2532 del año 2010.
V. CONCLUSIONES
Se estableció una metodología basada en voltamperometría de onda cuadrada con redisolución anódica para medir plomo y cadmio en muestras alimentarias. El presente método permite medir metales en rangos de concentración de 0,200 hasta 7,00 μM para plomo y de 3,00 hasta 15,0 μM para cadmio. También se presenta el pretratamiento de muestras usando equipos de laboratorio asequibles y de fácil uso. Se encontró plomo en cinco de las seis muestras seleccionadas, donde la muestra de salsa de tomate esudiada, contiene Pb2⁺ en una concentración 20 veces más alta que la concentración máxima recomendada por la normativa ecuatoriana