INTRODUCCIÓN
El limoneno es un compuesto bioactivo volátil que se caracteriza por tener un olor a limón, ser líquido a temperatura ambiente y extraerse principalmente como aceite esencial de gran variedad de frutos cítricos 1,2, siendo la mayor composición monoterpénica de frutos como la lima dulce 3,4. Gracias a que este compuesto es Generalmente Reconocido como Seguro (GRAS, por sus siglas en inglés) 5 uno de sus usos es como aditivo alimentario a nivel indutrial 6,7 y dentro de sus propiedades beneficiosas se destaca su actividad antimicrobiana 1,8,9.
Por su parte, la brucita es un nanohidróxido o hidroxisal laminar (HSL) del hidróxido de magnesio, Mg(OH)2 10, éstas estructuras catiónicas simples se caracterizan por formar láminas de octaedros, en donde el catión Mg²⁺ está coordinando con 6 aniones OH- unidos entre sí por fuerzas de Van der Waals con la capacidad de intercambiar aniones sin que su estructura laminar sea afectada, lo que les permite retener compuestos en su espacio intersticial entre lámina y lámina o adsorberlos 11,12. Dentro de las propiedades de estos nanohidróxidos se destaca su alta estabilidad química, térmica y biocompatibilidad, así como su fácil preparación y degradación 13,14. En cuanto a sus aplicaciones, se han usado HSL de zinc en compuestos bioactivos como la nisina, manteniendo su actividad durante 25 días, y proporcionándole estabilidad térmica, química y enzimática 10.
Por esto, la formación de nanohidróxidos basados en hidroxisales laminares se presenta como una alternativa novedosa, sencilla y segura para dar valor agregado y estabilizar compuestos bioativos con posible aplicación en la industria alimentaria para la conservación de frutas, verduras y productos empacados, garantizando así su inocuidad.
MATERIALES Y MÉTODOS
Formación de brucita y nanohidróxido limoneno-brucita
La brucita (HSLMg) fue sintetizada mediante precipitación disolviendo 12 g de cloruro de magnesio hexahidratado (Golden Bell) y 4.86 g de glucosa (Sigma Aldrich) en 300 mL de agua destilada, agregando posteriormente gota a gota con agitación constante hidróxido de sodio 0.1 M (Golden Bell) hasta alcanzar un pH de 10.5; una vez finalizado el goteo la solución se dejó en agitación durante 24 h. Posteriormente, se realizaron 2 lavados con agua destilada por centrifugación (1580R, Labogene) a 10,000 rpm durante 10 min a 25 ºC, y el sedimento se secó en un horno de convección forzada (FE-291, Felisa) durante 48 h.
Para la formación del nanocompuesto limoneno-brucita (L-HSLMg) se preparó una solución de 50 mL de agua destilada con limoneno (5 mg/mL) y se agregaron 500 mg de la HSLMg; este sistema se dejó en agitación constante, tomando alícuotas del sobrenadante cada 15 min y midiendo en un espectrofotómetro (NanoDrop 2000, Termo Scientific) a una longitud de onda de 233 nm hasta alcanzar una absorbancia constante. Finalmente, se realizaron lavados como se mencionó anteriormente.
Caracterización de los nanomateriales
Se generaron difractogramas en un difractómetro de Rayos-X (Panalytical Empyrean, Malvern) con radiación CuKα desde 5º hasta 70° con un paso de 0.02 y un tiempo de colecta de 30 s por paso. Los espectros FT-IR fueron recolectados en un espectrofotómetro Cary 630 (Agilent Technologies) en un intervalo de 4000 a 500 cm-1 con 32 scans por muestra y resolución nominal de 4 cm-1. Las micrografías fueron registradas en un microscopio FE-SEM (Mira 3LMU, Tescan) con un voltaje de aceleración de 10 kV.
Evaluación antimicrobiana
Se llevó a cabo el método de microdilución en placa usando cepas patógenas de Escherichia coli ATCC 8739 y Staphylococcus aureus ATCC 25923 previamente sembradas en caldo soya tripticasa (CST) a 37 °C durante 24 h. Se transfirieron 20 µL de los nanomateriales (50 mg/mL), 20 µL de bacteria (1x106 cel/mL) y 160 µL de CST a cada pozo de una microplaca de 96 pozos. Se incubó por 24 h a 37 °C y posteriormente se midió la absorbancia a 600 nm en un lector de microplacas (iMark, BioRad). Como control positivo se usó ampicilina (0.1 mg/mL) y negativo CST sin inocular.
Análisis estadístico
El análisis estadístico se llevó a cabo con estadística descriptiva (promedio ± SD) mediante un análisis simple de varianza ANOVA en conjunto con la prueba de Tukey’s HSD (α=0.05) usando el software estadístico Statgraphics Centurion XIX, versión 19.2.02 (Stat Point), todas las pruebas se realizaron por triplicado.
RESULTADOS
Formación de brucita y nanohidróxido limoneno-brucita
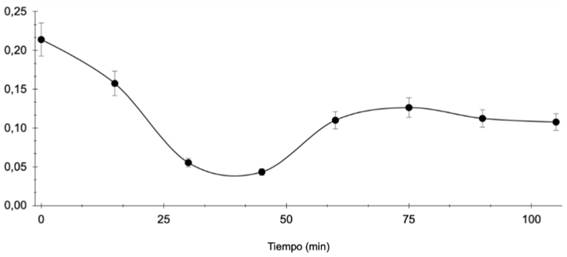
En la curva de adsorción de limoneno en el hidróxido HSLMg (Figura 1), se observa una disminución dependiente del tiempo hasta alcanzar una absorbancia de 0.11 después de 60 min.
Caracterización de los nanomateriales
De acuerdo con la base de datos JADE, el difractograma de la HSLMg (Figura 2) presenta los picos característicos de la brucita; por otro lado, los picos del nanohidróxido L-HSLMg en comparación con los del HSLMg presentan una mayor intensidad y están ubicados en el mismo ángulo de difracción.
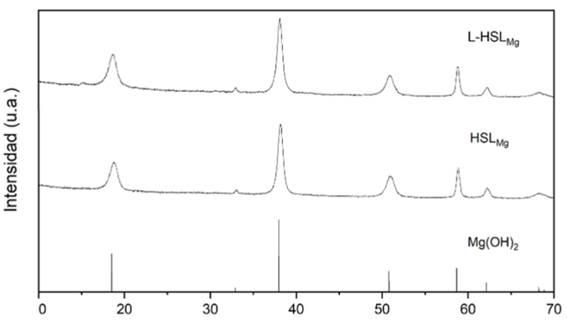
Figura 2 Difractogramas de brucita según la base de datos JADE (Mg(OH)2), sintetizada (HSLMg) y nanohidróxido limoneno-brucita (L-HSLMg).
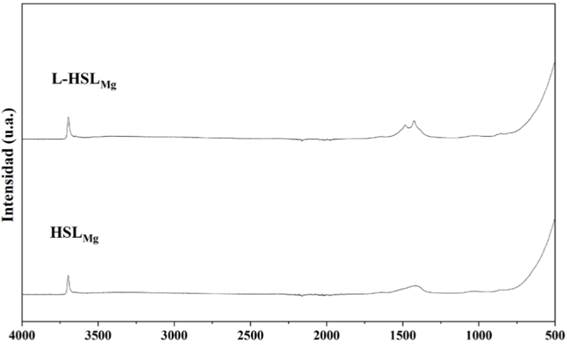
En el espectro FT-IR del nanocompuesto L-HSLMg comparado con el espectro de la HSLMg (Figura 3) se observa un alargamiento en el pico de número de onda de aproximadamente 3200 cm-¹ característico para vibraciones de grupos funcionales OH- de intensidad alta, así como un cambio en los picos que se presentan en las longitudes de onda de vibraciones de entre 1400 cm-¹ y 1500 cm-¹ pertenecientes a grupos funcionales OH- de intensidad media.
En la micrografía de la HSLMg (Figura 4A) se observa la estructura laminar característica de la brucita con tamaños de partícula menores a 500 nm; por su parte, en la del L-HSLMg (Figura 4B), además de observar la estructura laminar, se observan diferencias morfológicas en forma de pequeños grumos.
Evaluación antimicrobiana
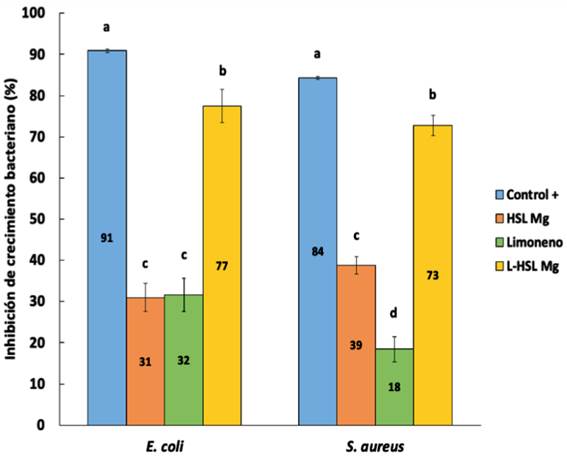
El porcentaje de inhibición de E. coli y S. aureus en presencia de los materiales HSLMg y L-HSLMg se muestran en la Figura 5. Se puede observar que para ambas cepas se alcanzan valores de inhibición de alrededor del 75 % con L-HSLMg, siendo un efecto estadísticamente significativo comparando con la inhibición obtenida por la HSLMg y el limoneno puro.
DISCUSIÓN
Debido a que se presentó una reducción en la absorbancia superficial del limoneno durante el proceso de formación del nanohidróxido L-HSLMg, se presume que las partículas de HSLMg sedimentadas adsorbieron y/o intercalaron el limoneno, como se ha reportado en otros trabajos 10. Los difractogramas muestran los picos característicos reportados para la brucita, con lo que se corrobora la obtención del compuesto 15,16, sin embargo, al no existir desplazamiento de la primera señal se puede asumir que el limoneno no se intercaló en el espacio interlaminar. Por otro lado, la aparición de una pequeña señal en el ángulo de 11° podría sugerir la presencia del compuesto orgánico 17. Por su parte, en los espectros FT-IR el aumento de la absorbancia en picos característicos de grupos funcionales OH- en el nanocompuesto L-HSLMg en comparación con la HSLMg es evidencia de la interacción de estos grupos con los grupos funcionales metilo del limoneno y así como lo reporta Velazquez-Carriles et al. (10, 18, 19) esto indica la presencia del compuesto bioactivo en la HSLMg. En la micrografía de la HSLMg se observa que se obtuvo la estructura deseada para este compuesto puesto que es parecida a la que se observa en la investigación reportada por Wang et al. (13, 20, 21) mientras que en la del nanohidróxido L-HSLMg los grumos que se observan en la estructura laminar son atribuidos a la presencia del limoneno entre y sobre las láminas de HSLMg.
Se ha reportado que los nanohidróxidos de magnesio pueden producir especies reactivas de oxígeno, lo que les confiere actividad antimicrobiana al provocar daño en la pared celular 22-24. Además, Zhu et al. 25 demostraron que estos compuestos favorecen la fuga de componentes celulares como ácidos nucleicos, lo que inhibe la síntesis de proteínas. El nanocompuesto L-HSLMg produjo inhibiciones superiores al HSLMg y limoneno, potenciando así la actividad como lo reportó Han et al. 1 al presentar un efecto sinérgico entre el nanohidróxido y el compuesto bioactivo. Estos resultados sugieren que estos nanohidróxidos podrían exhibir actividad antimicrobiana contra bacterias tanto Gram positivas como Gram negativas.
V. CONCLUSIONES
Se logró obtener HSLMg y se formó el nanohidróxido L-HSLMg, siendo esto confirmado con pruebas espectrofotométricas, de DRX, FT-IR y SEM. Por su parte, la evaluación antimicrobiana de estos nanocompuestos fue realizada en dos cepas patógenas alimentarias, E. coli y S. aureus, las cuales mostraron una mayor inhibición en crecimiento cuando se usó el nanocompuesto L-HSLMg, demostrando que para estas bacterias la HSLMg no solo mantiene la actividad antimicrobiana del compuesto bioactivo, sino que también la potencializa. Estos resultados dejan al descubierto lo promisorio que podría ser el uso de estos nanocompuestos en la industria alimentaria con el propósito de garantizar la inocuidad de los alimentos.