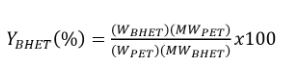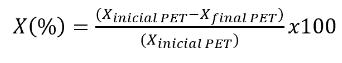INTRODUCCIÓN
El Poli teftalato de etileno se trata de un poliéster termoplástico semicristalino considerado como un material versátil en la economía global y utilizado en diferentes aplicaciones, una de las más importantes, en la industria del empaquetado, es decir, formando parte de los envases de productos de primera necesidad debido a sus propiedades como ligereza, durabilidad y resistencia química1, además de sus bajos costos de producción y facilidad de obtención. La naturaleza no biodegradable del material hace que los desechos de éste se incrementen progresivamente con el pasar de los años mismo que ha llegado a convertirse en un potente agente contaminante peligroso para el medio ambiente después de su uso2.
La Organización Mundial de las Naciones Unidas ONU menciona que en el mundo se generan alrededor de 300 millones de toneladas de residuos plásticos y dentro de esta cifra se encuentra que al menos 13 millones de toneladas de residuos plásticos al año son arrojados a los océanos, factor crítico que afecta la biodiversidad, la economía y salud de las personas y otros seres vivos.
El PET posee diversas propiedades que lo convierten en un material 100% apto para el reciclaje, una de ellas es que, al ser el PET un polímero termoplástico posee la capacidad de deformarse y ablandarse al ser sometido al calor mientras que al enfriarse, éste se convierte en una masa sólida facilitando su reciclaje, entre los métodos más utilizados de reciclaje de material PET, destacan cuatro:
I. Reciclaje primario o re extrusión
II. Reciclaje secundario o mecánico
III. Reciclaje terciario o químico
IV. Reciclaje cuaternario o recuperación energética3.
El reciclaje terciario o reciclaje químico de residuos PET se trata de un método de reciclaje en el que se realiza un tratamiento con productos químicos específicos provocando la ruptura de las cadenas largas por medio de un mecanismo de solvólisis para la obtención de sustancias como productos principales de reacción dependiendo del solvente utilizado, éstas corresponden al Bis- 2-hidroxietil tereftalato (BHET), ácido tereftálico (TPA), tereftalato de dimetilo (DMT) (4, éste tipo de reciclaje se da por diferentes técnicas de despolimerización con el uso de diferentes disolventes mismo que puede realizarse por:
I. Metanólisis: Metanol
II. Glucólisis: Etilenglicol
III. Hidrólisis: Ácidos y álcalis
IV. Aminólisis: Aminas y poliaminas y
V. Amonólisis: Amoníaco5
Actualmente el reciclaje químico del PET ha sido considerado como una de las alternativas de reciclaje más ventajosas debido a que éste se realiza con el objetivo de recuperar componentes petroquímicos sintéticos6. Una de las técnicas de reciclaje químico que sigue con los principios del desarrollo sostenible evitando la utilización de ácidos y álcalis fuertes es la glucólisis de PET, ésta técnica se trata de la degradación molecular del material plástico por acción de glicoles, el más común es el etilenglicol (EG) para obtener el monómero BHET como producto principal de la reacción, mismo que por reacciones de policondensación se puede utilizar como componente principal para la elaboración de productos sintéticos como resinas de poliéster insaturado, hormigón polimérico, espumas de poliuretano, entre otros7.
Acorde a la cinética de la reacción glucolítica de PET, se ha demostrado que la reacción sin la presencia de un catalizador es una reacción que puede durar hasta 8 horas requiriendo una energía de activación de 32 kcal/mol, es así que el uso de catalizadores es primordial, mismos que disminuyen la energía de activación a 19 kcal/ mol, obteniéndose una despolimerización casi completa y teniendo en cuenta los catalizadores de transesterificación más afines a la reacción8. La reacción de glucólisis del PET es una reacción reversible, siguiendo el mecanismo de reacción donde los enlaces éster del PET se rompen y reemplazan con terminales hidroxilo9, al ser una reacción reversible es importante conocer las condiciones de reacción. Según Ragaert y Delva en su estudio acerca de Glucólisis de PET10 existen varios factores que intervienen directamente en la velocidad de reacción de la glucólisis del PET, entre ellos:
I. Temperatura de reacción, misma que se encuentra en un rango de 180 °C a 250 °C,
II. Relación PET/EG de 1:2 o 1:311,
III. El tipo y la cantidad de catalizador, como óxido de zinc, acetato de zinc y carbonato de sodio que se consideran catalizadores de transesterificación siendo éstos derivados de metales y finalmente
IV. Tamaño de partícula12
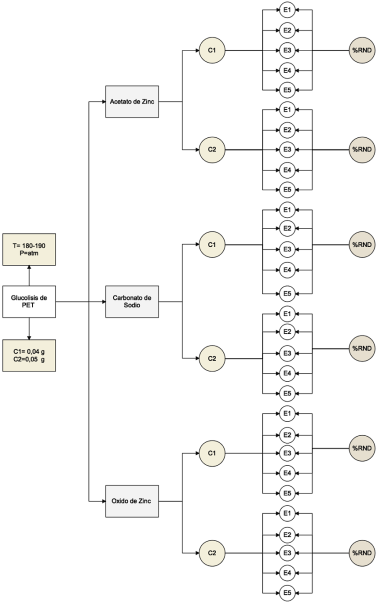
El presente estudio se basa en la realización de la reacción de glucólisis de PET reciclado de envases de agua para bebidas a nivel de laboratorio, modificando el tipo y la cantidad de catalizador utilizado en el proceso, con el fin de determinar el catalizador óptimo y con el que se obtienen los mejores rendimientos para este tipo de procesos.
MATERIALES y MÉTODOS
Equipos
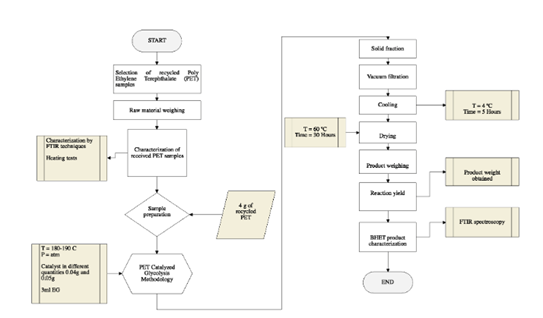
El equipo utilizado para la caracterización de las muestras de PET post-consumo y del producto glucolizado fue un espectrofotómetro de transformada de Fourier (FT-IR) modelo JASCO FT / IR-4100, con rango de medida en número de onda de 7.800 a 350 cm-1 y resolución de 0,9 cm- 1. Para la experimentación, se utiliza una placa calefactora, modelo SH-1, con una temperatura máxima de la placa de 350 °C (662 °F) ± 10 °C. Además, se utilizó una estufa SRN 112, la cual opera en un rango de temperatura de + 5 °C hasta una temperatura de 250 °C, finalmente para el proceso de filtración se utilizó una bomba de vacío DOA-P704 mostrada que soporta una presión de 60 psig.
Caracterización del poli tereftalato de etileno (PET) post-consumo
Las botellas de plástico fueron recolectadas aleatoriamente desde recipientes de residuos sólidos municipales considerando muestras de diferente color, tamaño y marca, para la caracterización de la materia prima se trituró el material plástico recolectado en gránulos de un tamaño de partícula de aproximadamente 0,5 x 0,5 cm. Los componentes principales de las botellas de plástico se identificaron mediante técnicas (FT-IR) con el fin de identificar los grupos funcionales correspondientes al polímero en cuestión. Además, se realizaron pruebas de calentamiento con el fin de corroborar que las muestras utilizadas para la experimentación pertenecen a la categoría de plásticos de PET, para ello, las muestras de PET fueron sometidas a pruebas de calentamiento a la llama observando su comportamiento con el calor y ensayos de densidad a presión atmosférica.
Glucólisis de PET
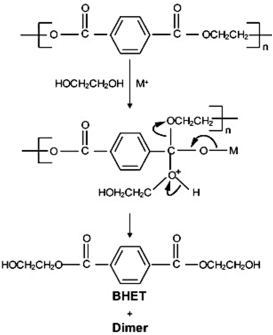
La glucólisis de PET se llevó a cabo en un reactor de vidrio con capacidad de 250 ml siguiendo la metodología propuesta por13, equipado en un reactor de vidrio adaptado con un balón de 2 bocas y un tubo de enfriamiento, en una de las bocas se colocó un termómetro para controlar la temperatura durante las dos horas de reacción. Siguiendo el esquema del mecanismo de reacción de glucólisis catalizada de la Figura 1, la reacción de glucólisis se ejecuta por etapas, en la etapa de iniciación los electrones libres en el oxígeno correspondiente al EG atacan al carbono carbonilo que se encuentra en el grupo éster del plástico, la segunda etapa es la etapa de propagación en donde el grupo hidroxietilo del EG conforma un nuevo enlace con el carbono carbonilo del PET que provoca el rompimiento de cadenas alargadas en moléculas más pequeñas como trímeros, dímeros y por último en la etapa de finalización el monómero Bis-2-Hidroxietil tereftalato, el catalizador a base de metales forma un complejo con el grupo carbonilo facilitando dicho ataque.
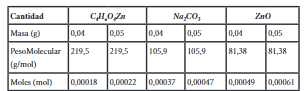
Los 4 g de muestra de plástico (PET) se añadieron junto con la cantidad de catalizador, como se muestra en la Tabla 1, y adicionalmente con 3 ml de etilenglicol (EG). Basado en los análisis previamente investigados, se determinó el rango de temperatura de reacción misma que se encuentra entre 180 y 190 °C14, con un tiempo de reacción de 2 horas. Los productos glucolizados se analizaron mediante técnicas FT-IR , al final de cada experimento se recogió la muestra de producto y se pesó el residuo sin reaccionar ubicado en el fondo del reactor y también se pesó el producto de la glucólisis. La representación esquemática del proceso se muestra en la Figura 1.
Caracterización del producto glucolizado
Las muestras obtenidas de cada experimento se caracterizaron mediante técnicas FT-IR, identificando así los grupos funcionales del principal producto bis-2- (hidroxietil) tereftalato (BHET), además, se pesó el producto final para calcular el porcentaje de rendimiento. y conversión de PET durante la reacción.
Rendimiento del producto glucolizado (BHET) (%)
El rendimiento del producto glucolizado obtenido se calculó a partir de la siguiente fórmula, misma que involucra mediante la cantidad de producto en relación a la masa de PET alimentado al inicio del proceso, a partir de la siguiente ecuación:
Dónde:
Conversión del PET (%)
El porcentaje de conversión de PET en la reacción de glucólisis catalizada es la cantidad de plástico que reaccionó, esto se calcula aplicando la ecuación15.
Dónde:
RESULTADOS
Test de identificación del polímero
El comportamiento de la muestra al ser sometida al calor muestra que el PET, debido a que es un polímero semicristalino, presenta un cambio de color, una transición de un color lechoso a un color prácticamente transparente, además, se observaron características como el hollín en la superficie del plástico, características que confirman que la muestra utilizada en la experimentación es polímero PET16.
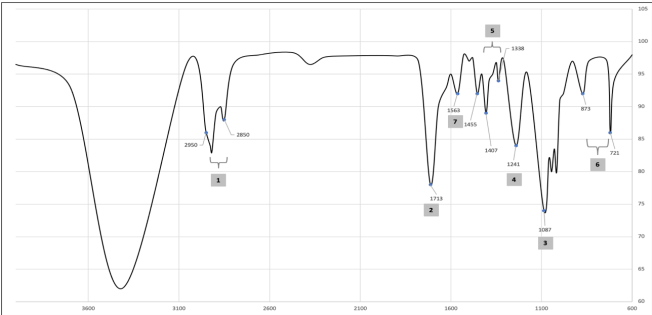
Los picos pronunciados del espectro 1 en el número de onda 2950.55-2850.27 cm-1 Enlaces C-H (estiramiento asimétrico), 2 en 1713 cm-1 banda de absorción correspondiente al estiramiento del grupo C = O del ácido carboxílico, 3 y 4 con una banda de absorción correspondiente al valor de 1087,66 cm-1 y 1241,93 cm-1 corresponde al grupo tereftalato OOC-C6 H4-COO17, 5 la banda de absorción en 1338.36 y 1407.78 cm-1 son atribuidos a la alteración en el enlace Carbono e hidrógeno C-H, en 6 con bandas de absorción de 873 y 721 cm-1 corresponden a los grupos C-H en el anillo de benceno18, por último en 7 se observan el enlace N-H correspondiente a las amidas que se deben a las sustancias utilizadas como aditivos en el plástico19.
Rendimiento del producto glucolizado
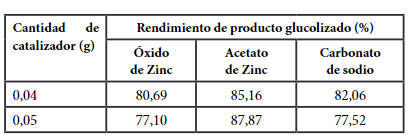
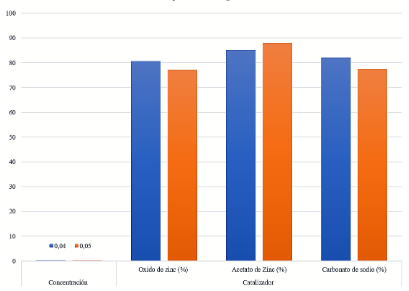
El rendimiento de las muestras obtenidas con los tres tipos diferentes de catalizador se muestra en la Tabla 2.
Análisis estadístico
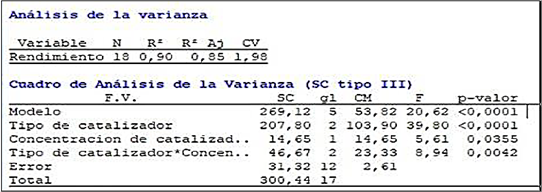
Utilizando el software Infostat, se realizó un análisis de varianza ANOVA de dos vías seguido de un test de TUKEY con el fin de analizar las diferencias estadísticamente significativas entre los resultados del diseño experimental de la investigación que se muestra en la Figura 4.
El test se realizó tomando en cuenta dos variables independientes, correspondientes al tipo de catalizador empleado y la variación en la cantidad de cada uno de ellos, seguido de una variable dependiente correspondiente al porcentaje de rendimiento de reacción.
Acorde al test ANOVA realizado se puede observar que existen efectos principales estadísticamente significativos en las tres variables de análisis ya que se obtuvo un p-valor < 0,05.
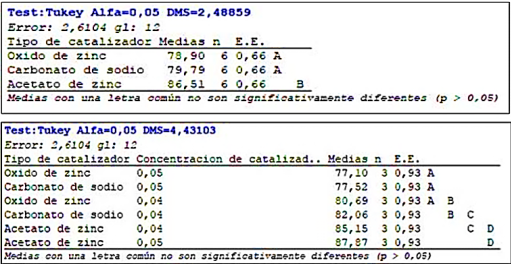
Por medio del test de Tukey se puede observar no hay diferencia estadísticamente significativa entre el ZnO y Na2CO3, pero si se observan diferencias relevantes con el C4H10O6Zn y de la misma manera tomando en cuenta la interacción de variables se encontró que no existe diferencia estadísticamente significativa utilizando las dos cantidades de Acetato de Zinc ya que la media reflejada en las tablas Tukey pertenecen al mismo grupo (D).
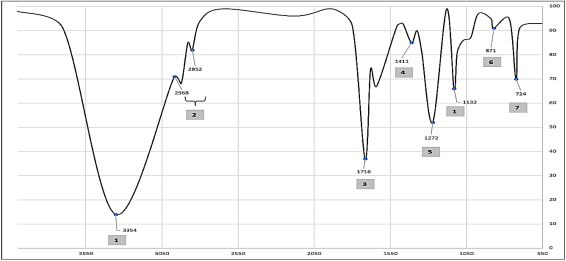
La Figura 4 muestra los picos pronunciados correspondientes a los grupos funcionales característicos de la molécula BHET con los 3 catalizadores utilizados, el monómero BHET tiene picos prominentes en 1 número de onda de 3354.57 cm-1 atribuidos a los grupos OH, 2 2852.2 y 2968,87 cm-1 (alquilo C - H)203 a 1716,34cm-1 enlaces C = O, 4 a 1411.64 cm-1 enlaces C = C, 5 1132.01 y 1272.09 cm-1 enlace éster C-O, la absorción alcanza su punto máximo en 6 de 871,916 cm-1 y 7 a 724,139 cm-1 perteneciente al anillo de fenilo aromático21.
DISCUSIÓN
La Figura 3 muestra los resultados en rendimiento de BHET con cada uno de los catalizadores utilizados, muestran que el rendimiento es mayor con uno de los catalizadores utilizados, el cual es el acetato de zinc, con un rendimiento equivalente de 87.87%, con una cantidad incrementada de acetato de zinc de 0,05 g y 4 g suministrados de plástico. La glucólisis de PET utiliza catalizadores de transesterificación para disminuir la energía de activación de la reacción, el acetato de zinc genera mejores rendimientos de BHET porque el Zn²⁺ es el metal que posee una baja energía de ionización para mejorar la activación de los grupos carbonilo del poliéster en el reacción de glucólisis22.
La eficiencia de los acetatos metálicos en la reacción de despolimerización del PET por medio de la reacción de glucólisis catalizada se ejecuta en la jerarquía de Zn²⁺>Pb²⁺>Mn²⁺ por debajo de 245 °C23, teniendo en cuenta el mecanismo de reacción donde el metal forma un complejo con el grupo carbonilo facilitando el ataque de EG al PET, produciendo mejores rendimientos de BHET en comparación con otros catalizadores.
El porcentaje más bajo de rendimiento de BHET se obtiene con el catalizador de ZnO, la deficiencia está asociada con el área superficial del catalizador, el efecto de la sustancia que acelera la velocidad de reacción es proporcional al área superficial, una de las desventajas de los óxidos metálicos es la sinterización que causa un aumento del tamaño de partícula, reduciendo la superficie y su actividad catalítica justificando sus bajos rendimientos24,25.
En base a los resultados obtenidos a partir de los análisis estadísticos se concluye que para mejorar la eficiencia y rendimiento en la reacción de Glucólisis se debe utilizar 0,05 gramos de Acetato de zinc como catalizador, sin embargo acorde al análisis Tukey se debe utilizar 0,04 gramos de catalizador con el objetivo de reducción de costos.
CONCLUSIONES
Se realizó la glucólisis del tereftalato de polietileno para identificar el tipo de catalizador más afín con la reacción, se determinó que con acetato de zinc se obtienen altos rendimientos en términos de producto glucolizado considerando que los derivados de metales como el acetato de zinc utilizado como catalizador contiene al metal más activo el Zn²⁺, pero éste al ser un metal reconocido por su alta toxicidad puede ser reemplazada por una sal como el carbonato de sodio con la que se obtienen rendimientos cercanos a los obtenidos con acetato de zinc.