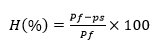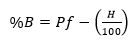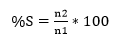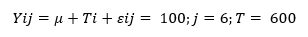1. Introducción
Las pasturas y forrajes son la fuente de alimentación principal para los rumiantes en las zonas tropicales. En estas regiones, el rendimiento de forraje y el valor nutritivo varía a lo largo del año debido al clima y al manejo inadecuado de la tierra. En este escenario, las estaciones del año son un tema importante, durante la época de lluvias hay excedentes de forraje, mientras que durante la época seca la disponibilidad de forraje es baja. En este sentido, el uso de las especies alternativas de árboles y arbustos (Hibiscus rosa sinensis) puede proporcionar altas cantidades de biomasa alimenticia (30 t ha-1 y 21 t ha-1 año-1) y alto contenido de proteína (19 %), comparado con pastos tropicales (8 %). Esto los convierte en una opción como alimento para rumiantes durante la época seca (Cruz Hernández et al., 2019).
Las especies no leguminosas, como Morus alba, Hibiscus rosa-sinensis y Trichanthea gigantea muestran tener un elevado potencial nutricional, su alta concentración de proteína y su rápida degradación en el rumen sugieren que su inclusión en dietas de baja calidad podría mejorar la eficiencia mediante la utilización de estas y mantener niveles adecuados de producción (Flores et al., 1998).
Los métodos de propagación más utilizados para la producción de plántulas de esta especie (Hibiscus rosa sinensis) conocida por varios nombres comunes como rosa china, Hibiscus chino, flor de avispa, o simplemente Hibiscus, se logra mediante injerto, acodo y esquejes, destacándose este último método, porque permite obtener un mayor número de plántulas por rama en menor tiempo (Lorenzi y Souza, 2008).
La formación de raíces es vital para absorber y conducir aguas más minerales disueltos, acumular nutrientes y sujetar la planta al suelo. Las hormonas producidas de forma natural o sintética son alternativas para tener mayor éxito en el prendimiento de las partes vegetativas, de manera que ayuden a la proliferación y formación de un buen sistema radicular que permita el crecimiento y desarrollo de una nueva planta. Las aplicaciones de hormonas de enraizamiento sintéticas son exitosas, pero costosas, por lo que es necesario mejorar el conocimiento de la propagación vegetativa con el uso de sustancias naturales (León Araujo, 2011; Jamal Uddin et al., 2020).
Las plantas H. rosa sinensis de siembra directa tienen sistemas radiculares deficientes durante los primeros 60 días, por lo cual la absorción de agua o nutrientes en esta época es muy limitada. Además, su orientación es plagio-gravitrópica superficial. Esta respuesta puede deberse a la fragilidad del sistema radicular, textura del suelo y gradientes de humedad muy altos a nivel superficial del suelo (Cuéllar y Arrieta Herrera, 2010).
Para lograr un eficiente manejo tecnológico de pasturas y forrajes se pueden considerar los productos orgánicos enraizadores, con la finalidad de aumentar el sistema radicular y, por ende, la capacidad de absorción de nutrientes; de esta forma las plantas tendrán mayor anclaje y así se podrá evitar el acame de las mismas (Vicuña Molina, 2015). Considerando lo antes mencionado, el presente trabajo de investigación consiste en evaluar enraizadores alternativos a los comerciales, que contribuyan a generar un buen crecimiento de esquejes de Hibiscus bajo condiciones de vivero.
2. Materiales y métodos
2.1. Localización del experimento
El experimento se realizó en la finca Santa Rosa de la Universidad Nacional Agraria. El área experimental se localiza en las coordenadas geográficas, “12°08'15.9" longitud norte y 86°10'05.9" longitud oeste, con una altitud de 56 m s.n.m. (Instituto Nicaragüense de Estudios Territoriales (INETER), 2022), el período evaluado fue desde septiembre 2022 hasta enero 2023.
2.2 Diseño del experimento
El experimento se realizó mediante un diseño completamente aleatorio (DCA) con seis tratamientos: T1-aloe vera; T2-aloe vera + melaza + huevo; T3-canela; T4-Trichoderma sp; T5-Moringa oleifera; T6-testigo. Se usaron 100 esquejes por tratamiento, y cada uno se constituye como una unidad experimental, para un total de 600 unidades de esquejes que se colocaron en un área aproximada de 32,2 m2 de un metro de ancho por dos metros de largo y un metro de separación.
2.3. Descripción de los tratamientos
Se evaluaron seis tratamientos conformados por aloe vera, canela, aloe + melaza + huevo, Moringa oleifera, Trichoderma sp y testigo (agua):
T1: Aloe vera: Se seleccionaron hojas grandes y vigorosas de la planta del aloe, se procedió a lavarlas, con ayuda de un cuchillo pequeño se eliminó la epidermis para obtener el gel, se retiraron impurezas y finalmente se depositó en un recipiente para posteriormente sumergir los esquejes en el aloe durante cinco minutos, con el fin de impregnar la parte inferior del corte en el tallo y proceder a colocar en las bolsas de vivero que contenían sustrato (El-Ahmir et al., 2021).
T2: Aloe vera + melaza + huevo: Para la obtención del gel de aloe se realizó el mismo procedimiento descrito anteriormente en el T1 luego se añadió melaza y huevos (solo se utilizaron las yemas), se mezclaron e integraron uniformemente los ingredientes y se procedió a remojar durante tres minutos los esquejes, luego se colocaron en bolsas de vivero que contenían sustrato (Araúz Meza y Luquéz Díaz, 2020).
T3: Cinnamomum verum: Se utilizaron 30 g de canela por litro de agua, se dejó en reposo durante una hora, pasado el tiempo, se procedió a filtrar y se sumergieron los esquejes durante tres minutos antes de sembrarlos en bolsas de vivero (El-Ahmir et al., 2021).
T4: Trichoderma sp: Se utilizaron 12,5 g de Trichoderma en 10 L de agua (dosis comercial 250 g del hongo en sustrato de arroz por hectárea), luego se procedió a sumergir los esquejes durante cinco minutos, para luego pasarlos a bolsas de vivero conteniendo sustrato, este microrganismo ha sido descrito como promotor de crecimiento radicular en cultivos anuales y perennes.
T5: Moringa oleifera: Se seleccionaron hojas sanas de la planta en un equivalente de 500 g, se licuó junto con tres litros de agua, se dejó reposar durante cinco horas. Posteriormente se sumergieron los esquejes en la solución durante 20 min, transcurrido el tiempo se colocaron en bolsas de vivero conteniendo sustrato (Pérez-Gómez et al., 2019).
T6: Sin solución enraizadora (testigo absoluto): Se procedió a sumergir los esquejes en agua durante tres min, antes de plantarse en bolsas de vivero conteniendo sustrato.
Cada tratamiento fue aplicado a 100 esquejes de H. rosa sinensis, se utilizaron bolsas de 8 x 12 pulgadas, conteniendo sustrato compuesto por suelo del área circundante y excretas de conejo. Para la distribución de los bloques se realizó asarización. Posteriormente se sumergieron las partes inferiores de los esquejes en los enraizantes durante tiempos variables y se procedió a sembrar (Tabla 1). Los datos fueron registrados a los 30 días (03/11/20), a los 60 días (02/12/2022) y a los 90 días (03/01/2023) después de la siembra de los esquejes.
2.4. Variables evaluadas
Los variables se tomaron a los 30 días, a los 60 días y los 90 días después de la siembra de los esquejes, en cada una de las fechas se tomó una muestra aleatoria de 10 esquejes por tratamiento, dando un total de 60 esquejes a los 30, 60 y 90 días. Las variables evaluadas fueron:
Longitud de la raíz (LR): Se realizaron mediciones con una regla para determinar la longitud (cm) de cada raíz emitida a los 30, 60 y 90 días después de la siembra de los esquejes.
Grosor de la raíz (GR): Se realizaron mediciones con un vernier para determinar el grosor (mm) de cada raíz emitida a los 30, 60 y 90 días después de la siembra de los esquejes.
Número de raíces por esqueje (NRE): Se contó el número de raíces por cada esqueje a los 30, 60 y 90 días después de la siembra.
Número de raíces secundarias (NRS): Se contó el número de raíces secundarias por cada una de las raíces por cada esqueje a los 30, 60 y 90 días después de la siembra.
Número de rebrotes (NR): Se enumeraron los rebrotes por cada esqueje a los 30, 60 y 90 días después de la siembra.
Peso fresco de raíz por esquejes (PF): Se midió el peso de las raíces de cinco esquejes de manera individual en una balanza analítica a los 30, 60 y 90 días después de la siembra.
Peso seco de raíz por esqueje (PS): Las raíces se depositaron en un horno a una temperatura de 65 oC durante 48 horas para obtener el resultado del peso seco por cada planta de manera individual.
Porcentaje de biomasa de raíz (%BR): Para determinar la biomasa de la raíz se tomó en cuenta el porcentaje de humedad. Para ello se utilizó el peso fresco y el peso seco de las raíces, una vez calculado el porcentaje de humedad se procedió a determinar la biomasa multiplicando el peso fresco de las raíces por el porcentaje de humedad. Mediante las fórmulas matemáticas (ecuaciones (1) y (2)) descritas por Ávila Guevara (2016):
donde:
donde:
Porcentaje de sobrevivencia (%S): Se evaluó después de la primera semana del establecimiento en bolsas de vivero. La variable fue evaluada para cada uno de los tratamientos utilizando el conteo de esquejes vivos y muertos, durante el ensayo se tomó como referencia para el cálculo la ecuación (3) y categoría de sobrevivencia (Tabla 2), propuesta por Saavedra Miranda y Gutiérrez Gonzáles (2014).
donde:
2.5. Análisis de datos
Los datos fueron organizados en una hoja de cálculo de Microsoft Excel 2013®. Posteriormente, las variables longitud de raíz, grosor de la raíz, número de raíces por esquejes, número de raíces secundarias, peso fresco de raíz por esqueje, peso seco de raíz por esqueje, y porcentaje de biomasa fueron analizados a través de un análisis de varianza (ANDEVA) como un diseño completamente al azar (DCA) con estructura factorial de 6 x 100 (6 tratamientos x 100 unidades experimentales), para lo cual se utilizó el modelo de la ecuación (4).
donde:
Yij: representa la i-ésima unidad experimental y j-ésimo tratamiento
Μ: representa la media general
Ti: es el efecto del i-ésimo tratamiento
Εij: representa el error experimental.
Las separaciones de media se realizaron mediante Tukey (Quinn y Keough, 2002). A la variable porcentaje de sobrevivencia se le realizo análisis descriptivo.
3. Resultados y Discusión
3.1. Efecto de enraizadores sobre variables de crecimiento vegetativo en H. rosa sinensis a los 30 días
El análisis de varianza para las variables de crecimiento vegetativo para número de raíces secundarias (NRS), longitud de raíces (LRS) y peso fresco (PF) a los 30 días de la siembra de esquejes mostró diferencias estadísticas significativas entre tratamientos (p = 0,0014, p = 0,0052 y p = 0,0435), respectivamente, y la prueba de separación de medias de Tukey (α = 0,05) indicó que el tratamiento con aloe vera más melaza más huevo (A+M+H) presentó las medias con mayores valores, en NRS (12,2), sin embargo, no mostró diferencia significativa con relación a canela, Moringa y el testigo absoluto.
El tratamiento aloe vera y Trichoderma sp mostró las medias con menores valores para la variable NRS. En relación con las LR el tratamiento A+M+H mostró valores de medias de 5,58 cm, pero no muy diferente de los tratamientos canela, testigo absoluto, Moringa y Trichoderma sp, el tratamiento aloe vera presentó LRS menores con 1,44 cm, no diferente al testigo absoluto, Moringa y Trichoderma sp. (Tabla 3).
Tabla 3 Efecto de soluciones enraizadores sobre H. rosa sinensis a los 30 días después de la siembra de esquejes. / Effect of rooting solutions on H. rosa sinensis 30 days after planting cuttings.
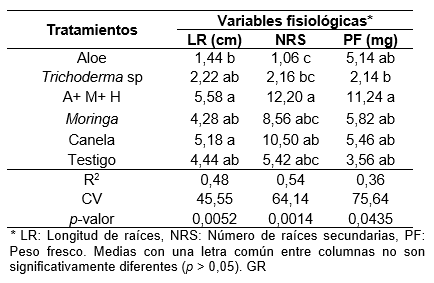
El tratamiento A+M+H obtuvo los mayores valores de PF con 11,24 mg no significativamente diferente de los tratamientos Moringa, canela, aloe vera y el testigo; el tratamiento Trichoderma sp mostró los menores valores de PF con 2,14 mg, sin embargo, no fue significativamente diferente a los tratamientos Moringa, canela, aloe vera y el testigo absoluto.
3.2. Efecto de enraizadores sobre variables de crecimiento vegetativo en H. rosa sinensis a los 60 días
Las variables GR, LR, NRS, PF, PS y %BR a los 60 días de la siembra de los esquejes mostró diferencias estadísticas significativas entre tratamientos (p = 0,0007, p = 0,0005, p = 0,0001, p = 0,0044, p = 0,0002 y p = 0,0002, respectivamente), y la prueba de separación de medias de Tukey (α = 0,05) indicó que el tratamiento Trichoderma sp presentó las medias con mayor valor, en GR (1,58), sin embargo, no mostro diferencia significativa con relación a A+M+H, Moringa, canela y testigo absoluto. El tratamiento aloe mostró las medias con menos valor para la variable de GR. El tratamiento de Trichoderma sp presentó la media con mayor valor en el caso de LR (10,52), sin embargo, no mostró diferencia significativa en relación con el testigo. El tratamiento con aloe mostró las medias con menos valor para la variable de LR.
El tratamiento testigo presentó las medias con mayor valor en NRS (34,0 cm), sin embargo, no mostró diferencias significativas en relación con Trichoderma sp. El tratamiento aloe mostró las medias con menor valor para la variable de NRS, sin embargo, no tiene diferencias significativas con A+M+H, Moringa y canela. El tratamiento de Trichoderma sp presentó las medias con mayor valor en PF (137,02 mg), sin embargo, no mostró diferencias significativas en relación con A+M+H, Moringa, canela y el testigo. El tratamiento aloe mostró las medias con menor valor para la variable PF, sin embargo, no es muy diferente de A+M+H, Moringa y canela (Tabla 4).
Tabla 4 Efecto de soluciones enraizadoras sobre H. rosa sinensis a los 60 días después de la siembra de esquejes. / Effect of rooting solutions on H. rosa sinensis 60 days after planting cuttings.
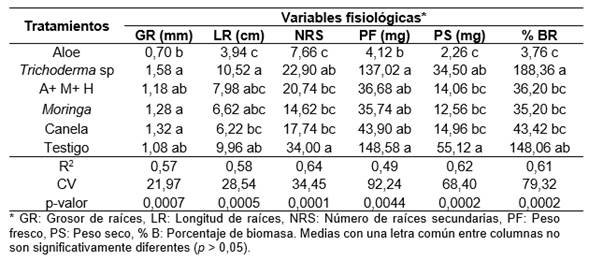
El tratamiento testigo presentó las medias con mayor valor, en PS (55,12 mg), sin embargo, no mostró diferencias significativas con relación al Trichoderma sp. El tratamiento aloe no mostró diferencias significativas para el PS (2,26 mg), sin embargo, no tiene diferencias significativas con A+M+H, Moringa y canela. El tratamiento de Trichoderma presentó las medias con mayor valor en %BR (188,86%), sin embargo, no mostró diferencias significativas con el testigo absoluto. El tratamiento aloe mostró las medias con menor valor para la variable %BR (3.76%), sin embargo, no tiene diferencias significativas con A+M+H, Moringa y canela (Tabla 4).
3.3. Efecto de enraizadores sobre variables de crecimiento vegetativo en H. rosa sinensis a los 90 días
Las variables PF, PS, %H y %BR a los 90 días de la siembra de los esquejes mostraron diferencias estadísticas significativas entre tratamientos (p = 0,0001, p = 0,0001, p = 0,0243, y p = 0,0001), respectivamente, y la prueba de separación de Tukey (α = 0,05) indicó que el tratamiento Moringa presentó las medias con mayores valores en PF (284,63 mg), sin embargo, no mostró diferencias significativas con relación a Trichoderma sp, A+ M+ H y testigo.
El tratamiento aloe mostró las medias con menor valor para PF. El tratamiento Moringa presentó las medias con mayor valor en PS (118,88 mg), sin embargo, no mostró diferencias significativas en relación con testigo, Moringa y Trichoderma sp. El tratamiento aloe mostró las medias con menor valor (44,53 mg) para la variable de PS, sin embargo, no es diferente al tratamiento canela (Tabla 5).
Tabla 5 Efecto de soluciones enraizadoras sobre H. rosa sinensis a los 90 días después de la siembra de esquejes. / Effect of rooting solutions on H. rosa sinensis 90 days after planting cuttings.
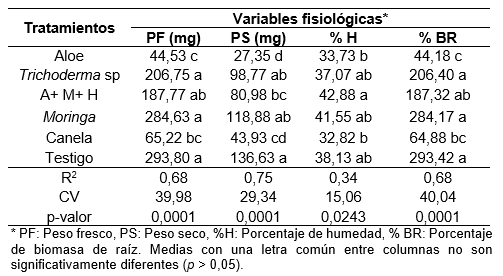
El tratamiento A+M+H presentó las medias con mayores valores en %H (42,88%), sin embargo, no mostró diferencias significativas en relación con Trichoderma sp, Moringa, aloe y testigo. El tratamiento canela mostró las medias con menor valor en %H no fue estadísticamente diferente de los tratamientos Trichoderma sp, Moringa, aloe y testigo. El tratamiento Moringa presentó las medias con mayor %BR (284,17%), sin embargo, no mostró diferencias significativas con relación a Trichoderma sp, A+ M+ H y testigo. El tratamiento aloe mostró las medias con menor valor en %BR (Tabla 5).
A partir de los resultados de este estudio se puede afirmar que el tratamiento con Trichoderma sp puede favorecer el desarrollo vegetativo de H. rosa-sinensis, seguido de los tratamientos Moringa, A+M+H y canela. Los factores que pudieron influir en los resultados de esta investigación son el crecimiento alométrico de las plantas, efecto de iluminación, agua y sustrato, sin embargo, se requiere realizar estos tipos de estudios para profundizar en los conocimientos sobre las variables evaluadas debido a que existe poca información y su uso se ha limitado como alimento forrajero y ornamental en Nicaragua.
Paz (2019), en su estudio morfológico de campo en Hibiscus, pudo identificar resistencias fisiológicas que presenta la especie para contrarrestar el estrés hídrico generado en épocas de sequía, acción que surge como mecanismo de reajuste foliar, para garantizar un equilibrio hídrico y de esta manera no afectar al resto del follaje.
Cuéllar y Arrieta Herrera (2010) demostraron que durante las fases de crecimiento de las plantas de H. rosa-sinensis es necesario una fase de vivero de 90 días, época en que la planta muestra un mejor acondicionamiento morfológico en altura y vigor. Los resultados para los pesos de raíz y brote mostraron que bajo condiciones de vivero, las plantas mantienen un equilibrio alométrico en la acumulación de peso hasta los 84 días (0,86±0,31 para raíz y 2,71±0,22 para el brote), presentándose diferencias estadísticas a partir de los 91 días, donde la acumulación de materia seca en el brote aumenta sustancialmente hasta 13,87 ± 0,21, además concluye que la especie H. rosa-sinensis necesariamente requiere una fase de vivero de hasta 98 o 105 días.
La productividad de biomasa de una comunidad de plantas puede estimarse como una función lineal de la cantidad de radiación interceptada por H. rosa-sinensis. En especies como H. rosa-sinensis la productividad es más dependiente de las variaciones en la cantidad de radiación solar incidente acumulada en cierto período.
Chowdhuri y Sadhukhan (2019) con enraizadores sintéticos mencionan que el ácido naftalenacético en concentraciones de 1.000 a 3.000 ppm pueden utilizarse para el enraizamiento de H. rosa sinensis, pero las dosis más altas son beneficiosas durante la temporada de lluvias en la zona subtropical, en este estudio el segundo mejor regulador de crecimiento fue el ácido indole-3-butírico a 3.000 ppm como enraizador.
3.4. Porcentaje de sobrevivencia de H. rosa sinensis en condiciones de vivero
A los 120 días después de la siembra de los quejes se encontró que los tratamientos con mayor %S fueron Moringa (97%), canela (96%), aloe (91%) y Trichoderma sp (90%), considerando estos resultados como excelentes. El tratamiento con menor %S fue el tratamiento A+M+H (89%) y testigo (88%), considerando estos resultados como buenos (Figura 1).
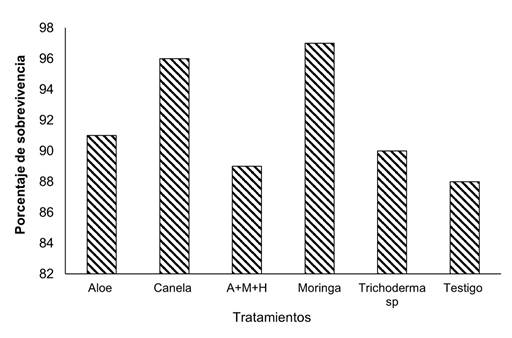
Figura 1 Porcentaje de sobrevivencia de H. rosa sinensis en vivero a los 120 días después de la siembra. / Survival percentage of H. rosa sinensis in the nursery 120 days after sowing.
Los sustratos deben aportar los elementos necesarios para el crecimiento: agua, aire y nutrientes. Actualmente, estos últimos pueden ser aportados de un modo preciso al cultivo por los abonos minerales, la disponibilidad de agua y de aire depende de las propiedades físicas y mecánicas del sustrato.
4. Conclusiones
El tratamiento con Trichoderma sp favorece el crecimiento vegetativo de H. rosa sinensis a los 60 días después de la siembra, seguido de los tratamientos Moringa, A+M+H y canela. Los tratamientos con mayor porcentaje de sobrevivencia fueron Moringa, canela, aloe y Trichoderma sp, considerados como excelentes, mientras que los tratamientos A+M+H y testigo fueron considerados buenos.