Introducción
La familia Asteraceae destaca por su diversidad, con alrededor de 24 000 especies alrededor del mundo, lo que la convierte en la familia de plantas más grande después de las orquídeas (Del Vitto y Petenatti, 2009). Se distribuyen en una amplia variedad de hábitats, desde los trópicos hasta las regiones templadas. En el Ecuador, se estima que esta familia vegetal representa aproximadamente el 10 % de la flora del país.
En términos ecológicos, las Asteraceae tienen un impacto significativo ya que son importantes fuentes de alimento para varios animales, incluyendo insectos, aves y mamíferos (Flann, Greuter e Hind, 2010). En cuanto a la composición química, las Asteraceaes son conocidas por su riqueza y variedad de metabolitos secundarios, incluyendo ácidos isoy clorogénicos, lactonas sesquiterpénicas, alcoholes triterpénicos pentacíclicos, aceites esenciales, alcaloides y diversos derivados acetilénicos. Estos compuestos son de gran interés médico debido a sus propiedades citotóxicas y anticancerígenas, entre otras (Figueroa, 2016).
Un miembro de esta familia de plantas es la especie Gynoxys cuicochesis Cuatrec. que presenta un tallo flexible y estriado con nudos finamente tomentoso. Sus hojas son opuestas, ovado-oblongas, con peciolos estriados y bordes ligeramente curvados. El haz es glabro y de color verde liso, excepto el nervio principal que es tomentuloso, mientras que el envés es densamente tomentoso-ocráceo y el nervio principal es prominente, rodeado de 10-11 nervios secundarios a cada lado (Robinson y Cuatrecasas, 1992). Las inflorescencias son terminales, cimoso-paniculadas y tomentosas, con brácteas lanceoladas, cortas y tomentosas. Los capítulos son heterogéneos, con un involucro cónico-campanulado compuesto de 7-8 brácteas escariosas y glabras. Las flores femeninas son marginales, con corola ligulada y las flores hermafroditas se agrupan en 8-9, con corola tubular y limbo campanulado profundamente dentado (León-Yánez y col., 2011). Estas características morfológicas proporcionan una base para la identificación precisa de la especie y son importantes para su descripción botánica. En la sierra ecuatoriana, este vegetal se conoce comúnmente como “piquiles” o “tunash”, y se emplea tanto como leña, como para proporcionar soporte estructural en la construcción de refugios temporales (Lojan, 1992).
Aunque esta especie no se utiliza en la medicina tradicional, esta planta es un excelente atractor de polinizadores debido a su inflorescencia en los primeros meses del año, lo que la convierte en una candidata interesante para el estudio fitoquímico. Hasta la fecha, no existen registros de estudios científicos sobre la composición química fija de esta especie vegetal. Por esta razón, el presente estudio se centró en el aislamiento de los metabolitos secundarios de la planta utilizando técnicas de cromatografía líquida por gravedad en microcolumna. La estructura de los metabolitos se elucidó mediante Resonancia Magnética Nuclear (RMN) y espectrometría de masa de ionización por electrospray (ESI). El objetivo de este trabajo es caracterizar químicamente a la especie Gynoxys cuicochesis Cuatrec. para contribuir a su descripción etnobotánica.
Materiales y Métodos
Información general de la muestra
Se llevó a cabo la recolección de 25 Kg de las partes aéreas (hojas) de la especie vegetal Gynoxys cuicochensis Cuatrec. en el sector Sebadal-Fierro Urco del barrio San Isidro, parroquia San Pablo de Tenta, cantón Saraguro, provincia de Loja, ubicado a una altitud de 2 990 metros sobre el nivel del mar (m.s.n.m). Las coordenadas exactas de la recolección fueron S 3◦40’47.4816 y O 79◦18’38.5056, bajo el permiso de recolección de especies vegetales MAEDNB-2016-0048 otorgado por el Ministerio del Medio Ambiente. Para su posterior procesamiento, se procedió a desecar la materia vegetal durante 10 días a una temperatura de 40◦C, utilizando el deshidratador ubicado en el laboratorio de Química de la Universidad Técnica Particular de Loja (UTPL). Como resultado, se obtuvieron 5 kg de materia vegetal seca lista para ser utilizada en la investigación.
Obtención del extracto vegetal
La muestra vegetal seca fue triturada manualmente y luego macerada en recipientes individuales que contenían 2 kg de muestra vegetal y 20 litros de una solución de etanol: agua (EtOH:H 2 O) en una proporción de 7:3, respectivamente. Se realizaron tres procesos de maceración estáticos, el primero, durante 3 días y los otros dos durante un día cada uno. Tras la filtración del extracto, se eliminó el etanol mediante el uso de un rotaevaporador. Luego, el extracto seco se liofilizó utilizando un liofilizador Labconco Corporation modelo 7754047. Las muestras de 100 ml se depositaron en frascos Boeco®y el proceso experimental duró 5 días para cada muestra.
Para la separación de la clorofila, se utilizaron dos embudos de decantación de 500 ml y 1000 ml. En el embudo de 1000 ml se empaquetaron 400 g de resina Diaion®HP-20 en una solución de EtOH:H 2 O en un gradiente de 6:4, y se sembraron 50 g de extracto diluido en la solución EtOH:H 2 O mencionada anteriormente. El mismo procedimiento se aplicó en el embudo de 500 ml, pero con 240 g de resina Diaion®HP-20 y 35 g de extracto. Para obtener el extracto libre de solvente (EtOH), se usó el rotavapor marca BUCHI R-220 Pro con las siguientes condiciones: la temperatura de refrigeración de -10◦C, una rotación de 40 rpm, el agua del baño maría de 30◦C, vapor de 27◦C de temperatura respectivamente y la presión de vacío que comenzó en 120 mbar y aumentó gradualmente hasta 30 mbar.
Finalmente, para facilitar el uso del extracto desclorofilado, se liofilizó utilizando el equipo Labconco Corporation modelo 7754047. La muestra se depositó en un frasco Boeco®de 100 ml con un volumen de 400 ml y el proceso de liofilización se llevó a cabo durante 5 días.
Fraccionamiento preparativo y purificación de metabolitos
Se llevó a cabo la preparación de un extracto libre de azúcares a partir de una solución Butanol:Agua (ButOH:H 2 O) de 1000 ml, dividiendo la solución en partes iguales y agitándolas constantemente durante media hora para lograr una homogeneización completa. Después de una hora de reposo, se eliminó el agua y se diluyeron 15 gramos de extracto liofilizado en 700 ml de solución butanólica, agregando el mismo volumen de agua destilada, y se dejó en reposo por una hora para permitir la separación de compuestos de acuerdo con su polaridad. Este proceso se repitió dos veces más para obtener la fase orgánica.
La fase orgánica se sometió a una cromatografía líquida en microcolumna mediante gravedad, utilizando una polaridad de Acetato, Metanol y agua (AcOEt, MeOH y H 2 O) en una relación de 8:1:1, con una carga de 800 mg de extracto de fase orgánica y 3 gramos de sílica gel fase directa. Las fracciones recolectadas se sometieron a una técnica de cromatografía en columna de flujo continuo (CCF), utilizando Diclorometano (DCM) como disolvente, y aplicando una polaridad de DCM, AcOEt, MeOH en una relación de 6:2:2, 5:3:2 y 4:5:1, respectivamente, con la adición de 5 gotas de ácido acético (AcOH) en cada concentración. La cromatografía en capa fina preparativa se realizó en placas de sílica gel fase directa de 20cm x 20cm, utilizando la misma solución de DCM, AcOEt, MeOH en una relación de 6:2:2 y 5 gotas de AcOH.
El proceso de elución se llevó a cabo en una cámara de vidrio y con la ayuda de la luz UV de 254 nm se identificaron los compuestos objeto de separación. La sílica gel impregnada con los compuestos de interés se lavó con la solución (DCM, AcOEt, MeOH 6:2:2 y 5 gotas de AcOH) la cual fue eluida en la CCF, y se colocó en viales de 10 ml para su secado utilizando nitrógeno.
Caracterización de metabolitos secundarios
Las muestras que contenían los metabolitos separados fueron llevadas al equipo de RMN marca BRUKER de serie MSC 500 MHz para realizar los análisis necesarios y obtener espectros de 1H, 13C, DEPT, COSY, HMBC, HSQC y TOCSY. El equipo operó a una frecuencia de 500 MHz y se utilizó cloroformo deuterado (CDCl 3) como disolvente. Adicionalmente, se realizó un experimento ESI mediante inyección directa en un equipo marca Bruker amaZon speed, utilizando nitrógeno durante el proceso.
Resultados y Discusión
Estudios anteriores en varias especies del género Gynoxys, como Gynoxys Sancto-antonii Cuatrec, Gynoxys psilophylla Klatt. (Bohlmann y col., 1986), Gynoxys dielsiana Domke (Zdero y col., 1980), Gynoxys acostae Cuatr., Gynoxys nitida Mushcl. y Gynoxys buxifolia Cass. (Keriko y col., 1995), han permitido el aislamiento de varios 3β, 6β 10β-H diaciloxi furanoeremofilanos y 1β, 6β 10β-H diaciloxi furanoeremofilanos, principalmente modificados con sustituyentes tigloiloxi, angeloiloxi, acetiloxi y senecioiloxi, los cuales se han propuesto como posibles marcadores quimiotaxonómicos del género. Sin embargo, un estudio sobre Gynoxys oleifolia Muschl. informa sobre la existencia de diterpenos ent-kaurenoides sustituidos, lo que ha generado un debate sobre la presencia de este metabolito en el género Gynoxys (Beltrán y col., 2006).
Cabe destacar que, como componentes minoritarios se han aislado los compuestos 6-acetil-2,2dimetil-croman-4-ona en Gynoxys psilophylla Klatt (Bohlmann y col., 1986), Germacreno D, biciclogermacreno, espatulenol, ácido oleanólico en Gynoxys nítida Muschl. y piceol en Gynoxys buxifolia (HBK) Cass (Keriko y col., 1995), Betulin en Gynoxys cf. pulchella (Kunth) Cass (Rodriguez, 2016). Después de realizar varias pruebas de análisis fitoquímicos en fracciones etanólicas de Gynoxys hirsuta Wedd. se ha sugerido la existencia de alcaloides pirrolizidínicos, furanoeremofilanos y cumarinas (Ramírez, 2011).
Así mismo, pruebas efectuadas en la fracción volátil de las hojas de Gynoxys meridiana Cuatrec. obtenido con hidrodestilación muestra como compuestos principales γ-curcumeno (31,9 %), fukinanólido (22,3 %), β-pineno (9.5 %), α-felandreno (7,1 %) y α-pineno (5,7 %). El estudio más reciente sobre la composición química del aceite esencial de Gynoxys miniphylla Cuatrec reporta que sus componentes mayoritarios son α-felandreno (∼ 17 %), α-pineno (∼ 15 %), germacreno D (∼ 13, 5 %), acetato de trans mirtanol (8.8 %), δ-cadineno (∼4,5 %), β-felandreno (∼3,5 %), (E)-β-cariofileno (∼2,5 %), ocimeno (2,4 %), α-cadinol (∼2,5 %) y α-humuleno (∼2 %) (Malagón y col., 2022).
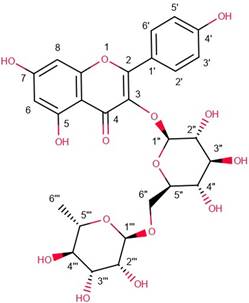
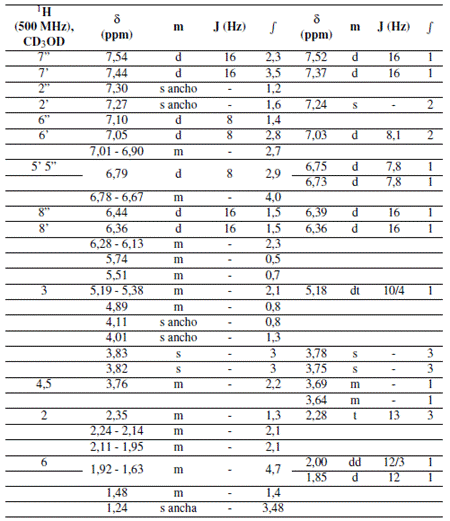
En esta investigación para la primera fracción identificada en el análisis del protón (Tabla 1) se detectó un doblete en 6,47 ppm y en 6,73 ppm correspondientes a H-6 y H-8 respectivamente. Ambas señales presentaron una constante de acoplamiento meta J6,8= 2 Hz. Asimismo, se identificó un doblete a 7,80 ppm que integra para 2H, relacionado con las posiciones equivalentes a H-2’ y H-6’. Desplazado a campos más altos por la influencia de un grupo hidroxilo, se encuentra un doblete 6,94 ppm que integra para 2H, correspondiente a los protones equivalentes H-3’ y H-5’, estos poseen una constante de acoplamiento orto J2’,3’= 8,8 Hz. Además, se observa un singlete en 5,56 ppm correspondiente a la posición 1” anomérica de la glucosa y un doblete en 5,38 ppm relacionado a la posición 1”’ anomérica de la ramnosa lo que sugiere la presencia del disacárido rutinosa.
La combinación de datos obtenidos a partir del análisis de protón y la espectrometría de masas por ESI brinda información relevante sobre la molécula en cuestión. El análisis de ESI muestra un ion molecular [M + H]+=595,13 indicativo de la presencia de nicotiflorina, químicamente conocido como Kaempferol-3-O-rutinósido.
La nicotiflorina (Figura 1) es un flavonoide compuesto por una molécula de glucosa y una de rutinosa. La glucosa es un monosacárido con fórmula química C 6 H 12 O 6, mientras que la rutinosa es un flavonoide compuesto por una estructura de flavona unida a una molécula de ácido glucurónico. Además, la nicotiflorina posee un grupo nicotinil unido a la posición C-6 de la glucosa, lo que la diferenciade otros flavonoides. La estructura química de la nicotiflorina es compleja y cuenta con varios grupos funcionales, como hidroxilos, cetonas y éteres.
Los flavonoides glicosilados, también conocidos como glucósidos de flavonoides, se encuentran ampliamente distribuidos en las especies vegetales y son conocidos por sus diversos efectos farmacológicos. La mayoría de estos compuestos contienen glucosa como el azúcar presente, aunque también se han encontrado galactosa, ramnosa, xilosa y el disacárido rutinosa. En las plantas, los glucósidos de flavonol y las agliconas cumplen una variedad de funciones importantes, como la protección contra la radiación UV, la regulación fisiológica interna y la reproducción. También actúan como antioxidantes, atrapando los radicales libres y apoyando el sistema inmunológico de la planta (Slámová, Kapešová y Valentová, 2018).
Abordando la farmacodinamia, se conoce que la glicosilación de los flavonoides mejora significativamente su solubilidad en agua y, por lo tanto, aumenta la biodisponibilidad de la correspondiente aglicona flavonoide, en función de la naturaleza del azúcar. Es importante destacar que los glucósidos se absorben más rápidamente que los ramnósidos y ramnoglucósidos debido a la disponibilidad de las respectivas enzimas hidrolizantes en el tracto gastrointestinal humano. Estas enzimas, como la lactasa-florizina hidrolasa intestinal o la βglucosidasa presente en las células epiteliales del intestino delgado, pueden metabolizar los glucósidos. En cambio, no existen enzimas α-l-ramnosidasa o rutinosidasa en humanos, lo que significa que la biodisponibilidad de los flavonoides que contienen ramnosa depende enteramente de su escisión por la microbiota intestinal (Slámová, Kapešová y Valentová, 2018; Khodzhaieva y col., 2021).
La adición de ramnosa a los flavonoides puede mejorar su solubilidad y estabilidad, además de conferirle propiedades farmacológicas específicas y selectividad. El azúcar utilizado en la glicosilación suele ser un disacárido compuesto por L-ramnosa (también conocida como 6-deoxi-manosa) y D-glucosa, los cuales están unidos por una unión glicosídica α-(1-2) o α-(1-6). Mientras que la glucosilación o galactosilación aumenta la solubilidad del flavonoide en agua, la presencia de residuos de ramnosilo puede disminuirla ligeramente. Es decir, la presencia de un residuo azúcar en un flavonoide parece jugar un papel importante en la solubilidad, biodisponibilidad y actividad biológica. De manera que, por ejemplo, los glucósidos de flavonoides pueden servir como “profármacos” para liberar las agliconas al tracto gastrointestinal (Slámová, Kapešová y Valentová, 2018).
El kaempferol es un flavonoide que se encuentra comúnmente en la familia Asterácea, y se ha demostrado que tiene efectos anticancerígenos y antiinflamatorios. Además, se ha descubierto que el kaempferol y sus compuestos asociados también tienen actividades antibacterianas, antifúngicas y antiprotozoarias (Adebayo y col., 2010). Recientemente, se ha informado que el kaempferol tiene una acción neuroprotectora en el cerebro, inhibiendo la citotoxicidad proinflamatoria y la actividad de importantes vías inflamatorias (Silva y col., 2021). Se sabe que la inflamación crónica y los radicales libres son factores de riesgo para desarrollar cáncer. Por lo tanto, los principios activos capaces de inhibir estos factores son útiles para generar citotoxicidad de células cancerosas. La actividad anticancerígena observada en algunos derivados del kaempferol resulta de especial interés, por lo que las especies vegetales que lo contienen son candidatas ideales para la búsqueda de tratamientos contra diferentes tipos de cáncer.
Existen numerosos derivados del kaempferol que han demostrado actividad anticancerígena. Un ejemplo es el trifolín (kaempferol 3-O-Dgalactósido), el cual induce la apoptosis en células de cáncer de pulmón a través de vías intrínsecas y extrínsecas (Kim y col., 2016). El azfelín (kaempferol-3-O-rhamnoside) se ha sugerido como una terapia quimioterapéutica para el cáncer de mama debido a sus propiedades antioxidantes y su capacidad para prevenir el daño oxidativo de biomoléculas (Vellosa y col., 2015). Por su parte, la nicotiflorina (kaempferol-3-O-rutinosido) ha demostrado ser hepatoprotectora, reduciendo los niveles de citoquinas y enzimas séricas y restaurando los indicadores antioxidantes en el homogeneizado hepático (Zhao y col., 2017).
Además, Li y col. (2006) han demostrado que la nicotiflorina reduce significativamente el daño neuronal y la muerte celular en modelos de isquemia cerebral focal permanente y en cultivos neuronales sometidos a estrés oxidativo. También disminuye la producción de especies reactivas de oxígeno (ROS) y la activación de factores inflamatorios en estos mismos modelos, sugiriendo una acción neuroprotectora del kaempferol. Por lo tanto, los derivados del kaempferol tienen un gran potencial como terapias contra el cáncer y enfermedades neurodegenerativas.
Según Patel (2022), la nicotiflorina posee propiedades farmacológicas tales como antioxidantes, antiinflamatorias, cardioprotectoras y antidiabéticas. Esta sustancia ha sido utilizada tradicionalmente en la medicina china para tratar diversas afecciones, incluyendo trastornos gastrointestinales, infecciones respiratorias y enfermedades cardiovasculares. Hasta el momento, no se han reportado en la literatura la presencia de flavonoides glicosidados en especies del género Gynoxys. Por lo tanto, el aislamiento de nicotiflorina en Gynoxys cuicochensis Cuatrec. es una valiosa contribución a la información quimiotaxonómica disponible. Para la segunda fracción, se ha propuesto una elucidación estructural que sugiere la presencia de un derivado del ácido quínico conocido como ácido 1,3-di-O-trans-feruloilquinico.
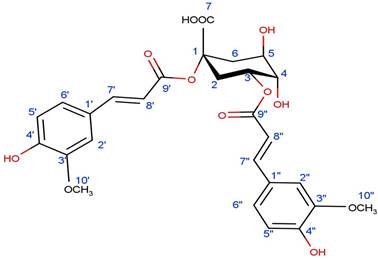
El análisis de RMN revela características distintivas en las señales de protones (Tabla 2). En primer lugar se observa una contribución aromática evidente debido a las señales correspondientes a las posiciones H2 (7,07 ppm, d, J=8Hz, 2H), H5 (6,82 ppm, d, J=8Hz, 2H) y H6 (7,18 ppm, d, J=6Hz, 2H), lo cual indica la presencia de un sistema trisustituido. Además, se destacan dos señales de H7 (7,64 ppm, d, J=16Hz, 2H) y H8 (6,40 ppm, d, J=16Hz, 2H), las cuales sugieren la existencia de un doble enlace en configuración trans. Es importante mencionar que también se evidencia la presencia de grupos metoxi en la estructura aromática debido a las señales de OCH3 (3,88 ppm, s, 6H).
El ácido 1,3-di-O-trans-feruloilquinico (Figura 2) es un éster derivado del ácido dihidroxicinamoilquínico, caracterizado por la presencia de dos grupos feruloilo unidos a las posiciones 1 y 3 de la unidad quinona en el anillo central. En concordancia con esta investigación, Wenzl y col. (2000) también informaron el uso de una conformación de silla con el grupo carboxílico en una posición axial en esta molécula, debido a las interacciones estéricas entre los grupos funcionales en su estructura.
La posición axial del grupo carboxílico se atribuye a la necesidad de minimizar dichas interacciones estéricas entre los grupos funcionales presentes. En este sentido, el grupo hidroxilo en la posición 5 y los grupos feruloilo en las posiciones 1 y 3 se orientan en dirección opuesta al grupo carboxilo, lo que conduce a la minimización de las interacciones estéricas.
Además, es importante destacar que la conformación de silla resulta estable para moléculas con anillos de seis miembros, como el anillo central del ácido 1,3-di-O-trans-feruloilquinico. En esta conformación, los grupos sustituyentes en los átomos de carbono del anillo se encuentran orientados en direcciones opuestas, lo cual contribuye a la minimización de las interacciones estéricas y, por ende, aumenta la estabilidad global de la molécula.
Se ha observado que este metabolito se acumula en las regiones más maduras del sistema radicular, excluyendo tanto los ápices de las raíces como los brotes. Se ha atribuido a este metabolito una actividad antioxidante reguladora de lípidos en la sangre de ratas. Además, estudios in vitro han demostrado su actividad antiinflamatoria, lo que sugiere su potencial como agente terapéutico en enfermedades inflamatorias. Se han descrito diversas actividades biológicas adicionales para este compuesto, como propiedades antimicrobianas, antitumorales, antidiabéticas y neuroprotectoras (Wenzl y col., 2000).
Dado que la información bibliográfica disponible sobre este metabolito es limitada y no permite realizar una comparación exhaustiva entre fuentes, se ha considerado también la actividad biológica descrita para su precursor, el ácido quínico, como punto de referencia.
El ácido quínico es un ácido hidroxicarboxílico natural con un compuesto fenólico de estructura química simple. Consiste en un anillo de seis carbonos con dos grupos hidroxilo y un grupo carboxilo. En las plantas, desempeña varias funciones importantes, que incluyen la regulación del crecimiento y desarrollo, la protección contra el estrés ambiental y la defensa contra patógenos. Además, el ácido quínico participa en la síntesis de otros compuestos fenólicos, como los flavonoides. Se ha demostrado que este ácido induce la producción de fitoalexinas, que son compuestos antimicrobianos producidos por las plantas en respuesta a la infección por patógenos (Ma y Ma, 2015).
Aunque la relación directa entre el metabolito en cuestión y el ácido quínico aún requiere una investigación más detallada, la actividad biológica conocida del ácido quínico proporciona una base sólida para explorar el potencial terapéutico y las propiedades biológicas de este metabolito poco estudiado. Un enfoque comparativo con el ácido quínico puede ayudar a obtener una comprensión más profunda de su actividad biológica y sus posibles aplicaciones.
El ácido quínico ha sido ampliamente investigado debido a su notable actividad biológica, que abarca diversas áreas de interés. Se han evidenciado propiedades antioxidantes, antiinflamatorias, antihipertensivas, antidiabéticas y neuroprotectoras asociadas a este compuesto (Pero, Lund y Leanderson, 2009; El-Askary, Salem y Abdel Motaal, 2022). Además, se ha demostrado su capacidad para ejercer efectos beneficiosos en la salud cardiovascular, el metabolismo de la glucosa, la obesidad y el daño celular.
Los estudios han revelado que el ácido quínico puede regular la expresión génica, modificar la actividad enzimática y modular las vías de señalización celular. Estas acciones moldean su impacto biológico en diversas enfermedades y condiciones patológicas. Su capacidad antioxidante le permite neutralizar especies reactivas de oxígeno, protegiendo así a las células del daño oxidativo. Asimismo, su actividad antiinflamatoria ayuda a reducir la respuesta inflamatoria excesiva en diferentes tejidos y sistemas biológicos (Heikkilä y col., 2019).
El ácido quínico también ha mostrado efectos positivos en la regulación de la presión arterial, lo que lo convierte en un posible agente para el manejo de la hipertensión. Además, se ha observado su capacidad para mejorar el metabolismo de la glucosa, lo cual es de especial interés en el contexto de la diabetes y la resistencia a la insulina (Singh y col., 2021; Lee y col., 2022). En cuanto a su acción neuroprotectora, el ácido quínico ha demostrado capacidad para proteger las células nerviosas contra el estrés oxidativo y otros eventos nocivos, lo que sugiere su potencial en la prevención y tratamiento de trastornos neurodegenerativos (Zuo, Tang y Xu, 2015; Clifford y col., 2017).
Conclusiones
Se obtuvo exitosamente el extracto alcohólico de Gynoxys cuicochensis Cuatrec. a partir de una muestra recolectada en el sector Sebadal-Fierro Urco de la provincia de Loja. Mediante el empleo de técnicas de cromatografía líquida en microcolumna, RMN y ESI, se logró el fraccionamiento y la caracterización química del extracto.
El tamizaje fitoquímico del extracto alcohólico de las hojas de Gynoxys cuicochensis Cuatrec. reveló la presencia de un compuesto flavonoide y un derivado del ácido quínico, ambos con propiedades farmacológicas conocidas. Sin embargo, es importante destacar que esta especie no es empleada en la medicina tradicional.
En el estudio fitoquímico experimental de Gynoxys cuicochensis Cuatrec., el análisis de los espectros de resonancia magnética nuclear de protones y carbono (1H y 13C), correlación heteronuclear múltiple (HMQC), correlación heteronuclear múltiplebanda cruzada (HMBC), distorsión de ensanchamiento selectivo por polarización de espín (DEPT), correlación espectroscópica (COSY) y correlación de espectroscopía de coherencia total (TOCSY) permitieron la identificación del primer metabolito como nicotiflorina (kaempferol-3-O-rutinósido). Es importante destacar que no se ha reportado previamente la presencia de este compuesto en el género vegetal Gynoxys, lo cual abre nuevas puertas para una investigación más profunda de esta especie y contribuir al avance científico en la región.
En cuanto al segundo metabolito aislado, el ácido 1,3-di-O-trans-feruloilquinico, la información científica disponible es limitada. Sin embargo, se puede proponer una posible actividad antioxidante y antiinflamatoria debido a su derivación del ácido quínico, ya que se sabe que los compuestos fenólicos suelen poseer estas propiedades. Para comprender plenamente las propiedades y el potencial terapéutico de este metabolito, es necesario realizar investigaciones adicionales y estudios más detallados. Estos resultados contribuyen al conocimiento científico de la región y sientan las bases para la exploración de nuevas aplicaciones farmacológicas y terapéuticas en el campo de la fitoterapia.