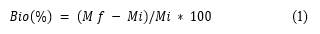Introducción
Los primeros envases del mercado se fabricaron con polímeros sintéticos de aceite procesado. Actualmente, existe una gran variedad de envases para diferentes fines, aunque su uso está destinado a preservar el producto durante el transporte, el almacenamiento y la protección contra golpes con el fin de lograr la viabilidad del uso del producto por parte del consumidor (Kubowicz y Booth, 2017; Santos y col., 2021).
El uso indiscriminado de plásticos con un tiempo de degradación prolongado, que puede alcanzar los 500 años, presenta graves problemas ambientales y de salud. Los polímeros plásticos sufren abrasión con el tiempo, formando microplásticos que son absorbidos en el proceso de alimentación de los animales marinos y el hombre (Sobral, Frias y Martins, ; Olivatto y col., 2018; Haider y col., 2019).
Muchos países han estado promoviendo el desarrollo de medios capaces de mitigar este escenario catastrófico provocado por el exceso de envases de plástico. Varios investigadores enfocados en la ecología y cambio ambiental han estado desarrollando nuevos polímeros biodegradables a partir de fuentes naturales renovables como el almidón, las grasas, el quitosano y la metilcelulosa (Brito y col., 2011). Según Cheviron, Gouanvé y Espuche (2014) y Farias y col. (2016), las fuentes renovables de polímeros son una alternativa para mantener el desarrollo sostenible de la tecnología, de tal forma que sea económica y ecológicamente atractiva. Los polímeros naturales tienen características biológicas, fisicoquímicas, mecánicas y morfológicas comparables a los polímeros sintéticos (Pitt, Boing y Barros, 2011; Akter y col., 2012).
Una rama de esta área de polímeros naturales se concentra en la incorporación de metales, nanocompuestos, extractos de plantas, aceites fijos y esenciales capaces de promover numerosas funciones activas e inteligentes a estos polímeros biodegradables. Varios estudios evalúan la biodegradabilidad estructural del polímero natural con materiales incorporados, comprobando su capacidad armónica para promover un producto resistente capaz de ser utilizado en diferentes procesos de la cadena productiva (Gómez-Estaca y col., 2010; Nor Adilah y col., 2018; Youssef y col., 2019).
Se han probado varios envases biodegradables con resultados positivos a partir del almidón de diferentes fuentes vegetales como el arrurruz. La Maranta arundinacea (arrurruz) pertenece a la familia de las Marantaceae, que cuenta con rizomas ricos en almidón (>85 %), y características específicas que son diferentes a otras fuentes de almidones naturales y que se utilizan con fines terapéuticos (Madineni y col., 2012). Varios estudios evalúan esta nueva fuente de almidón natural capaz de promover el desarrollo de películas biodegradables de alta calidad, además de proporcionar estabilidad de soporte de interacción, como por ejemplo con soluciones metálicas (Yin y col., 2009; Cruz y col., 2020; Nogueira, Fakhouri y Oliveira, 2018; Valadares y col., 2020).
Varios metales en forma de sulfatos, cloruros o nanocompuestos tienen características estructurales con una actividad potencial como agente antibacteriano. En sí mismo, el biopolímero de almidón de arrurruz no inhibe el desarrollo de bacterias por ser una fuente de hidratos de carbono, pero cuando se incorpora con metales que presentan esta acción las películas promueven una acción activa en la conservación del producto, tales como en los alimentos (Cruz y col., 2020; Shafiei Shafiei y col., 2021).
De esta forma, el objetivo de este estudio es producir películas biodegradables a partir de almidón de arrurruz mezclado con metales (sulfatos y cloruros), con el fin de verificar el impacto de estos metales en algunas características como el tiempo de biodegradabilidad, la transmisión de la radiación UV, la luz visible, y la aptitud como fuente antibacteriana.
Materiales y métodos
Producción de películas biodegradables mezclada con metales
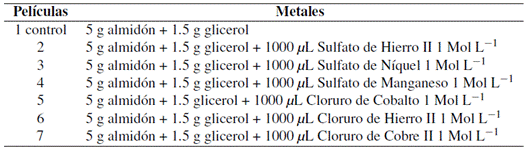
Las películas biodegradables mezcladas con metales se obtuvieron utilizando la técnica de Casting descrita y modificada por Issa, Ibrahim y Tahergorabi (2017). Para la producción de todas las películas se utilizaron 5 g de almidón de arrurruz comercial disuelto en 100 mL de agua destilada. A continuación, se agitó moderadamente la solución formadora de la película a una temperatura ambiente de 25◦C durante 5 min. Luego, la solución se calentó a 70 ◦C, con agitación mecánica constante durante 30 min. Tras la gelatinización del almidón, se añadió glicerol como plastificante al 30 % (p/p), y se volvió a agitar la emulsión durante otros 10 min. Cuando las emulsiones alcanzaron los 30◦C, se mezclaron con diferentes soluciones metálicas como se describe en la Tabla 1. Todas las soluciones se vertieron sobre placas de poliestireno y se secaron en una estufa de circulación de aire a 35◦C durante 48 h.
Determinación del tiempo de biodegradabilidad y de la transmisión de la luz
La biodegradabilidad se llevó a cabo mediante la metodología descrita por Martucci y Ruseckaite (2009), con modificaciones. Las muestras de películas (2 x 2 cm 2) se secaron hasta determinar el peso constante (Mi). A continuación, las muestras se colocaron en envases abiertos de polietileno para que los microorganismos y la humedad pudieran acceder al 40 %. Después, se enterraron en el suelo a humedad constante, temperatura ambiente, y luminosidad natural. Luego de tres, diez, quince y treinta días de instalado el experimento, el embalaje artificial con las muestras se retiró del suelo, se lavó con agua destilada y se secó hasta obtener un peso constante (Mf). El tiempo de biodegradabilidad se calculó usando la ecuación [1]. La transmisión de la luz ultravioleta-visible (UV-Vis) de las muestras se colocó en una cubeta de cuarzo y se midió la transmitancia a longitudes de onda que oscilaban entre 900-200 nm, de acuerdo con Santos y col. (2021).
Actividad antibacteriana
El ensayo antibacteriano se evaluó in vitro usando cuatro bacterias Escherichia coli (ATCC 25922), Staphylococcus aureus (ATCC 25923), Salmonella serovar Thyphimurium (ATCC 14028) y Salmonella serovar Enteritidis (ATCC 13076) adquiridas comercialmente y preservadas en el banco bacteriológico del primer autor. Brevemente, se cultivaron 150 µl de cultivo bacteriano 1×104 células mL−1 en placas de Petri con agar triptona dextrosa (DTA) y 150 µl de suspensión de esporas 1×108 UFC mL−1 en placas de Petri con agar recuento de plantas (PCA). A continuación, las láminas se colocaron (7 mm de diámetro) en la superficie del agar y se incubaron a 36◦C durante 36 h. Se midió el diámetro de la zona de inhibición con un calibre digital. Como control positivo, se utilizaron discos de azitromicina (disco de 15 µg) y cefalexina (disco de 30 µg) y como control negativo los discos de películas de almidón. El diámetro mínimo aceptable fue de 5 mm. El ensayo se realizó por triplicado según lo descrito por Valadares y col. (2020).
Resultados
Las películas biodegradables a partir de biopolímeros como el arrurruz mostraron una alta tasa de biodegradabilidad in vitro, como se observa en la Figura 1. Se observaron diferencias estadísticas en las películas mezcladas en comparación con el estándar, excepto en las películas mezcladas con sulfato de hierro II = 94 %, sulfato de manganeso = 94 %, cloruro de hierro II = 93 %, y cloruro de cobre II = 91 %.
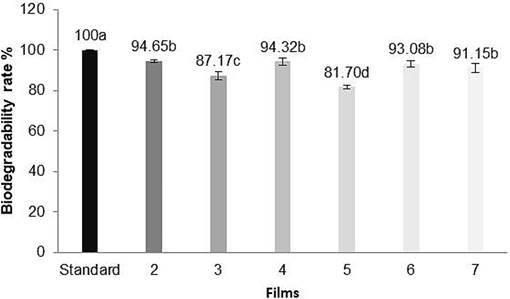
Figura 1 Tiempo de biodegradabilidad de las películas de almidón de arrurruz mezcladas con metales. 1. Estándar, 2. Sulfato de hierro II, 3. Sulfato de níquel, 4. Sulfato de manganeso, 5. Cloruro de cobalto, 6. Cloruro de hierro II, 7. Cloruro de cobre II. Letras iguales entre las medias de cada película biodegradable mezclada con metales no muestran una diferencia significativa usando la prueba de Tukey 5 %.
La Figura 2 muestra siete imágenes fotográficas de películas producidas con almidón de arrurruz mezclado con metales: (A) Película estándar, (B) Película de sulfato de hierro II, (C) Película de sulfato de níquel, (D) Película de sulfato de manganeso, (E) Película de cloruro de cobalto, (F) Película de cloruro de hierro II y (G) Cloruro de cobre II.
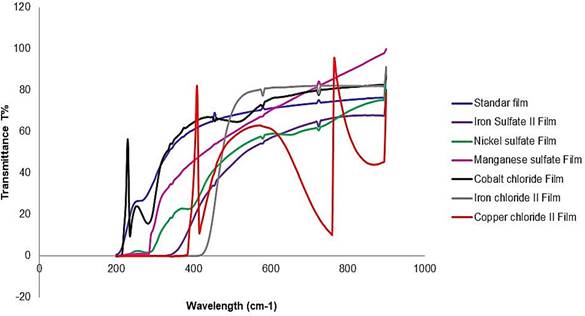
En cuanto a los colores de las películas, los resultados muestran una disminución de las tasas de transmisión de luz en las películas que mezclan diferentes metales en la región visible (de 250 a 890 nm). La máxima tasa de transmisión de luz para la película estándar fue de 69,36 T%, en la película de sulfato de hierro II fue de 68,22 T%, en la película de sulfato de níquel fue de 59,10 T%, en la película de sulfato de manganeso fue de 30,85 T%, en la película de cloruro de cobalto fue de 65,68 y 17,45 T%, en la película de cloruro de hierro II fue de 78,82 T% y en la película de cloruro de cobre II fue de 62,94 T% (Figura 3).
La actividad antibacteriana en todas las películas mezcladas con metales muestra una actividad inhibitoria potencial en comparación con los antibióticos de referencia Azitromicina y Cefalexina (Tabla 1). Se observó una diferencia estadística del 5 % en E. coli según la prueba de Tukey para todas las películas metálicas, excepto en la película de sulfato de níquel y cloruro de cobalto, ambas con un área de inhibición = 22 mm, y sulfato de manganeso = 10 mm, y cloruro de hierro II = 13 mm. En S. aureus se observó una diferencia del 5 % sólo para las películas de cloruro de cobalto = 25 mm, y el cloruro de hierro II = 13 mm de acuerdo con la prueba de Tukey. S. serovar Typhimurium mostró una diferencia estadística de 5 % según la prueba de Tukey en las películas metálicas mezcladas con sulfato de manganeso = 14 mm, y cloruro de cobalto = 22 mm. De igual forma, se observó una diferencia significativa en S. serovar Enteritidis según la prueba de Tukey al 5 % para las películas mezcladas con sulfato de manganeso = 8 mm, cloruro de hierro II = 15 mm, y cloruro de cobre II = 19 mm. Las películas de control no mostraron ninguna actividad inhibitoria en las cepas bacterianas evaluadas.

Figura 2 (A) Película estándar, (B) Película de sulfato de hierro II, (C) Película de sulfato de níquel, (D) Película de sulfato de manganeso, (E) Película de cloruro de cobalto, (F) Película de cloruro de hierro II y (G) Cloruro de cobre II.
Discusión
El uso de metales en una matriz polimérica biodegradable presenta resultados satisfactorios de biodegradabilidad y de aspectos morfológicos visuales y ultraestructurales tanto mecánicos como térmicos. El almidón presentó buena aptitud durante la incorporación de metales en forma de sulfatos y cloruros, de igual forma mostró plasticidad con el glicerol. Se observa una buena interacción entre los componentes de la matriz, promoviendo películas resistentes y una interacción intermolecular específica. Aunque se trata de un estudio pionero y diferente al observado (que incluye nanocompuestos metálicos), resulta necesario evaluar esta interacción en otros ensayos.
Los ensayos evaluados en este estudio demostraron que el almidón de arrurruz es un polímero biodegradable que se puede comparar con polímeros que han sido estudiados durante mucho tiempo. La biodegradabilidad es uno de los principales factores a la hora de elegir un biopolímero, debido a que a menor exposición en el medio ambiente, más atractivo será su fuente de producción. En este estudio, se observó que la mayoría de las películas de arrurruz mezcladas con metales tenían una alta tasa de biodegradación en el suelo (90 %).
Todos los metales, excepto el sulfato de níquel y el cloruro de cobalto, no interfirieron negativamente durante la actividad microbiana natural. Aunque el objetivo de este estudio no era evaluar el comportamiento del metal respecto a su toxicidad en la microbiota, el análisis organoléptico visual fue satisfactorio.
Por lo tanto, esta evaluación sirve para llevar a cabo futuros estudios y evaluar todos los metales, especialmente el Cobalto, en la bioacumulación de los organismos que viven en el suelo. Algunos metales forman parte del desarrollo de diversas formas de vida en el suelo, supliendo las necesidades a lo largo del proceso de desarrollo. Sin embargo, algunos metales tienen un grado de toxicidad en algunos grupos de microorganismos. Saral Sarojini, Indumathi y Rajarajeswari (2019) obtuvieron un tiempo variable durante la prueba de biodegradabilidad de películas a base de quitosano con nanopartículas de óxido de zinc (Zn-NP), aunque todas las películas tuvieron una buena tasa de degradabilidad de 28 días con una mediana máxima del 95 %.
La transmisión de los rayos ultravioleta y de la luz visible influye negativamente en los productos, especialmente en los alimentos y en las soluciones fotosensibles. La acción provocada por la luz visible y ultravioleta puede causar la oxidación de los lípidos en los alimentos con alto contenido de grasa, como la carne (Hosseini y col., 2015; Fathi, Almasi y Pirouzifard, 2018). Los envases biodegradables mezclados con metales tienen una baja tasa de transmisión o absorción de luz UV y visible, favoreciendo así el mantenimiento del producto a almacenar sin modificar sus características. Las películas incorporadas con metales presentadas en este estudio demostraron ser alternativas viables para el mantenimiento de diversos productos, observando el metal deseado y, por supuesto, su concentración para un uso determinado. Todas las películas incorporadas promovieron la baja transmisión de la luz UV y visible.
Varios estudios utilizaron biopolímeros mezclados con metales, como Pagno y col. (2015), quienes evaluaron la tasa de transmisión de la radiación UV en películas biodegradables de almidón de quinoa mezcladas con nanocompuestos (NPs) de oro (Au), y obtuvieron una alta tasa de absorción de la radiación.
Hasheninya et al. (2018) usaron carboximetilcelulosa con NPs de óxido de cobre (CuO). Las altas concentraciones de NPs de CuO dieron lugar a una disminución significativa de la transmisión de luz entre los rangos UV (200-400 nm) y visible (400-800 nm). De igual forma, Arfat y col. (2017) utilizaron gelatina de piel de pescado mezclada con NPs de Ag-Cu, donde a mayor concentración de NPs, menor es la tasa de transmisión de luz UV y visible. Las películas de sémola incorporadas con ZnO también mostraron una baja transmisión de luz UV y visible en el estudio de Jafarzadeh y col. (2017).
Los metales usados en la matriz de biopolímeros de arrurruz presentaron gran potencial en la capacidad de inhibición bacteriana en comparación con las bacterias grampositivas y gramnegativas, demostrando que son nuevas opciones para películas biodegradables activas con capacidad antimicrobiana. Muchos estudios con metales, sus cationes, aniones u óxidos incorporados en matrices poliméricas (fibras de gelatina/Ce3+) presentan una actividad de inhibición bacteriana para S. aureus y E. coli (Yin y col., 2009), preparadas a partir de TiO2 mezclado con CeO2, donde se observa el 95 % de inhibición en bacterias reductoras de sulfato (Wang y col., 2010).
Las películas de carboximetilcelulosa con zeolita modificada que utilizan partículas de plata (Ag+) y oro (Au+3) presentaron efectos potenciales bacteriostáticos (S. aureus y E. coli) y fungistáticos (Candida albicans y Aspergillus niger) en el estudio de Youssef y col. (2019). Cruz y col. (2020) encontraron en dos complejos de Cobalto I/II una elevada actividad de inhibición para E. coli de 22,66 y 20,66 mm, respectivamente. Estos resultados son similares a los observados en este estudio para la película biodegradable que contiene cloruro de Cobalto en E. coli.
Conclusiones
Este estudio propone el desarrollo de seis nuevos envases biodegradables (films) mezclados con diferentes metales en forma de sulfatos o cloruros, incidiendo directamente en la biodegradabilidad, la transmisión de rayos UV y luz visible, pues funciona como un agente antibacteriano eficaz a partir del biopolímero del almidón de arrurruz, el cual posee características que permiten la mezcla de materiales sin perder la capacidad de formar una película activa resistente.
Los resultados obtenidos demuestran que las películas de arrurruz mezcladas con metales resultaron ser excelentes opciones, apuntando a un sistema ecológico complejo que alinea la biodegradabilidad con las características físico-químicas en la disminución de la tasa de transmisión de los rayos UV o de la luz visible, y también microbiológicas con el uso activo de productos capaces de actuar bajo la acción antibacteriana y/o bacteriostática.
Finalmente, este trabajo permite llevar a cabo nuevos ensayos in vitro evaluando el biopolímero mezclado con metales, obteniendo una evaluación en términos citotóxicos de la flora microbiana del suelo para evaluar la posible bioacumulación de estos metales en diferentes tipos de tejidos, órganos o incluso la absorción de aquellos con efecto de desarrollo y biotransformación.