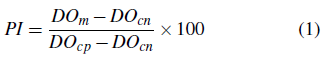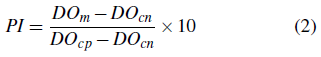Introducción
La brucelosis es una enfermedad bacteriana zoonótica causada por varias especies del género Brucella spp. que infecta animales domésticos y de vida silvestre (Ledwaba y col., 2019), afectando al sistema reproductivo, ocasionando abortos, crías débiles y produciendo pérdidas económicas debido al sacrificio de animales infectados y el impedimento para el comercio (Assenga y col., 2015). Los síntomas de brucelosis en humanos son fiebre, fatiga, artralgia, dolor muscular y sudoración en ocasiones produciendo estados de incapacidad física (Zheng y col., 2018).
Hasta la fecha se conocen 12 especies de las cuales B. abortus afecta a bovinos, B. mellitensis produce abortos en cabras, B. suis infecta a cerdos, B. canis es específica en caninos, B. ovis contagia a ovejas, B. neotomae se ha reportado en ratas (Suárez-Esquivel y col., 2017); dos especies B. pinnipedialis y B. ceti fueron aisladas en mamíferos marinos (Kroese y col., 2018); B. microti se ha identificado en una variedad de animales como topillos, jabalíes; B. papionis se ha descrito como hospedador a los babuinos, B. vulpis en zorros rojos; B. inopatia se ha aislado en humanos aunque no se ha identificado el reservorio animal (Leclercq, Cloeckaert y Zygmunt, 2020), la capacidad zoonótica se expresa con mayor fuerza en B. mellitensis, pero B.abortus también es responsable de la brucelosis en personas (Awah-Ndukum y col., 2018).
La transmisión a humanos ocurre por el consumo de leche, productos lácteos infectados, inhalación de partículas en aerosol y contacto directo con tejidos de animales enfermos (Dal y col., 2019). Las fuentes de infección para los animales incluyen materiales abortados, secreciones vaginales, leche, semen, consumo de agua, alimentos contaminados, y la infección en terneros puede darse a través del útero y por calostro (Ogugua y col., 2018). Una estrecha relación entre la fauna silvestre y el ganado brindarían oportunidades para la transmisión y la persistencia de la brucelosis en estas poblaciones (Godfroid y col., 2013). Algunos estudios sugieren que la bacteria puede circular entre varias especies silvestres susceptibles, manteniéndose así permanentemente en los ecosistemas (Aruho y col., 2021).
Las infecciones declaradas por la Organización Internacional de Epizootias (OIE) como enfermedades zoonóticas ameritan medidas de prevención, diagnóstico y control. Por tal motivo es necesario identificar factores de riesgo asociados a la patogénesis de la infección por Brucella spp. en los diferentes sistemas de manejo de las ganaderías responsables de la propagación de la enfermedad, permitiendo así una gestión eficaz para su manejo y control (OIE, 2018).
La brucelosis es una de las zoonosis de mayor importancia, altamente difundida en Latinoamérica. Argentina reporta una prevalencia de 19,7% a nivel de rebaños (Aznar y col., 2015); Uruguay 0,02% (Baruch y col., 2020); Colombia 22% (Cárdenas, Melo y Casal, 2018). Es difícil establecer datos oficiales de prevalencia en Ecuador por haber sido sub-notificada ante la OIE. Sin embargo, se han reportado estudios sobre la presencia de anticuerpos contra Brucella spp., que varían entre regiones, incluso dentro de ellas. Un estudio a nivel nacional en el año 1979 refiere una seroprevalencia en la región Sierra Norte de 1,97 a 10,62%, en región Costa 4,2 a 10,62% y en la región Sierra Sur de 1,3 a 2,6%. Otro estudio reporta una prevalencia del 6% (Salguero, 2011; Román-Cárdenas y Luna-Herrera, 2017). En los últimos años, algunos trabajos permiten actualizar el nivel de seroprevalencia de esta enfermedad, con una variabilidad significativa que va de 1,80-12% en todo el país (Zambrano, Pérez y Rodríguez, 2016).
Es necesario comprender la epidemiologia de la brucelosis en otras regiones del país donde no se realiza vigilancia serológica como requisito, previo a implementar programas de control y determinar las zonas de mayor prevalencia de la enfermedad. Existen varias pruebas para el diagnóstico en sangre o leche. Actualmente, las prescritas para el comercio internacional de ganado son: Rosa de Bengala (RBT), Aglutinación en placa tamponada (BPAT), ELISA-I (ELISA-indirecto), ELISAC (ELISA-competitivo), Fijación del complemento (CFT) y Fluorescencia polarizada (FP) (Vhoko y col., 2018).
Un paso inicial hacia la formulación de programas apropiados de control de la brucelosis a nivel local sería la georeferenciación del estado de infección de algunas zonas lecheras que permita cuantificar la enfermedad a nivel de fincas y generar evidencia epidemiológica de la endemicidad de la bacteria.
El objetivo principal de este estudio fue estimar la prevalencia de Brucelosis bovina en ganaderías de la provincia del Azuay, mediante la técnica de ELISA-I en muestras de leche. Igualmente, evaluar los factores asociados que pudieran predisponer a la aparición de la enfermedad, tales como: presencia de abortos, incremento de intervalos entre partos, nacimiento de crías débiles, asistencia veterinaria, ausencia de vacunación, tamaño del rebaño, entre otros, relacionados con la patogénesis y signos de la brucelosis (Akinseye y col., 2016; Mugizi y col., 2015).
Materiales y Métodos
Área de estudio
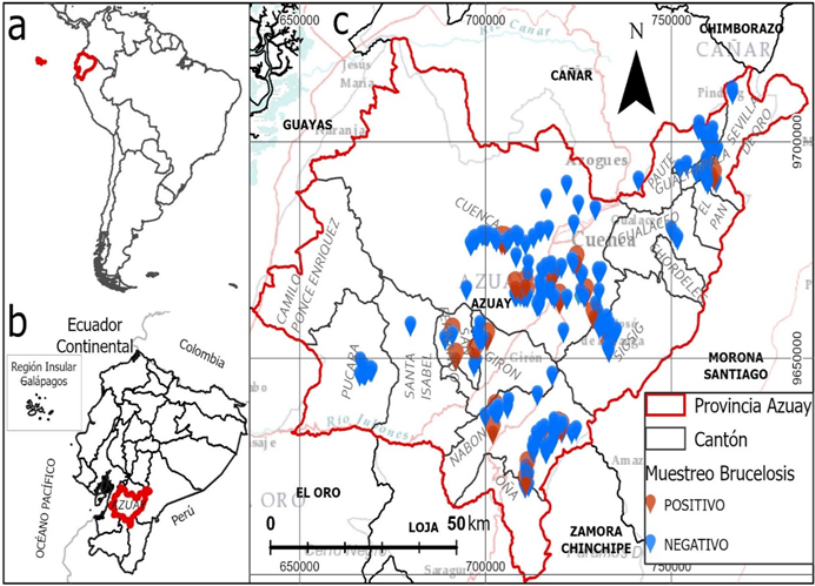
Esta investigación se realizó en los cantones Cuenca, Santa Isabel, Gualaceo, Paute, Sigsig, Sevilla de Oro, Girón, San Fernando, Pucará, Oña, Nabón, El Pan y Chordeleg, pertenecientes a la provincia del Azuay, ubicada en la región austral del Ecuador, con una extensión aproximada de 8.639 km 2. Existen dos zonas diferenciadas: el Este comprendido por los Andes orientales y el Oeste que constituye la región Costanera. El clima es variable debido a la altura, desde cálido hasta frío, por la presencia del macizo de los Andes y la vegetación subtropical. Al Occidente, la provincia se encuentra climatológicamente fragmentada en diversos sectores. Además, a causa de su ubicación, cada zona climática presenta sólo dos estaciones definidas: húmeda y seca. En el Occidente la temperatura oscila entre los 20°C y 33°C, mientras que en la zona andina, ésta suele estar entre los 10°C y 28°C (Cárdenas y Murillo, 2018).
Población en estudio
Consistió en unidades productivas agropecuarias (UPAS) dedicadas a la producción de leche sin importar el tamaño, las cuales, al momento del estudio incluían vacas en lactancia. La raza Holstein Friesen fue predominante (Instituto Nacional de Estadísticas y Censos, 2019). El tamaño de los rebaños varió desde 5 hasta 120 animales; el sistema de manejo abarcó un amplio rango, desde ganaderías extensas tecnificadas mayores a 50 has, medianas entre 5 a 50 has y fincas pequeñas con un manejo extensivo tradicional con poca tecnología, menores a 5 has. Para el propósito de esta investigación, las zonas de producción lechera se definieron por la mayor concentración de granjas que suministran esta materia prima (Ortega y col., 2017).
Diseño del estudio
Se realizó un estudio descriptivo de corte transversal comprendido entre los años 2019-2020. La unidad de análisis lo constituyen muestras de leche obtenidas en centros de acopio, vehículos de recolección y directamente en ganaderías. Para calcular el número de fincas a muestrear se usó el programa epidemiológico Win Epi (De Blas, Ruiz-Zarzuela y Vallejo, 2006). Se tomó como población total las 15 784 unidades de producción (UPAS), que constan en el programa de control y erradicación de Fiebre Aftosa en el Azuay (Agrocalidad, 2019), al no haber estudios previos en esta zona de la prevalencia de la brucelosis se partió de una prevalencia esperada del 50%, un error estimado del 5%, y un nivel de confianza de 95%. El programa arrojo una cifra de 376 fincas a muestrear, sin embargo, se tuvo acceso en total a 436 ganaderías.
Para determinar el número de UPAS a estudiar en cada cantón se utilizó un muestreo proporcional, la selección de las fincas se realizó de manera aleatoria, según la accesibilidad a la zona, distancia, tiempo para llegar a las ganaderías, disponibilidad de recursos, predisposición de los productores, centros de acopio y transportistas con mayor factibilidad de participar en esta investigación. Se realizó una encuesta georeferenciada a cada propietario utilizando el software Survey 123 ArcGis, instalados en dispositivos móviles. Ninguna de las ganaderías reportó contar con un programa de vacunación contra brucelosis.
Encuesta georeferenciada
Se realizó una encuesta georeferenciada cuyas preguntas se elaboraron para obtener información sobre la condición sanitaria de los animales, y el manejo de las fincas en base a literatura existente (Cárdenas y col., 2019) con el objetivo de determinar los posibles factores de riesgo de sufrir brucelosis tomando en cuenta: el manejo reproductivo, reemplazo de animales, procedencia de agua de bebida, presencia de animales domésticos susceptibles, sistema de explotación, conocimiento de la enfermedad, problemas reproductivos, presencia de abortos, manejo de desechos después del parto o abortos (Cárdenas y col., 2019). El consentimiento informado para la administración del cuestionario y la recolección de muestras se obtuvo verbalmente de los propietarios antes del muestreo y la entrevista.
Análisis de muestras de leche mediante ELISA indirecto
Las muestras fueron tomadas en envases estériles en una cantidad de 100 ml. Los envases fueron transportados refrigerados al Laboratorio de Microbiología de la Facultad de Ciencias Agropecuarias de la Universidad de Cuenca, donde fueron almacenados a -20°C. Para identificar la presencia de anticuerpos a Brucella spp. se usó el kit de ELISAI (Innovate Diagnostic, Francia), para ello previamente se centrifugaron las muestras de leche a 8 000 rpm durante 10 minutos para separar el lacto suero de la grasa. Se utilizó una placa con 96 pocillos impregnada con el LPS de Brucella abortus; se distribuyeron 100 μl de control negativo y control positivo por duplicado y posteriormente se agregaron 100 μl de las muestras en los pocillos restantes. Se selló la placa y se incubó a 21°C durante 45 minutos, posteriormente se enjuagó cada pocillo con 300 μl de solución de lavado por tres veces. Se agregaron 100 μl de conjugado (anti IgG de rumiante marcado con una peroxidasa), se incubó a 21°C durante 30 minutos, se repitió el proceso de lavado y posteriormente se adicionaron 100 μl de solución de revelado (tetrametilbencidina) a todos los pozos, se volvió a incubar la placa durante 15 minutos a una temperatura de 21°C y finalmente se añadieron 100 μl de solución de parada para detener la reacción.
Los valores de densidad óptica (DO) de las muestras (m) y controles se leyeron a 450 nm (longitud de onda), mediante un lector de placas ELISA (Biotek 800TS, USA). Se usaron controles positivos (cp) y controles negativos (cn) para validar la prueba. Se calculó el porcentaje de inhibición (PI) utilizando la Ecuación 1. Una muestra se consideró como positiva cuando su PI fue mayor a 50%.
Serología para identificación de animales seropositivos
Se tuvo acceso a 34 ganaderías para realizar las pruebas RBT y ELISA-C a todas las vacas que aportaron al pool de leche, para confirmar individualmente la presencia de animales seropositivos. Para ello se tomaron 9 ml de sangre de la región coccígea en tubos al vacío sin anticoagulante, los cuales fueron transportados al laboratorio a una temperatura de 8°C. Se realizó la centrifugación a 8 000 rpm (Dynac, Clay Adams, USA), durante 10 minutos, para extraer el suero sanguíneo a ser almacenado en tubos eppendorf y congelado a -20°C.
Rosa de Bengala
A los sueros extraídos de sangre periférica obtenida sin anticoagulante se les realizó la prueba RBT (Innovate Diagnostics, Francia), según el manual de la Organización Mundial de Sanidad Animal (OIE). Se utilizó una placa de vidrio cuadriculada, se mezclaron 40 ul del reactivo con la misma cantidad de suero a analizar, se agitó la lámina ligeramente durante 4 minutos. La aparición de aglutinación dentro de un minuto se puntuó como 4+ (++++), entre 1 y 4 min se puntuó 1+ a 3+ (+, + + y + + +) según los diferentes grados de aglutinación, la ausencia de aglutinación en 4 minutos se consideró negativa.
ELISA-C como prueba confirmatoria
Se utilizó el kit ELISA-C (Svanova, Suecia) para confirmar la presencia de animales seropositivos a Brucella spp. El ensayo se realizó adicionando 45 μl de solución de dilución en todos los pocillos para luego incorporar 5 μl de controles positivos, débiles y negativos por duplicado, así como 5 μl de solución de dilución como control de conjugado; posteriormente se añadieron 5 μl de las muestras. Seguidamente se agregaron 50 μl de la solución anticuerpos monoclonales de ratón (mAb) prediluidos, específicos de un epítopo común del O-polisacárido liso de molécula de LPS, tanto en los pocillos controles y muestras. Se selló la placa y se agitó durante 5 minutos, ulteriormente se incubó durante 30 minutos a 20°C. Culminada la incubación, se enjuagó la placa 4 veces con la solución PBS-Tween Buffer, inmediatamente se añadieron 100 μl en cada pocillo de solución de conjugado (anticuerpo de cabra contra IgG de ratón unido a peroxidasa de rábano picante, HRP) y se incubó a 20°C durante 30 minutos.
Se repitió el proceso de lavado y posterior a esto se agregaron 100 μl de sustrato (peroxidasa de hidrógeno y el cromógeno ABTS). Se incubó a 20°C durante 10 minutos y la reacción se detuvo adicionando 50 μl de la solución de parada (H2SO4) (Viveros, 2019). La microplaca se leyó a 450 nm con un espectrofotómetro (Biotek 800TS, USA), calculándose para cada muestra el porcentaje de inhibición (PI) de acuerdo a la Ecuación 2.
Donde DO m , DO cp , DO cn son las lecturas de las densidades ópticas para las muestras, el control positivo y el control negativo, respectivamente. Las muestras se clasificaron como positivas si los títulos de anticuerpos registraban un PI ≥ 30%, definido por el proveedor. Además, el hecho de que DO cp > 0;350 y DO cp =DO cn > 3, confirmó que la prueba funcionó correctamente.
Análisis estadístico
Los análisis se realizaron utilizando el software Infostat versión 2020 (Di Rienzo y col., 2020). Se calculó la frecuencia absoluta y relativa de fincas seropositivas a anticuerpos en muestras de leche contra la infección por Brucella spp. Se utilizó la prueba Chi-cuadrado para analizar si existía asociación entre cada uno de los factores de riesgo y la seropositividad, y se investigó la influencia de los factores mediante el modelo de regresión logística. Se realizaron cuadros de doble entrada para efectuar los cálculos de Odds Ratio a fin de estimar el riesgo relativo de que ocurra un evento. El intervalo de confianza fue 95% para el logaritmo de la razón de probabilidades como 1,96 errores estándar a ambos lados de la estimación, además del valor P en cada caso, el cual establece la significación estadística cuando P ≤ 0;05.
Resultados
Seroprevalencia de brucelosis bovina a nivel de fincas
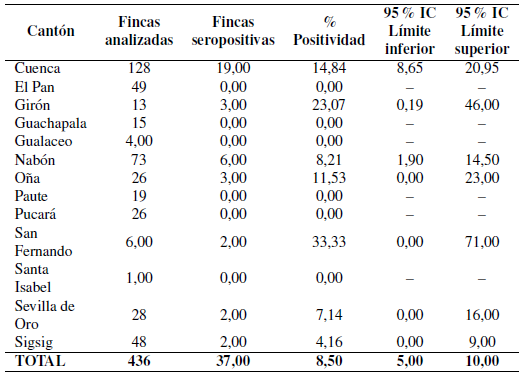
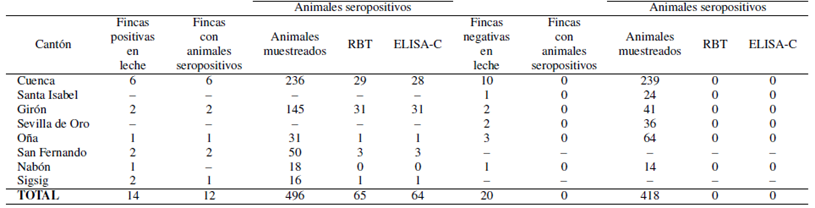
Se encontraron anticuerpos a Brucella spp. en 37 muestras de leche de un total de 436 fincas analiza das (Figura 1), arrojando una prevalencia del 8;5%. El porcentaje de seropositividad más bajo se presentó en el cantón Sigsig, con 4;16% y el más alto en San Fernando con 33;33%. No se encontró seropositividad en las muestras procedentes de los otros seis cantones, por lo que se registran sin valores los intervalos de confianza (-) (Tabla 1).
Confirmación de animales seropositivos en fincas positivas y negativas a ELISA-I en leche
Se realizó en 34 fincas las pruebas serológicas con RBT y ELISA -C a las vacas que aportaron al pool de leche para comprobar la presencia de animales seropositivos, coincidiendo en un 100% el diagnóstico negativo con ELISA-I en muestras de leche de 20 fincas al no detectar animales seropositivos, y en 14 ganaderías cuyas muestras de leche resultaron positivas, solo 12 de estas presentaron vacas con anticuerpos (Tabla 2).
Factores de riesgo para la presencia de la infección
La regresión logística reveló que los abortos, la ubicación geográfica, extensión de la finca, el sistema de explotación, la presencia de otras especies domésticas en la finca, problemas de celo, eliminación de restos placentarios, el nacimiento de terneros débiles y el sistema de reproducción se asociaron de manera significativa con la seropositividad a brucelosis (P < 0;05), siendo los rebaños que presentaron abortos los que mostraron mayores riesgos de contraer la enfermedad (OR = 2;71). Así también, las ganaderías cuyos animales presentaron problemas de repetición de celo tendrían mayor probabilidad de infectarse (OR = 2;09). El nacimiento de terneros débiles igualmente fue un factor asociado a una mayor predisposición (OR = 3;24).
La asociación con factores tales como la asistencia veterinaria, existencia de un área de parición, las fuentes de agua, animales de reemplazo, raza, y la presencia de retención placentaria no mostraron diferencia significativas (P < 0;05) (Tabla 3).
Discusión
La presencia de anticuerpos a Brucella spp. en muestras de leche mediante ELISA-I y confirmado con la existencia de animales seropositivos en RBT y ELISA-C sugiere una alta exposición de los hatos ganaderos del Azuay a la bacteria, lo cual ha sido descrito previamente, acompañado de la identificación de cepas de Brucella abortus en bovinos, así como en humanos, en varias regiones de Ecuador (Ron-Román y col., 2014; Rodríguez-Hidalgo y col., 2015).
La excelente correlación entre las pruebas ELISA-I en leche, RBT y ELISA-C en suero sanguíneo indican una alta sensibilidad de ELISA-I para diagnosticar fincas positivas a brucelosis con 100% de especificidad. Solo en dos fincas positivas en leche con ELISA-I no se encontraron animales positivos a RBT o ELISA-C, posiblemente debido al movimiento de estos al rejo de secado o descarte por problemas reproductivos al momento del muestreo individual, o a la negativa de algunos propietarios para la toma de muestras en hembras gestantes. Una reacción cruzada antigénica con otras infecciones bacterianas (Yersinia spp, Salmonella spp, Streptococcos spp, E. coli) podrían conducir a resultados falsos positivos en el diagnóstico serológico (Bonfini y col., 2018), aunque según Nielsen y col. (2004), eso es poco probable debido a la alta especificidad de las pruebas serológicas para brucelosis en leche.
La prevalencia de la brucelosis puede variar dependiendo de las zonas de estudio, influenciada por diferentes prácticas de manejo, procedencia de animales de reemplazo, sistema de explotación, mayor permanencia de la bacteria por variaciones en el clima, entre otros factores. Brucella spp. es muy susceptible a la luz solar y al calor, sobreviviendo unas pocas horas en los meses cálidos y secos, mientras que en verano pueden sobrevivir en suelo húmedo durante aproximadamente 7 días (Matope y col., 2010), pudiendo prevalecer en áreas endémicas por la amplia gama de hospedadores susceptible, capaces de transmitir la enfermedad (Ducrotoy y col., 2017; Musallam y col., 2019).
En cantones con mayor prevalencia de fincas afectadas, tales como: San Fernando, Girón, Cuenca, la brucelosis podría deberse al sistema de manejo, principalmente debido a la mezcla de animales procedentes de diferentes rebaños dentro de la misma zona geográfica (Craighead y col., 2018), por ser lugares con mayor cantidad de ganaderías lecheras y poseer un importante comercio de bovinos. En las encuestas epidemiológicas, la mayoría de productores manifestaron desconocer los síntomas de la enfermedad, hubo ausencia de monitoreo serológico mediante análisis de laboratorio y nulo descarte de animales infectados que comúnmente son comercializados, diseminando así la enfermedad. En zonas detectadas con baja prevalencia como los cantones Paute, El Pan, Guachapala, Gualaceo, Pucará, Santa Isabel, existen bajas tasas de transmisión posiblemente debido a factores agroecológicos que restringen el contacto entre los rebaños.
Los valores de prevalencia obtenidos en este estudio (8,5%) son menores a los encontrados por Mainato y Vallecillo (2017), en la provincia vecina del Cañar (13,63%), donde refieren una mayor presencia de fincas seropositivas en los cantones de Biblián y Cañar. Un estudio epidemiológico de Brucelosis a nivel nacional (Carbonero y col., 2018) incluye a la provincia del Azuay con una prevalencia a nivel de rebaño menor al 10%; Pichincha 37,5%; Santo Domingo 26,8%; Tungurahua 25,3% y Zamora con 4,8%. Por otro lado, Poulsen y col. (2014), en un estudio para determinar la prevalencia en dos provincias del Norte del Ecuador, refieren un valor de 7,2%. Estas variaciones a nivel país podrían deberse a las técnicas de muestreo, interpretación de las pruebas, reactivos utilizados, número de animales muestreados.
Dentro de los factores de riesgo, el tamaño de la finca fue un factor significativo asociado a una mayor seroprevalencia a brucelosis, debido probablemente a problemas de higiene, producto de una alta densidad animal en sistemas de producción extensiva. Berhe, Belihu y Asfaw (2007), manifiestan un riesgo de seropositividad de 8,5 y 4,3 veces mayor en hatos grandes y medianos, respectivamente, en comparación con rebaños pequeños, ya que en estos disminuye el riesgo de contacto con animales de otras manadas. Del mismo modo McDermott y Arimi (2002) declaran que, en sistemas extensivos, el tamaño de los rebaños, el mestizaje común con otros animales y el encuentro en puntos comunes de pastoreo y abrevadero incrementan el riesgo de contagio de la enfermedad.
Un historial de abortos o mortinatos se asoció con la seropositividad a brucelosis. Los fetos abortados y secreciones uterinas proporcionan un suministro constante de la bacteria manteniendo la transmisión de nuevas infecciones (Sanchez y col., 2020). También se reveló una asociación con problemas de celo en los animales, lo cual coincide con varios autores (Asgedom, Damena y Duguma, 2016), quienes identificaron también un aumento en el número de servicios por parto cuando el ganado presentaba problemas reproductivos debidos a la brucelosis, que afecta al tracto genital, conduciendo a una infección uterina y una tasa pobre en concepción.
En relación al sistema de explotación, existen resultados similares a los reportados en este trabajo, donde el manejo tradicional facilitaría la propagación de la enfermedad debido al poco control de movimiento de los animales (Fero y col., 2020). Sin embargo, Kumar y col. (2016), mencionan que la transmisión horizontal de la enfermedad en granjas organizadas se relacionaría con el hacinamiento, alta densidad de animales y malas prácticas higiénicas como la eliminación inadecuada de fetos abortados, membranas fetales, secreciones vaginales, que ayudan a la propagación de la infección.
La regresión logística asoció la eliminación inadecuada de la placenta y fetos como un factor predisponente para la transmisión de la infección, esto debido a que millones de Brucellas se excretan durante el parto normal o abortos de vacas infectadas, las cuales, teniendo un medio adecuado de temperatura, luz solar y pH, pueden mantener la infectividad durante varios meses (Sussex, 2016). De igual manera, John y col. (2010), indican que los propietarios de hatos que eliminaban de manera inadecuada residuos biológicos luego de partos, abortos o retenciones placentarias fueron más propensos a tener al menos un animal seropositivo cuando se comparó con aquellos que eliminaron correctamente estos materiales.
Si bien en este trabajo, la asociación con la introducción de animales con estatus sanitario desconocido en el rejo no tuvo un efecto significativo, el porcentaje de animales positivos aumenta cuando se introducen animales de otras fincas. Kanouté y col. (2017) determinan una mayor probabilidad de observar rebaños positivos a Brucella cuando ingresan semovientes sin análisis en áreas endémicas. Destacan la necesidad monitorear a los bovinos antes de ingresar a la granja, e igualmente promover el reemplazo con animales provenientes de fincas libres de brucelosis.
Según la encuesta epidemiológica en la mayoría de las zonas evaluadas los productores desconocían la existencia de programas preventivos de inmunización contra brucelosis, por lo cual se puede inferir que la presencia de animales seropositivos se debió al contacto con Brucellas de campo y no a reacciones post vacunales. Dorneles, Sriranganathan y Lage (2015) señalan que la vacunación es una estrategia determinante para programas de control y erradicación de brucelosis. De igual forma, Pascual y col. (2018), manifiestan que los programas de erradicación deben incluir pruebas de diagnóstico, descarte de animales infectados y la incorporación de la vacunación, la cual ha demostrado reducir infecciones y abortos en los animales.
Tabla 3 Factores de riesgo asociados a brucelosis bovina.
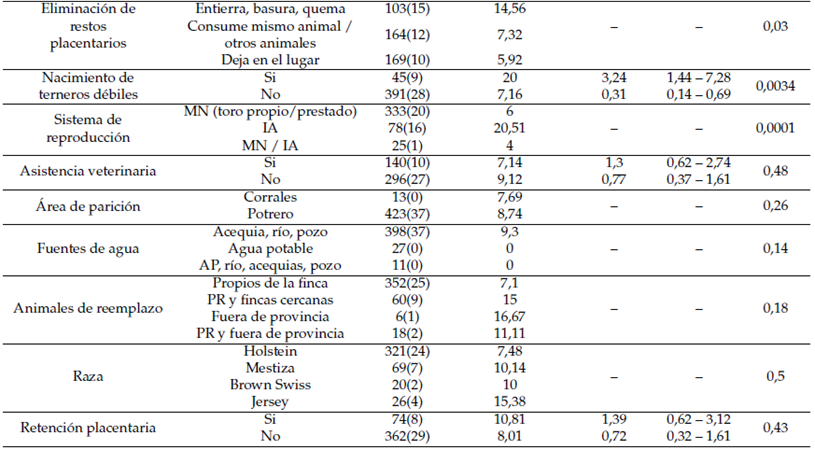

CAN= caninos; OVI= ovinos; POR= porcinos; EQUI= equinos; MN= monta natural; IA= Inseminación artificial; AP= agua potable; PR= propios de la finca.
Olsen y Stoffregen (2005) han comprobado que, el porcentaje de reactores en rebaños infectados es menor en los animales vacunados en comparación con animales no vacunados. Según sus datos, al usar dosis completa de la cepa 19 en terneros y al evaluar la protección en bovinos de hasta 9 años de edad estimaron que aproximadamente 65-75% de todos los animales vacunados estaban completamente protegidos durante su vida útil productiva. Sin duda, la alta prevalencia de brucelosis detectada en la zona está relacionada, además, con la ausencia de vacunación.
El sistema de reproducción también puede influir en la infección por Brucella spp. sobre todo a través del contacto sexual con rebaños vecinos o mediante el intercambio de toros provenientes de granjas infectadas (Nardi y col., 2017). La raza y las fuentes de agua no demostraron en este estudio ser factores que predisponen a la infección. Aunque otros factores de manejo no considerados pudieran influir, nuestros hallazgos concuerdan con la epidemiología general de la brucelosis bovina observadas en otras partes del mundo (Franc, Häsler y Arenas-Gamboa, 2018; Hull y Schumaker, 2018), entendiéndose que la alta prevalencia de esta enfermedad representa un importante problema de salud pública y animal en Ecuador.
Conclusiones
Este estudio proporciona evidencia serológica de la presencia de brucelosis en hatos lecheros con diferentes niveles de seropositividad en la provincia del Azuay, con una prevalencia elevada (8,5%), asociada a factores de riesgo involucrados en la patogénesis de la enfermedad y responsables de su propagación. La prueba ELISA-I en leche es una herramienta diagnóstica útil para identificar ganaderías positivas a brucelosis con altísima especificidad, reduciendo el tiempo de muestreo y costo, y pudiendo analizar eficazmente un número mayor de fincas a la vez. Es necesario realizar serovigilancia en las ganaderías a fin de comprender la distribución espacial de la enfermedad en el país, previo a implementar programas de control y sensibilizar a la población sobre la transmisión zoonótica de la brucelosis.