Introducción
Los plaguicidas se aplican casi universalmente en terrenos de cultivos agrícolas, parcelas y en la industria florícola, centrándose el presente estudio en esta actividad económica, ya que es una de las principales actividades económicas dentro de la cuenca del río Pisque.
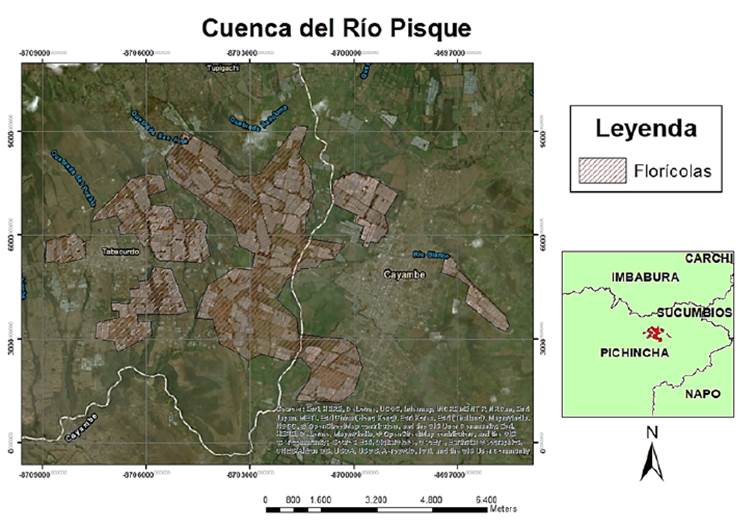
La cuenca del río Pisque es un valle en el cual se encuentran dos ciudades principales, Cayambe y Tabacundo, las cuales sumaron una población de 152 153 habitantes para el año 2018 (GAD Municipal de Pedro Moncayo, 2018; GADIP Cayambe, 2020), además de contar con 3 201,73 hectáreas de flores cultivadas en invernadero para el año 2017 (Cachipuendo, 2018). Se encuentra ubicada en la provincia de Pichincha y sus aguas desembocan en el río Guayllabamba, que posteriormente desemboca en el río Esmeraldas y en el océano Pacífico. Los invernaderos dedicados a la producción florícola acentuados entre las ciudades de Cayambe y Tabacundo se pueden apreciar en la ortofoto de la Figura 1.
En la cuenca, los cultivos florícolas para los años ochenta ocupaban 25 hectáreas (Bravo y Flores, 2006), e incrementaron a mediados de los años 90 debido a factores económicos como la eliminación de los aranceles para la exportación a Estados Unidos (Corrales, 2016) y a factores ambientales, como la gran iluminación solar que ocurre a los 2800 y 2900 msnm, las temperaturas estables durante todo el año (Bravo y Flores, 2006), y la cercanía a los puertos aéreos; este incremento de la producción florícola conllevó consecuentemente al incremento del uso de plaguicidas.
Se estima que menos del 0,1% de los pesticidas aplicados a los cultivos alcanzan su objetivo, mientras que el resto terminan contaminando el aire, el suelo y el agua (Arias y col., 2008). Mucha de esta liberación de pesticidas se transporta al agua, afectando su calidad y salud humana. Entre las afectaciones al agua se tiene el incremento de la toxicidad, del carbón orgánico no biodegradable, de la conductividad eléctrica, y de la materia sólida (Calamari y Barg, 1993); mientras que las principales afectaciones a la salud humana son daños al sistema nervioso, alteraciones hormonales, cáncer, daños al sistema inmunológico, daños reproductivos, entre otros (Badr, 2020). Por esta razón es necesario el monitoreo de pesticidas, lo cual generalmente se realiza mediante muestreos activos y únicamente de Compuestos Orgánicos Persistentes (COP) (Alvarez y col., 2014; Miège y col., 2012). Por lo cual, se propone para el presente trabajo un muestreo de los químicos más usados en la industria florícola para evaluar su permanencia, y registrar descargas continuas mediante técnicas de muestreo pasivo, evitando descargas puntuales (Alvarez y col., 2007).
Para el muestreo de los plaguicidas se usó una técnica útil en la evaluación de los compuestos orgánicos en cuerpos de agua naturales, como son los métodos de muestreo pasivo (Narváez, López y Molina, 2013). Estos pueden permanecer en el agua por periodos acumulados de tiempo de forma pasiva adsorbiendo los contaminantes por procesos de difusión y partición (Vrana y col., 2005). El uso de un muestreador pasivo para monitorear contaminantes en el medio acuático es más simple y práctico que la medición de plaguicidas bioacumulados en organismos vivos (Alvarez y col., 2004; Vrana y col., 2005; Fedorova y col., 2014; Kot, Zabiegała y Namie´snik, 2000). Sin embargo, su uso en el campo ambiental requiere de una calibración de laboratorio previa para determinar el valor de la tasa de muestreo del compuesto específico (Morin y col., 2012), obteniéndose como resultado final el arrastre o carga fluvial que tiene cada químico en un flujo de agua superficial.
Materiales y Métodos
En esta sección se explicarán los protocolos que se usaron para la medición del caudal, el muestreo pasivo de aguas, los análisis de laboratorio y la calibración de los dispositivos de muestreo. Para esto, primero se definieron los plaguicidas que se evaluarán mediante una encuesta a 20 productores florícolas.
Para los aforos se buscó en cada río una pequeña sección donde el agua fluya continua y unidireccionalmente, sin la interrupción de rocas u obstáculos para realizar la medición del área transversal del cuerpo de agua mediante una batimetría (Swanson, Brownawell y O’Connell, 2009), y para la medición de la velocidad se usó un micromolinete marca Simtech, modelo FP111. Este procedimiento se realizó un día al mes, cada mes durante un año, iniciándose en junio de 2018. Hubo tres puntos de aforo, uno en el río Granobles, otro en el río Pisque (punto 1) después de la unión con el río Guachalá y un último en el río Pisque (punto 2) antes de aportar su caudal al río Guayllabamba. Para el cálculo del caudal del río Guachalá se procedió a restar el caudal del río Granobles del caudal del río Pisque (punto 1), ya que como se observa en la Figura 2, no se encuentran aportes importantes dentro del tramo estudiado.
Para la medición de plaguicidas polares se usaron dispositivos SPMD (Semipermeable Membrane Devices/Dispositivos de membrana semipermeable) y para no polares POCIS (Polar Organic Chemical Integrative Sampler/Muestreador integrador de compuestos orgánicos polares). La diferencia de potenciales químicos del analito entre los medios líquido y sólido de los muestreadores hacen que estos dos lleguen al equilibrio en el tiempo en el que se realiza el análisis, obteniendo como resultado en el muestreador pasivo la concentración media de analito que se encontraba en el cuerpo de agua (Górecki y Namie´snik, 2002). Para el cálculo de la masa del analito acumulado respecto a la concentración en el agua se usó la Ecuación 1 propuesta por Vrana y col. (2005).
Donde M s (t) es la masa del analito acumulada en el muestreador luego del tiempo de exposición. R s es la constante de proporcionalidad, C w es la concentración de analito en el ambiente acuoso, y t corresponde al tiempo de exposición. Los dispositivos usados son los distribuidos por la empresa “ESTLab” ubicada en St. Joseph, Missouri, Estados Unidos. Los dispositivos POCIS son del modelo “Oasis HLB rectangular” y los dispositivos SPMD son del modelo “99% purity 15cm with loops”. Ambas membranas fueron sujetadas por una estructura de metal y colocadas dentro de una carcasa plástica de tubo PVC (Figura 3).
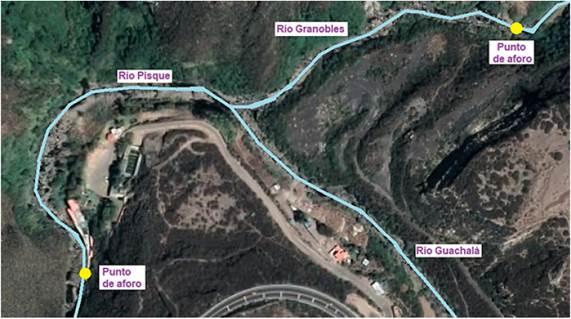
Figura 2 Zona de muestreo y puntos de aforo en la conjunción de los ríos Granobles y Guachalá para formar el Pisque.
Hubo cuatro puntos de muestreo pasivo, tres ubicados en los sitios en que se realizaron los aforos de caudal, y un cuarto en el río Guachalá. Se realizaron dos puntos de muestreo en el mismo río Pisque con el fin de conocer que químicos permanecen en el agua y qué químicos se degradan. Se colocaron un muestreador SPMD y un POCIS en cada uno de los cuatro puntos de muestreo con una permanencia de 28 días en el agua en cada mes, durante los tres meses secos, que en la zona corresponden de junio a agosto. El objetivo de realizar el muestreo en los meses secos es detectar concentraciones más bajas de plaguicidas, lo cual se dificulta si existen diluciones de concentración debido a precipitaciones.
Para el análisis de pesticidas se realizó un procedimiento de extracción conocido como diálisis, en el cual se separan los analitos de las membranas con métodos distintos para los SPMD y los POCIS, según señala el procedimiento propuesto por Narváez, López y Molina (2013). Con esto se procedió a utilizar la técnica de preparación de la muestra para medición recomendada por Aguilar (1998) y López-Roldán, Alda y Barceló (2004) y Rodrigues y col. (2007), entre otros. La medición se realizó por el método de Cromatografía líquida de alta eficiencia o High Performance Liquid Chromatography (HPLC). Para esto se consideraron las técnicas para pesticidas desarrolladas por Kiso y col. (1996) y Hernández y col. (2001) y Ferrer y Thurman (2007), entre otros. Estas técnicas se aplicaron tanto en la fase normal de los compuestos polares, para lo cual se utiliza una fase estacionaria polar, y una fase móvil no polar; como también para compuestos no polares en las cuales la fase estacionaria es no polar y la fase móvil polar.
Para la medición se utilizó un equipo de HPLC marca Waters, los modelos de sus componentes son 1525 de la bomba binaria, 2998 del detector de matriz de fotodiodos y el software Empower 3 desarrollado por la misma marca. Como columna se usó una C18 marca Restek con código 9534565.
Según Huckins y col. (1999) y Luellen y Shea (2002) y Murdock y col. (2001), la calibración de la cinética de intercambio en el muestreo pasivo se puede realizar en el laboratorio. El método experimental es el más conveniente para conocer los coeficientes de transferencia, ya que la velocidad de transferencia depende de varios factores hidrodinámicos como turbulencia, propiedades ambientales, forma y permeabilidad de la carcasa, entre otros, los cuales se simplifican en un solo factor (Yabuki y col., 2016). Experimentalmente la obtención de este único factor en el laboratorio se realizó en un canal hidrodinámico marca Armfield modelo S16-11-b; con la degradación de los plaguicidas en el mismo canal se obtuvieron los valores de degradación de cada analito. En el canal hidrodinámico se colocaron los ingredientes a analizar en una concentración de 1 ppm mediante productos comerciales; se verificó la concentración inicial y se colocaron tres dispositivos SPMD y tres dispositivos POCIS retirándose y analizándose un par cada tres días. Por último, para la cuantificación de los agrotóxicos en los cuerpos de agua se usan las constantes de proporcionalidad de laboratorio corregidas mediante los datos obtenidos desde los dispositivos SPMD y los POCIS de campo, obteniéndose una concentración de plaguicida media en el agua por cada mes, la cual al multiplicarse por el caudal del mismo mes da como resultado el valor de la carga del pesticida en el cuerpo hídrico en movimiento en magnitudes de masa sobre tiempo.
Resultados
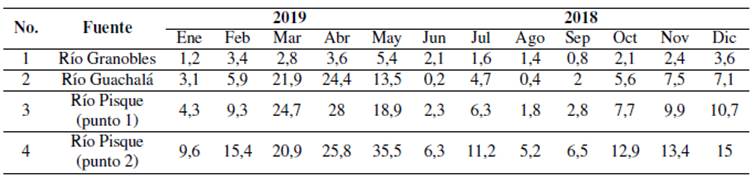
Los resultados en medidas de caudal en metros cúbicos por segundo (m 3 /s) de los aforos para cada mes se muestran en la Tabla 1, con una medición realizada en el río Granobles y dos en el río Pisque, en dos puntos distintos. Para el caso del río Guachará, el valor de caudal corresponde al cálculo matemático explicado anteriormente.
Con las encuestas realizadas a los productores florícolas se pudo comprobar el uso en mayor cantidad de 24 plaguicidas, los cuales se presentan en la Tabla 2. En ninguno de estos ingredientes se encontró una toxicidad del Tipo I o compuestos clasificado como COP; de los encontrados tres son de toxicidad Tipo II, 13 de Tipo III y 9 de Tipo IV. Sin embargo, se decidió incrementar la medición del DDT 4,4’ con el fin de comprobar la permanencia de este químico en el suelo que presenta contacto con el agua y que posiblemente fue usado en décadas anteriores.
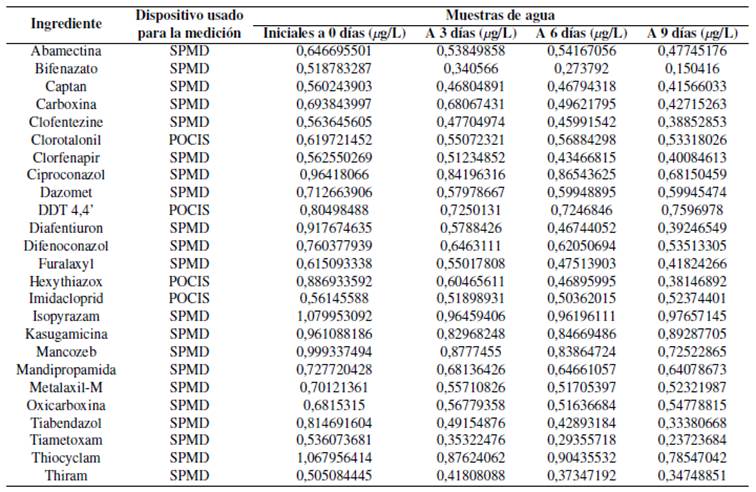
Con estos plaguicidas, se procedió a la calibración de los muestreadores pasivos SPMD y POCIS los cuales se presentan en la Tabla 2, el tipo de dispositivo de muestreo usado para su análisis según la polaridad del ingrediente, las concentraciones temporales medidas directamente en el agua luego de realizarse una mezcla del químico, y las mediciones obtenidas desde los dispositivos pasivos a los 3, 6 y 9 días.
De los valores anteriores se obtuvieron las constantes de proporcionalidad con estas tasas, y los caudales mensuales se obtuvieron las cargas fluviales de plaguicidas transportadas al año en los cuatro puntos de medición, los cuales se presentan en la Tabla 3.
Conclusiones y Discusión
De los 25 agrotóxicos medidos, todos fueron detectados por los dispositivos SPMD y POCIS a excepción del Ciproconazol. De estos, el Tiabendazol ya fue previamente detectado en la cuenca mediante un muestreo compuesto directo en el río Granobles en el estudio realizado por Breilh y col. (2009), por lo que 24 químicos no se han caracterizado antes en la cuenca debido a su producción comercial menor a diez años (Securities and Exchange Commission, 2017).
En el río Granobles el químico con mayor concentración fue el acaricida Hexythiazox con una cantidad descargada de 1,2 T/año, otros con alta concentración fueron el acaricida Clofentezine y el fungicida-bactericida Kasugamicin con concentraciones mayores a media tonelada al año. En el río Guachalá el químico con mayor concentración fue el acaricida Hexythiazox con una descarga medida de 5,5 T/año, mientras que el insecticida-acaricida Abamectin tiene una descarga de media tonelada al año. El químico con mayor concentración en la desembocadura del río Pisque fue el acaricida Clofentezine con una permanencia en el arrastre en el río de 0,605 T/año, mientras que entre el fungicida Diafeconazol y fungicida-bactericida Kasugamicin superan la permeancia de arrastre en el río superior a 0,4 T al año. Los resultados confirman que los insecticidas y los fungicidas en Ecuador son los agrotóxicos más utilizados (Valarezo y Muñoz, 2011).
El arrastre más alto de DDT en aguas superficiales fue en el río Granobles con 0,194 T/año, debido a que en esta subcuenca se encuentran las industrias florícolas. Sin embargo, este valor de arrastre es bajo comparado al resto de agrotóxicos, ya que en el Ecuador desde el año 2008 no se importa este plaguicida persistente; por lo tanto, la contaminación de los suelos y el agua con sustancias químicas y residuos persistentes es el resultado de muchos años de su aplicación sin restricciones, encontrándose metabolitos como el DDT 4,4’ aún en los cuerpos hídricos (Cairns y Sherma, 1992; Kouzayha y col., 2013).
Tabla 3 Cargas fluviales de plaguicidas desde junio de 2018 a mayo de 2019 en los puntos de muestro Granobles, Guachalá, Pisque (punto 1) y Pisque (punto 2).
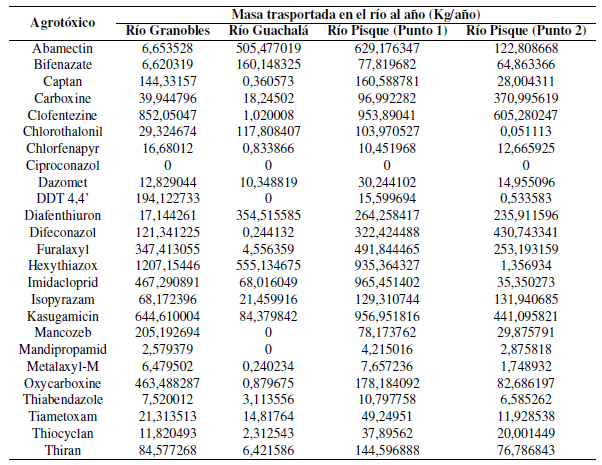
Existe una disminución de las concentraciones de plaguicidas aguas abajo comparando los puntos 1 y 2 del río Pisque, esto en parte se correlaciona con las disminuciones de las concentraciones encontradas en laboratorio (Tabla 2). En los análisis de campo esto se puede deber a factores ambientales, además de condiciones climáticas variables, incluidas la sequía, desertificación y otros factores presentes en la zona de estudio (Aisha y col., 2017). El acaricida Clofentezine tiene una mayor permanencia en los cuerpos hídricos a pesar de tener una toxicidad del Tipo IV, con una disminución de únicamente el 37% entre los puntos 1 y 2 del río Pisque. No se puede comparar la presencia y degradación de estos químicos con otras cuencas o microcuencas del país, ya que no existen estudios similares.
El perfil químico del río Pisque es relativamente similar a los observados en el lago Ziway en Etiopía, el cual tiene también presencia de industria florícola en su cuenca (Lamessa y col., 2021). El conocimiento sobre el tipo y cantidad de pesticidas presentes en la cuenca permite evaluar su efecto en la salud humana y los ecosistemas, para esto se deberá analizar el ciclo de vida completo de los plaguicidas en la cuenca, analizando sus destinos finales y la exposición humana y de otras especies a través de los diferentes medios y vías, como por ejemplo alimentos, evaporación al aire, transferencia al suelo o al agua subterránea (Margni y col., 2002).