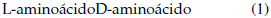Forma sugerida de citar:
Franco-Rodríguez, F., González-Morales, H., Heredia-Barbero, A., Montoya, L. y Reyes-Medina, Y. (2023). Quiralidad en las ciencias naturales: un acercamiento a distintas escalas. La Granja: Revista de Ciencias de la Vida. Vol. 37(1):8-22. http://doi.org/10.17163/lgr.n37.2023.01
1 Introducción
La quiralidad es un tema poco explorado y de gran interés a distintos niveles. Por ello, se ideó un contenido que adecuara, condensara y reflejara correctamente la información que la ciencia ha reportado. Los temas tratados a continuación son poco conocidos en distintas comunidades, y se cree que pueda servir para adentrarse en este tema tan fascinante. La relevancia de la quiralidad radica principalmente en que se trata de un sistema complejo y dinámico tanto en la ciencia como en el arte. Esta visión permitió analizar el fenómeno a distintas escalas mediante la trayectoria de otros trabajos, conformando así un estudio histórico y actual. Aparentemente, a grosso modo, la información existente sobre la quiralidad a distintos niveles es escasa y que este tipo de análisis es importante para tener una mejor comprensión sobre el tema.
2 Antecedentes Históricos
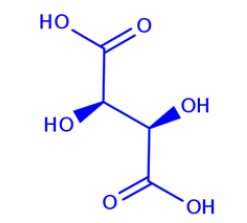
En la historia de la quiralidad se debe mencionar que en 1815 Jean Baptiste Biot puso luz polarizada en soluciones de distintos compuestos orgánicos, notando su desvío al estilo de las manos, es decir, un desvío hacia la izquierda y un desvío hacia la derecha. Él le llamó “actividad óptica”. Luego, los experimentos de Luis Pasteur en 1848 con monocristales de ácido tartárico (Figura 1) fueron determinantes porque se tuvo en la mano un conjunto de cristales quirales (Suh y col., 1997). En los años 50 se hallaron las fuerzas débiles que son una de las fuerzas fundamentales de nuestro universo. Este descubrimiento trajo consigo una respuesta que es a la vez pregunta: esta fuerza fundamental también presenta asimetría, favoreciendo la interacción con partículas izquierdas (StackExchange, 2020). El posible origen de este comportamiento es que las partículas, moléculas y todo en nuestra realidad se comportan como hélices (que son casi sinónimo de quiralidad) al ordenarse en el espacio de esta forma. Digamos, una hélice es la representación más fiable de la quiralidad. Podríamos decir con otras palabras que esto no se sabe. Pero la posible interacción de los campos magnéticos a nivel atómico puede ser la respuesta. A continuación, se muestra una molécula de ácido tartárico (Figura 1), un compuesto químico utilizado por Luis Pasteur y su esposa Marie Laurent donde se vio por primera vez la simetría quiral. Fue este el comienzo de la caracterización estructural especular en la química.
3 En la Física
La física indica que la izquierda y derecha, por ejemplo, en la entropía de la segunda ley de la termodinámica, son casi iguales en sus propiedades, pero los rayos cósmicos ofrecen datos que pueden contradecir la paridad entre configuraciones izquierdas y derechas en el universo. Los rayos cósmicos se cree que se originan en el Sol, en las estrellas o en agujeros negros (Kohler, 2020) y pueden ionizar a las moléculas orgánicas, causando reactividad química no siempre útil para los sistemas vivos. Cuando una partícula está cargada y tiene giro sobre su propio eje y alrededor de un núcleo, produce un campo magnético. Entonces, el campo magnético es un comportamiento debido al movimiento de una partícula cargada. Si este movimiento se detiene, el campo magnético también se desvanece. Las ecuaciones de Maxwell juntan los conceptos de electricidad y magnetismo como las dos caras de una misma moneda (Beléndez, 2008). ¿Por qué hablar de radiación cósmica?, porque cuando esta radiación interactúa con algunos átomos, forma muones y electrones que interactúan preferentemente con moléculas de cierta quiralidad, lo que favorece su síntesis. De forma parcial, esto explicaría la pérdida de la paridad en estas moléculas, aunque no explique por qué los sistemas vivos no respetamos molecularmente esta paridad (Figura 2).
La segunda ley de la termodinámica tampoco respeta la simetría, porque indica que los sistemas tienden a estabilizarse o condicionarse a las características del medio que, a final de cuentas, son las condiciones del universo donde toda la realidad existe. El fin último de todo es el desorden y la entrega a las condiciones de nuestro universo. Las fuerzas débiles también tienden a favorecer la asimetría. De forma histórica, la polarización de la luz ha sido identificada desde hace siglos en muchas culturas. Este fenómeno se llama “polarización”, porque la luz al ser pasada por un monocristal de espato de Islandia, que es calcita, un carbonato de calcio, genera dos puntos o “polos” (Craig y Thirunamachandran, 1999). Los trilobites tenían ojos compuestos de este carbonato de calcio (Farace y Aznar, 2011). Un acoplamiento preferencial a uno de los polos por parte de un átomo o una parte de la molécula sería la respuesta (Craig y Thirunamachandran, 1999). Esta respuesta sobre el acoplamiento de las partículas fundamentales con radiaciones y la posible selección molecular en la misma evolución molecular del universo podrían traer consigo respuestas, otros acoplamientos (Torres-Silva, 2008) y la selección molecular asimétrica en el fenómeno más complejo que ha visto nuestro universo: la vida. El experimento de Wu donde se viola la paridad por las fuerzas débiles (Wu y col., 1957) es el equivalente al que pertenecemos nosotros como máquinas complejas quirales.

Figura 2. Colonia del murciélago Nyctinomops laticaudatus en vuelo. Los murciélagos salen de las cuevas con un vuelo helicoidal y en sentido contrario a las manecillas del reloj, resultado de una “convención social” (Gardner, 1985). (Crédito de la imagen: M. Zozaya Naturalista, bajo permiso CC BY NC).
4 En los sistemas biológicos
4.1 Microorganismos
Desde hace aproximadamente 3000 millones de años, los procariontes han vivido en biopelículas bacterianas (Nazar, 2007). Esta capacidad de formar colectivos cooperativos sirve a una importante estrategia de supervivencia cuando las bacterias están expuestas a condiciones variables y adversas (Finkelshtein y col., 2017); así mismo, presentan grandes ventajas de protección frente a perturbaciones medioambientales por ejemplo, la humedad, el pH, y la temperatura (Nazar, 2007), y una resistencia de 1000 a 1500 veces mayor a antibióticos (Gohil y col., 2018).
Cuando se forman biofilms, las bacterias pueden utilizar señales químicas coordinadas para comunicarse entre ellas; esta interrelación funciona mediante mensajeros: pequeñas moléculas que permiten a las bacterias percibir la población existente y responder ante diferentes condiciones ambientales cambiantes. A este mecanismo de comunicación se le llama “quórum sensing”. Las bacterias Gram negativas emplean moléculas acilhomoserina-lactonas, mientras que en las Gram positivas prevalecen los oligopéptidos modificados (Nazar, 2007).
La formación de colonias elaboradas y enrevesadas con geometrías quirales y/o fractales puede verse en diferentes especies, tales como Bacillus subtilis, que utiliza flagelos (Ingham y Jacob, 2008) y Paenibacillus vortex que, además, posee motilidad social avanzada empleando señalización quimiotáctica. P. vortex forma enjambres con miles de bacterias con grupos líderes llamadas vórtices que giran cooperativamente, así, el vórtice se expande en tamaño y se mueve hacia afuera, dejando un rastro y originando a colonias enrevesadas con formas quirales o fractales (Finkelshtein y col., 2017), aunque la base biológica de la formación no está bien comprendida actualmente (Ingham y Jacob, 2008).
4.2 Macroorganismos
La expresión de la quiralidad en los sistemas biológicos resulta ser una cualidad inherente a todos ellos. La quiralidad puede manifestarse no solo en sistemas microscópicos (ya que la mayoría de las moléculas de los seres vivos son quirales), sino también macroscópicamente, tales ejemplos serían los casos de las alas de las mariposas (Figura 3) o las conchas helicoidales de distintos moluscos (Nieto-Ortega, 2014). Esto mismo sucede en el caso de plantas trepadoras que se enrollan en forma de hélices sobre distintos tipos de plantas, como árboles o arbustos, así como en diversos materiales como estacas; la forma de hacerlo es dextrógiro (hacia la derecha), como en el caso del dondiego de día, aunque también existen aquellas que lo hacen mediante un giro levógiro (hacia la izquierda), como es el caso de la madreselva (Pérez Benítez y Arroyo Carmona, 2018). Citando el ejemplo de los humanos, que son estructuralmente quirales, podemos encontrar el hígado a la derecha del centro y el corazón hacia la izquierda, mostrando así quiralidad funcional (Hegstrom y Kondepudi, 1990).
Aunque no hay ninguna razón para decir que una imagen especular es mejor que la otra, en la naturaleza se presenta cierta predominancia por un tipo de quiralidad sobre otro (Hegstrom y Kondepudi, 1990). Por ejemplo, la quiralidad funcional es la preferencia de un organismo por utilizar una de sus extremidades más que la otra, un ejemplo de esto sería que los humanos utilizan más una mano que la otra para realizar diversas actividades (Barrera-Calva, Pineda-Ledezma y Barrera-Mera, 2012).
Muchas especies utilizan el hemisferio derecho del cerebro para reaccionar de forma rápida ante condiciones novedosas, por otro lado, utilizan el hemisferio izquierdo para controlar respuestas que tienen otras alternativas como respuesta a ellas, categorizando así sus posibilidades donde de forma ordinaria las funciones hemisféricas tienen una participación de complementariedad funcional (Barrera-Calva, Pineda-Ledezma y Barrera-Mera, 2012). En los humanos, el hemisferio izquierdo se encarga de la vocalización comunicativa (incluyendo el movimiento de la lengua, la mandíbula, la lengua y los músculos labiales). Sin embargo, esto no es exclusivo de los humanos, también se ha visto que los grillos y las aves poseen esta propiedad quiral (Barrera-Calva, Pineda-Ledezma y Barrera-Mera, 2012).
Muchas especies utilizan el hemisferio derecho del cerebro para reaccionar de forma rápida ante condiciones novedosas, por otro lado, utilizan el hemisferio izquierdo para controlar respuestas que tienen otras alternativas como respuesta a ellas, categorizando así sus posibilidades donde de forma ordinaria las funciones hemisféricas tienen una participación de complementariedad funcional (Barrera-Calva, Pineda-Ledezma y Barrera-Mera, 2012). En los humanos, el hemisferio izquierdo se encarga de la vocalización comunicativa (incluyendo el movimiento de la lengua, la mandíbula, la lengua y los músculos labiales). Sin embargo, esto no es exclusivo de los humanos, también se ha visto que los grillos y las aves poseen esta propiedad quiral (Barrera-Calva, Pineda-Ledezma y Barrera-Mera, 2012).
En el caso típico de los Gasterópodos se puede observar un ejemplo clásico de quiralidad, esto se debe a la dirección en la que se enrollan: dextral (en sentido de las manecillas del reloj o diestro) y sinistral (zurdo) (Schilthuizen y Davison, 2005), también conocido como levógiro. Esta quiralidad es originada en el desarrollo temprano (Vargas y Zardoya, 2015). En la tercera división del desarrollo larvario, cuando el embrión pasa de cuatro a ocho células, los moluscos sufren una segmentación en espiral, es decir, los planos larvarios se orientan de manera oblicua respecto al eje polar del oocito. Cuando se definen los patrones de división temprana y el sentido en que se orienta, las asimetrías corporales consecuentes están determinadas, es decir, si la división ocurre en el sentido de las manecillas del reloj estaremos hablando de un organismo dextral, en contraparte, si el caso es antihorario entonces el organismo será levógiro o sinistral (Vargas y Zardoya, 2015).

Figura 3. Mariposa “Mariposa Cometa Xochiquetzal”; se señala el plano de simetría bilateral (Crédito de la imagen: N. Pacheco-Coronel Naturalista, bajo permiso CC BY NC). La quiralidad se presenta cuando existe uno o más elementos quirales, por ejemplo, un eje quiral, plano o centro.
En la anatomía interna, los órganos internos difieren en levógiros y dextrógiros, ya que dependiendo de cuál sea el caso los órganos internos se reducen del lado hacia donde se ocurre el giro (Vargas y Zardoya, 2015). En ciertas especies estas asimetrías corporales pueden impedir que exista cópula entre una misma especie, porque los genitales también se invierten respecto a individuos con la quiralidad opuesta (Schilthuizen y Davison, 2005). Por ello, los organismos que tienen una quiralidad opuesta a la mayoría de los que viven en una población tendrán problemas para encontrar pareja.
Entre organismos dominados por quiralidad dextrógira, los individuos levógiros parecen existir debido sólo al resultado de mutaciones, con frecuencia muy bajas (de uno de cada ciento a uno de cada mil), aunque esto puede variar con la especie, llegando inclusive a especies donde los individuos levógiros y dextrógiros muestran una proporción similar, como es el caso del caracol Liguus poeyanus (Hegstrom y Kondepudi, 1990).
Adicionalmente, se han descrito genes que se expresan exclusivamente de un lado del cuerpo y que determinan algunas de las asimetrías de los gasterópodos. En el ejemplo de un organismo dextrógiro, el lado derecho del cuerpo del organismo expresaría genes dependientes de la quiralidad, su expresión se relacionaría con la formación de células productoras de concha, con un mayor ritmo en el lado derecho, o en el caso de los levógiros en el lado izquierdo. Si se anula la actuación asimétrica de estos genes se obtienen conchas completamente simétricas (Vargas y Zardoya, 2015). Cabe destacar que los genes que regulan el desarrollo de las asimetrías corporales (levógiro y dextrógiro) también actúan en otros deuterostomos y vertebrados, por ello, parecería posible que esta cascada de genes estuviera presente en un antepasado común de los moluscos y deuterostomos, siendo este el que estableciera tales asimetrías corporales (Vargas y Zardoya, 2015).
En las pocas especies que se ha caracterizado la quiralidad, esta está determinada por un solo locus genético con herencia retrasada, lo que significa que el factor de herencia que controla la orientación es materno (Schilthuizen y Davison, 2005).
5 Estructuras Celulares
5.1 Membrana
Las membranas biológicas se componen de una doble capa o bicapa de lípidos (generalmente fosfolípidos), estos últimos contienen cuatro secciones: dos cadenas de ácidos grasos unidos a una molécula de glicerol y este a su vez a un fosfato; en el otro extremo del fosfato se pueden encontrar moléculas como colina, serina, inosina, etanolamina, entre otras (Figura 4b). La estructura de la membrana es una característica que sigue siendo trascendental para explicar la diversidad de los seres vivos. Los microbiólogos Otto Kandler y Mark Wheelis sustentaron en 1990 un sistema de clasificación de los seres vivos en tres dominios (Archaea, Bacteria y Eukarya), utilizando a la composición de la membrana como uno de los principales sustentos (Woese, Kandler y Wheelis, 1990). Aunque Woese ya había desarrollado el uso de secuencias para clasificar a los seres vivos, desde la década de los 70 hizo falta más contexto para convencer a la comunidad con su sistema de clasificación. En la descripción de 1990 se contemplan tres rasgos para diferenciar a los dominios: estructura celular (procarionte, eucarionte), tipo de unión ácido graso a glicerol (éter, éster) y tipo de rRNA (18S rRNA, 16 S rRNA) (Woese, Kandler y Wheelis, 1990).
Hasta este punto la homoquiralidad no se aprecia en la membrana, pero de cerca se reconoce que el glicerol presenta dos configuraciones: glicerol-1-fosfato (G1P) en Archaea y glicerol-3-fosfato (G3P) en Bacteria y Eukarya, en donde G1P es enantiómero (levógiro) de G3P (dextrógiro) (Figura 4b). Ambas moléculas son sintetizadas por deshidrogenasas y aun cuando tienen una función y localización equivalente, debido a su polaridad y a las moléculas unidas por ambos extremos, las deshidrogenasas G1DPH y G3DPH no comparten una historia evolutiva (Akanuma, 2019). Con este antecedente persistía un dilema conocido como “la división de lípidos”, es decir, ¿cómo y cuándo se originó la homoquiralidad? Al respecto, el común ha aceptado que el origen fue heteroquiral (una mezcla de G1P y G3P), esto es que el “Last Universal Common Ancestor” (LUCA) contaba con una membrana heteroquiral y recientemente se ha demostrado, gracias a filogenética molecular, que la homoquiralidad es moderna (Figura 4a). Este análisis con homólogos bacterianos de G1DPH y arqueanos de G3DPH concluyó que el ancestro de Bacteria no contenía G1DPH, por tanto, la molécula G1P en Archaea fue seleccionada después de su origen y su origen era heteroquiral al igual que en LUCA (Akanuma, 2019; Lombard, López-García y Moreira, 2012). Con lo anterior se ha logrado explicar la singularidad de los eucariontes al presentar una membrana con 3PG cuando se originaron por un proceso de endosimbiosis, donde la arquea (actualmente homoquiral 1PG) actúa como hospedador de una bacteria (13PG) si esta arquea contaba con una membrana heteroquiral.
5.2 Pared celular
La mayoría de los procariontes del dominio Bacteria tienen una envolvente que es alguno de los dos tipos Gram (positivos o negativos). En ellos el arreglo de la envolvente es bastante distinto, pero coinciden en contener una pared celular de mureína (del latín murus ‘muro’), químicamente nombrada como péptidoglicano. La mureína cuenta con dos secciones: varias fibras de un polisacárido que alterna N-acetilglucosamina (NAG) con N-acetilmurámico (NAM) unidas entre sí por un péptido. Algunos de los aminoácidos se conocen como no canónicos porque no están en el listado de los 20 aminoácidos universales en los seres vivos (canónicos), algunos ejemplos son: L-ornitina, L-homoserina y L-idroxilisina y otros más que destacan por ser dextrógiros; como: D-isoglutamato, D-ornitina, D-alanina y D-serina (Vollmer, Blanot y De Pedro, 2008). Los D-aminoácidos también se encuentran en algunas moléculas de moléculas integradas al péptidoglicano, por ejemplo, el ácido teicoico (del griego τειχoζ, teikhos, ‘pared’) ¿Cómo y por qué se originan estas versiones isoméricas? Aquí tiene cabida considerar que estos péptidos heteroquirales no se sintetizan en el ribosoma sino por enzimas, entre ellas las transpeptidasas, y que la interconversión de los L y D aminoácidos es efectuada por las enzimas epimerasas y racemasas, que pertenecen al grupo enzimático de las isomerasas con la clasificación enzimática E.C. 5.x.x.x. Al parecer, la falta de D-aminoácidos en la mureína y ácidos teicoicos vulnera a los organismos Gram positivos y negativos a los antimicrobianos (Radkov y Moe, 2014).
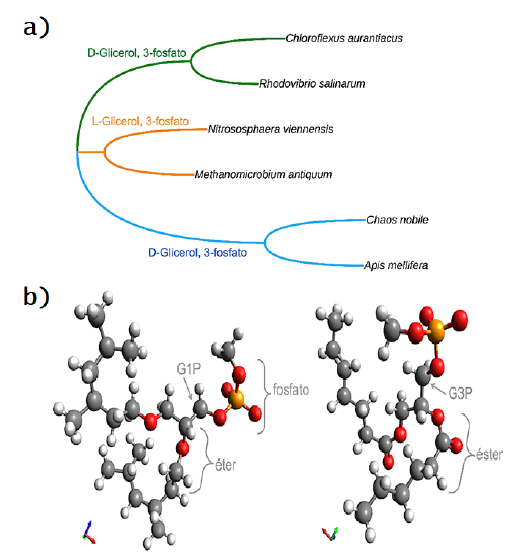
Figura 4. (a) Filogenia realizada con el alineamiento de secuencias de los tres dominios (Bacteria en verde, Archaea en naranja y Eukarya en azul) realizada con 2120 posiciones del gen 16S rrna, el método de máxima verosimilitud y el modelo evolutivo GTR en el programa MEGA X (Kumar y col., 2018). Se señalan los enantiómeros en cada dominio. (b) Estructura química de los fosfolípidos, se señalan los enantiómeros G1P (éter en Archaea) y G3P (éster en Bacteria, Eukarya).
5.3 Complejos proteicos
Es común que las células cuenten con estructuras filamentosas extracelulares (pili y flagelos) e intracelulares (citoesqueleto y flagelos periplásmicos en las espiroquetas), o partículas biológicas como los virus. Algunas de estas estructuras fibrilares están organizadas en hélice, por tanto, con una conformación intrínsecamente quiral. La estructura, al igual que el ensamblaje de las moléculas helicoidales, es producto de una selección por lo que se presenta una homoquiralidad en la célula, tipo celular o un linaje completo (Satir, 2016). Las estructuras vinculadas con la motilidad son ejemplos claros de un polímero helicoidal: el flagelo y las fibras del citoesqueleto. Aun cuando la composición y la estructura del flagelo son distintas entre los tres dominios, el común denominador es también contener fibras helicoidales. El flagelo bacteriano ha sido por mucho el más estudiado y se compone de un tándem de la proteína flagelina unido al cuerpo celular por medio de un gancho para terminar en un cuerpo basal. Una característica de rotación en el cuerpo basal del flagelo le confiere motilidad a la bacteria. La rotación del flagelo en una condición basal o de mínima energía ocurre en contra del sentido del reloj y ésta invierte su sentido a consecuencia de la transducción de señales, por ejemplo, químicas (tóxicos, nutrientes), o físicas (fotones, temperatura).
Otras estructuras fibrosas helicoidales son las proteínas que constituyen el citoesqueleto. La actina y la tubulina son las más extendidas entre los seres vivos. Se suponía que los microfilamentos del citoesqueleto se encontraban únicamente en los tipos celulares complejos (eucariontes), pero también se han encontrado proteínas homólogas a estas dos proteínas en bacterias y arqueas (ej. MreB, Ftsz y Crenactina). La actina y la tubulina están ligadas a la motilidad, y en eucariontes también se asocian con la división celular y la motilidad. Un ejemplo de esto último son los espermatozoides: los microfilamentos están empaquetados helicoidalmente y aportan propulsión y permiten un movimiento de torsión que puede cambiar de sentido, facilitando atravesar la zona pelúcida (Satir, 2016).
Asimismo, en procariontes la torsión de la proteína helicoidal MreB está conservada, lo que implica que el sentido de giro de la proteína helicoidal se define desde la división celular. También, se ha encontrado que la referencia para esta torsión en MreB es la pared celular, que es opuesta a la retícula que forma el péptidoglicano. Es una oposición que se ha encontrado conservada incluso en linajes distantes filogenéticamente (ej. phyla tan distintos como Proteobacteria y Firmicutes) y es crucial para el destino de la forma celular durante la división (Wang y col., 2012), recordando que la pared proporciona el soporte celular. Esta disposición MreB-péptidoglicano no se traslada a eucariontes, porque en éstos las hélices de microfibras (actina como homóloga de MreB) son citoplasmáticas y radiales, sin envolver al bacilo o coco por el interior (periplasma), como ocurre en procariontes. El operón para MreB están también codificadas MreC y MreD, quienes colocan espacialmente a MreB con las proteínas de síntesis del péptidoglicano (ej. transglicosilasas, transpeptidasas) durante la elongación celular.
6 Macromoléculas
6.1 El ADN
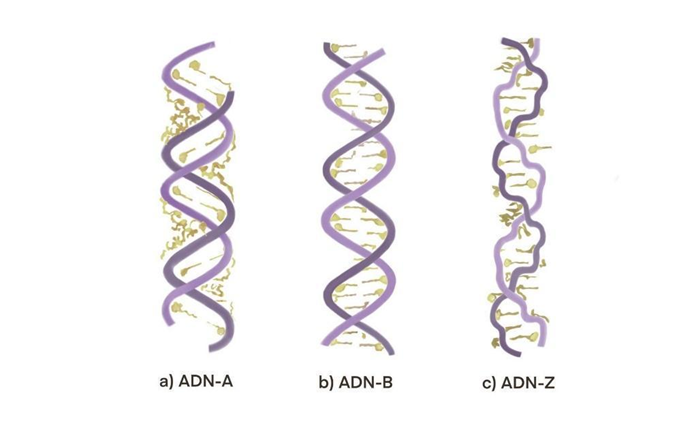
El ADN (ácido desoxirribonucleico) es la molécula fundamental de la vida, y es la que lleva codificada la información genética característica de los diferentes seres vivos. Esta molécula está constituida por una doble cadena con dos hebras compuestas por uniones sucesivas del azúcar desoxirribosa y fosfatos (Martínez-Frías, 2010). En general, existen tres familias principales de hélices de ADN (Figura 5): el ADN-A, que puede formarse fácilmente sólo dentro de ciertos tramos de purinas; el ADN-B que es favorecido por una mezcla de secuencias (aunque la conformación exacta depende de la secuencia particular de nucleótidos); y el ADN-Z que se ve favorecido con la alternancia de pasos purinapirimidina (Ussery, 2002).
Al igual que las proteínas, el ADN existe bajo una sola quiralidad. Únicamente el enantiómero D del azúcar está presente en los ácidos nucleicos, es decir, que la orientación del ADN y el ARN es diestra (en inglés, “right-handed”), por lo que su conformación más estable es una hélice diestra (Globus y Blandford, 2020). Esto es sumamente importante, ya que los organismos vivos se rigen bajo esta preferencia. No obstante, la hélice de la familia ADN-Z presenta una orientación zurda (Ussery, 2002), lo que implica que existen diferentes conformaciones de la hélice de ADN y por lo tanto diferentes funciones biológicas.
En cuanto a características estructurales, el ADN-B posee hebras dobles que corren en direcciones opuestas y una estructura asimétrica con surcos mayores y menores dispuestos de manera alterna, el número de pares de bases por vuelta helicoidal es de 10,5 y la anchura de su hélice es de ~2nm. El ADN-A, por su parte, se ve favorecido en muchas soluciones que están relativamente carentes de agua. A diferencia del ADN-B, su hélice es más ancha (~2,3 nm), el número de pares de bases por vuelta helicoidal es de 11 y el plano de los pares de bases está inclinado unos 20° con respecto al eje de la hélice (Lehninger, Nelson y Cox, 2008).
La estructura del ADN-Z cambia radicalmente en las primeras dos, y la distinción más obvia va a ser una rotación helicoidal hacia la izquierda. La anchura de su hélice es de 1,8 nm, tiene 12 pares de bases por vuelta helicoidal y la estructura parece más delgada y alargada, adquiriendo una apariencia de zigzag. Esta forma de ADN-Z es difícil de observar, ya que presenta una gran inestabilidad (Lehninger, Nelson y Cox, 2008).
En términos de funciones biológicas, el ADN-A juega un rol importante en la transcripción y en las secuencias de Repetición Terminal Larga (en inglés, LTR), como la secuencia encontrada en el virus de inmunodeficiencia humana (VIH). Se ha encontrado que en los genomas existen tramos cortos de purinas que probablemente forman conformaciones de ADN-A en una abundancia mucho mayor de lo que se esperaría para la composición de mononucleótidos, que van desde aproximadamente una cuarta parte del genoma en bacterias hasta casi la mitad del ADN en eucariontes (Ussery, 2002). El ADN-B es dependiente de la secuencia, y si se trata de secuencias rígidas (o flexibles) pueden servir como sitios para la unión a proteínas y la formación de complejos específicos, mientras que el ADN-Z podría jugar un papel importante como potenciador en la transcripción y en la diferenciación terminal. Éste se puede encontrar en procariontes, eucariontes y virus. En algunos genomas de eucariontes se puede presentar el 10% o más regiones con la configuración ADN-Z (Ussery, 2002). En las células vivas, la mayor parte de ADN se encuentra en una mezcla de ADN-A y ADN-B, con algunas regiones pequeñas capaces de formar ADN-Z (Ussery, 2002).
6.2 El ARN
La importancia de la quiralidad en el ARN yace en que la química prebiótica era esencialmente racémica.
El elemento quiral en el ARN es un azúcar que sufre una racemización particularmente rápida bajo las condiciones húmedas y cálidas en las que presumiblemente tuvo lugar la química prebiótica (Sandars, 2005). Su replicación sólo tiene éxito si se utilizan monómeros de nucleótidos homoquirales. En la presencia de monómeros racémicos la replicación es inhibida, por lo tanto, la homoquiralidad precedió al mundo del ARN por un mundo pre-ARN, en el que la selección operaba utilizando algún otro tipo de material genético sin las restricciones quirales del ARN (Bailey, 2000).
De acuerdo con Sandars (2005), al mundo pre-ARN se le conoce como ANP (del inglés “Peptide Nucleic Acid”), cuyos monómeros, además de ser heteroquirales, tuvieron la habilidad de replicarse en una forma más simple y de formar estructuras secundarias como el ARN. El ANP forma naturalmente una hélice, pero la selección de la orientación puede ser aleatoria o se elige por cualquier cambio sutil en el entorno, por lo que se esperaría que se formaran números pares. En el momento en el que el ARN comienza a polimerizarse, la orientación del ANP puede ser forzada por la adición del monómero quiral presente en el ARN. Una vez que ésta se desarrolla, la selección de monómeros adicionales favorece la continuación de la misma orientación quiral (Sandars, 2005).
Sin embargo, la inhibición cruzada enantiomérica por parte del ARN detiene el proceso de polimerización, evitando la formación de polímeros largos. Por ello, Sandars (2005) ha demostrado que bajo ciertas circunstancias la inhibición cruzada enantiomérica podría ser la fuerza impulsora de una bifurcación quiral que conduce a polímeros homoquirales.
Cabe destacar que al polímero le gusta adoptar una forma helicoidal por razones estructurales en ambos casos (ANP y ARN). En el caso del ANP, la elección de orientación es aleatoria o desencadenada por una influencia externa. Por el contrario, el polímero de ARN se ve obligado a adoptar una orientación determinada por la de los monómeros constituyentes (Sandars, 2005). Aunque bien podría no ser éste el sistema que la naturaleza utilizó, representa una posible forma en que la homoquiralidad podría haber evolucionado.
6.3 Clorofilas y bacterioclorofilas
Las clorofilas y bacterioclorofilas son moléculas ópticamente activas con varios centros quirales, necesarios para su función biológica natural y el ensamblaje de sus complejos supramoleculares (Senge y col., 2014). Se trata de tetrapirroles cíclicos con un Mg central, un anillo isocíclico de cinco partes y un alcohol esterificante de cadena larga en el C17 (Patty y col., 2017).
Los átomos centrales de magnesio de las clorofilas (Chls) y bacterioclorofilas (BChls) están en la mayoría de los casos penta-coordinados, dando como resultado la formación de un nuevo centro estereoquímico y la posibilidad de dos tipos diferentes de interacción clorofila-ligando (Senge y col., 2014).
Normalmente las bacterioclorofilas no se presentan como pigmentos “aislados” en forma monomérica y/o libre. En su estado funcional, a menudo están unidas a cadenas laterales de apoproteínas. Esto se facilita mediante ligaduras axiales, las cuales permiten interacciones importantes con el entorno de las apoproteínas, ayudando a la organización de las proteínas clorofílicas y modulando sus propiedades electrónicas (Senge y col., 2014). Al igual que la mayoría de los aminoácidos y las proteínas, cualquier complejo de tetrapirroles que contenga una proteína, incluso aquiral, se vuelve ópticamente activo.
7 Biomoléculas
La vida en la Tierra existe gracias a que las biomoléculas (azúcares y aminoácidos) se encuentran, principalmente, en su forma homoquiral predominante (Breslow, 2011). A las dos imágenes espejo de una molécula quiral se les llama enantiómeros. A los enantiómeros de los aminoácidos y los azúcares se les llama L o D (Cava y col., 2011). Los seres vivos tienen una afinidad exclusiva a los Laminoácidos en la síntesis de proteínas ribosomales, y a los D-azúcares (D-ribosa) en nucleótidos (Sasabe y Suzuki, 2018). Si las proteínas con L-aminoácidos tuvieran enantiómeros D- al azar, éstas tendrían conformaciones variables. Sin embargo, esto no es algo que ocurra en la biología actual debido a que enzimas específicas producen los L-aminoácidos, y lo mismo ocurre con los azúcares (Breslow, 2011).
7.1 Azúcares
Los azúcares tienen una fórmula genérica de CnH2nOn . La mayoría de los azúcares están activos ópticamente debido a que tienen carbonos sustituidos asimétricamente. La posición relativa del primer carbono asimétrico en la cadena del azúcar determina si éste es D o L . Azúcares como la ribosa y la glucosa tienen más de un centro quiral y se clasifican con base en la configuración del centro quiral más alejado del grupo carbonilo (Breslow, 2011).
A los enantiómeros L- de los azúcares se les conoce como azúcares raros debido a que no se encuentran muy seguido en la naturaleza. Sin embargo, estos azúcares raros tienen un gran potencial en las industrias alimentaria y farmacéutica (Chen y col., 2020). Por ejemplo, se han llegado a utilizar como medicamentos antivirales en tratamientos de enfermedades virales graves, como el VIH o la hepatitis (Helanto y col., 2009), y aunque no se han encontrado L-azúcares en procesos biológicos, se han hecho experimentos para determinar si algunos L-azúcares contribuyen al metabolismo energético total (Livesey y Brown, 1995).
7.2 Aminoácidos
Las proteínas se forman a partir de 20 aminoácidos esenciales, éstos son aminoácidos . La estructura general de un aminoácido se conforma por un grupo carboxilo (-COOH) y un grupo amino (-NH2 ) unidos al carbón , que a su vez está unido a un hidrógeno (-H) y a una cadena lateral (grupo R) (Genchi, 2017). Los aminoácidos generalmente tienen un solo centro quiral (Breslow, 2011), que es precisamente el carbono (Figura 6). A los enantiómeros de los aminoácidos se les llama L o D dependiendo de la actividad óptica del isómero del gliceraldehído sobre el que se puede superponer el aminoácido. Ambos enantiómeros se producen por síntesis química, pero la mayoría de las enzimas presentan una selectividad marcada y, debido a esto, muchos procesos bioquímicos utilizan y producen enantiómeros particulares (Cava y col., 2011).
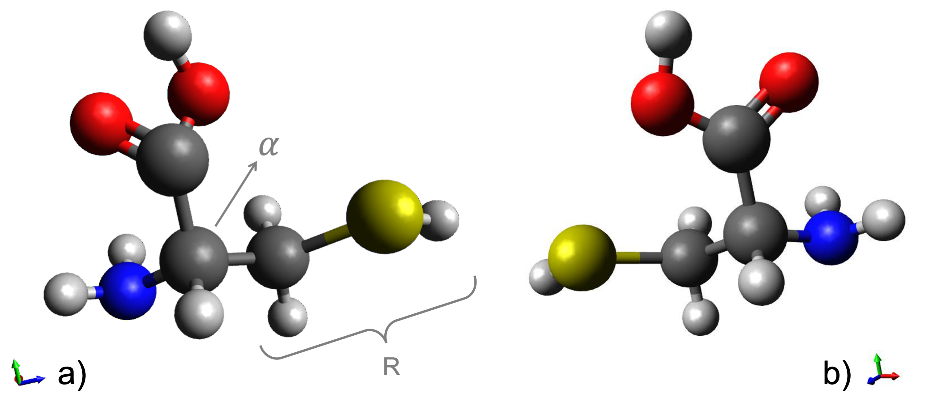
Figura 6. Aminoácido cisteína en sus versiones enantioméricas (imágenes especulares): (a) dextrógira y b) levógira.
Aunque los L-aminoácidos son los más comunes en los organismos vivos, se ha visto que los D-aminoácidos tienen un papel en algunos procesos biológicos, como por ejemplo el D-aspartato, que es un regulador importante de la neurogénesis adulta y la D-serina que actúa como un coagonista de los receptores de glutamato de tipo N-metil D-aspartato en el cerebro, y que están involucrados en el aprendizaje, la memoria, y el comportamiento en mamíferos. También, se sabe que los D-aminoácidos se han utilizado como nutrientes para apoyar el crecimiento bacteriano, regular la germinación de esporas bacterianas, y son componentes de la pared celular bacteriana (Cava y col., 2011).
Existen tres teorías para tratar de explicar la presencia de D-aminoácidos en las proteínas de los seres vivos. La primera es que puede resultar de la incorporación directa de un D-aminoácido a la cadena de péptidos (producido, por ejemplo, por un aminoácido racemasa). La segunda es que se puede deber a una racemización no enzimática asociada al envejecimiento o a alguna enfermedad. Y la tercera es que puede ser por una modificación enzimática posterior a la traducción (Genchi, 2017).
7.2.1 Racemización de aminoácidos
La racemización es una reacción reversible de primer orden que puede describirse mediante la Ecuación 1 (Bada, 1985).
Fue hace más de un siglo cuando se observó por primera vez que los aminoácidos sufrían racemización cuando se calentaban en soluciones altamente ácidas y básicas. A principios del siglo XX, se observó por primera vez la racemización de aminoácidos en péptidos y proteínas en soluciones alcalinas a temperaturas elevadas. La racemización también puede ocurrir en pH neutro y a tasas que son comparables con aquellas bajo un pH ácido y en bases diluidas. Además, la racemización se detecta en proteínas tanto de fósiles como de organismos vivos (ej. mamíferos), por lo que se ha llegado a sugerir que la racemización podría ser la base de un método de fechamiento útil para determinar la edad de los organismos (Bada, 1985).
El aminoácido racemasas y las D-aminoácido oxidasas (DAO) son las enzimas que se encargan de la síntesis y degradación de los D-aminoácidos. Como los L-aminoácidos son los aminoácidos que predominan en los organismos vivos, éstos actúan como el sustrato para la generación de D-aminoácidos, y los racemasas lo que hacen es cambiar la estereoquímica del carbono quiral en los aminoácidos para convertir los L-aminoácidos en D-aminoácidos (Genchi, 2017).
7.2.2 Origen de la homoquiralidad en azúcares y aminoácidos
Los compuestos aquirales pueden cristalizarse en estructuras quirales. Los minerales enantiomórficos, como el cuarzo, son activos ópticamente. Este tipo de minerales, ya sea que provengan del espacio o de la Tierra, pudieron haber servido como criaderos quirales prebióticos debido a la transferencia de quiralidad mediada por la superficie, proporcionando un exceso de L-aminoácidos o D-azúcares en la Tierra prebiótica (Evans y col., 2012).
Generalmente, cualquier reacción química que forma un producto con un centro quiral va a producir cantidades iguales de enantiómeros L y D; esto se conoce como una mezcla racémica. Pero, no siempre ocurre así: el modelo cinético auto catalítico de Frank para una síntesis asimétrica sugiere que un ligero exceso de un enantiómero puede influir y favorecer la síntesis de ese enantiómero sobre su antítesis óptica (Evans y col., 2012). En la actualidad, todavía no se sabe con certeza qué procesos llevaron al cambio de un mundo racémico al mundo homoquiral en el que vivimos (Sasabe y Suzuki, 2018).
En algunos meteoritos que han caído en la Tierra se han encontrado compuestos orgánicos, incluyendo algunos aminoácidos. En la meteorita que cayó cerca de Murchison, Australia en 1969 se encontraron cinco -metil aminoácidos y todos tenían un exceso pequeño pero significativo de lo que se describió como enantiómeros L (o enantiómeros S). Una idea para explicar esto es que en el cinturón de Kuiper se formaron mezclas racémicas de -metil aminoácidos que después fueron descompuestas selectivamente por luz polarizada circular derecha sin blindaje, y los -metil aminoácidos con un exceso de enantiómeros L llegaron a la Tierra por medio de condritas (Breslow, 2011).
7.3 Otras biomoléculas de bajo peso molecular
La talidominda, los antibióticos y las anfetaminas son ejemplos de fármacos con uno o más centros quirales que se indican con los prefijos R y S. Las versiones quirales de la talidomida tienen efectos distintos en el cuerpo humano: la versión S es teratógena y la versión R tiene propiedades tranquilizantes (Elder y col., 2021). Ejemplos de antibióticos son la ofloxacina y su versión R, la levofloxacina (Maia, Tiritan y Castro, 2018). Otro ejemplo es el cloranfenicol, el cual presenta dos centros quirales (hay versiones S,S y R,R) e inhibe la síntesis de proteínas, por tanto, es un antibiótico bacteriostático. Este antibiótico se utiliza solo en países en desarrollo para algunas meningitis y conjuntivitis, sin embargo, su uso es restringido debido a sus efectos tóxicos y el desarrollo de resistencia antimicrobiana.
Algunas enterobacterias pueden degradar el como una estrategia de resistencia microbiana y mediante vías metabólicas no aplicables para el Recientemente se ha encontrado una forma de resistencia a la versión S,S mediante su racemización hacia la forma metabolizable R,R (Elder y col., 2021).
8 Conclusiones
La quiralidad es una propiedad esencialmente geométrica que llega a nuestras manos desde las moléculas y que tiene relevancia fisicoquímica. Los sistemas vivos, desde bacterias a otros organismos unicelulares como los eucariontes y metazoos hasta el comportamiento social tienen esta simetría. Especialmente en sistemas vivos cobra relevancia que la simetría a espejo dé propiedades físicas y químicas distintas. En este aspecto, el origen de la quiralidad en la biología se vuelve una pregunta necesaria de responder.
En esta revisión se intentó resolver y acercar a esta cuestión, desde las propiedades termodinámicas y las emergentes, donde la quiralidad sí tiene cambios relativamente medibles en nuestras simulaciones y algunos de nuestros experimentos. El hecho de que los L-aminoácidos y D-azúcares sean los compuestos fundamentales de la maquinaria evolutiva viva, nos lleva a pensar en mecanismos de evolución molecular y una selección natural molecular. El enfoque desde la biofísica molecular dio algunas respuestas, y por lo mismo se sigue en la búsqueda de la relevancia de la quiralidad en sistemas vivos mediante este tipo de revisiones.