Forma sugerida de citar:
Cáceres-Del Carpio, F.A. y Iannacone, J. (2021). Evaluación del Riesgo Ambiental por los insecticidas Fipronil e Imidacloprid en el Camarón de río (Cryphiops caementarius). La Granja: Revista de Ciencias de la Vida. Vol. 33(1):104-114. http://doi.org/10.17163/lgr.n33.2021.09
1. Introducción
La importación de insecticidas en el Perú aumentó de 3481 tn a 5037 tn entre los años 2007 a 2017 (INEI, 2018), y debido a sus impactos ecológicos en los cuerpos de agua y la afectación a la biodiversidad acuática (Escobar-Chávez et al., 2019; Sotelo-Chávez y Iannacone, 2019), es que el uso de los plaguicidas se regula para la protección de la salud y el medio ambiente por el Servicio Nacional de Sanidad Agraria (MINAGRI, 2020). Actualmente, el fipronil e imidacloprid representan aproximadamente un tercio del mercado mundial de insecticidas (MINAGRI, 2020). El fipronil y el imidacloprid actúan bloqueando la transmisión en el sistema nervioso central, pero cada sustancia química tiene un modo de acción diferente (Al-Badran et al., 2018, 2019). El fipronil interfiere con el paso de iones cloruro al unirse a un sitio específico dentro del receptor de ácido gamma-aminobutírico (GABA), mientras que el imidacloprid se une a los receptores de acetilcolina nicotínicos postsinápticos (nAChR) (Al-Badran et al., 2018). El fipronil (fenilpirazoles) e imidacloprid (neonicotinoides) se aplican sobre plagas agrícolas, plagas domésticas y ectoparásitos de los animales domésticos (Al-Badran et al., 2018, 2019; Escobar-Chávez et al., 2019). En el Perú, en los cultivos agrícolas de arroz y cebolla, los insecticidas fipronil e imidacloprid son ampliamente empleados para el control de plagas (Gangwar et al., 2016; Pathak et al., 2018). En comparación con otros tipos de insecticidas, el fipronil y el imidacloprid se consideran más seguros debido a su baja toxicidad en peces y mamíferos. El fipronil y el imidacloprid son muy efectivos sobre los artrópodos en pequeñas concentraciones (Al-Badran et al., 2018). El incremento de su empleo en décadas recientes, la solubilidad moderada a alta y la persistencia en el agua plantean una seria preocupación con relación a los posibles efectos negativos en los invertebrados acuáticos que no son el objetivo del control (Al-Badran et al., 2019). El camarón de río (Cryphiops caementarius, Molina 1782), es una especie de relevancia biológica, comercial y económica en el Perú, y constituye uno de los componentes hidrobiológicos endémicos que mantiene la pesquería comercial de la costa sur del Perú y norte de Chile (Campos et al., 2017). Se han registrado sus más altas poblaciones en los ríos del departamento de Arequipa (Perú), debido a que estos cuerpos de agua presentan un mayor caudal, además del predominio en esta zona sobre el cultivo de arroz y cebolla. Cryphiops caementarius se emplea en la acuicultura para la alimentación (Reyes-Avalos, 2011, 2018; Romero-Camarena et al., 2013; Campos et al., 2017), sometido a una explotación hidrobiológica alta en el medio natural, al presentarse impactos sobre la destrucción de su hábitat por procesos naturales de sequía, y antrópicos como el empleo del agua, actividades agrícolas y mineras (Wasiw y Yépez, 2017). A la fecha no existe ninguna investigación que evalúe el riesgo ambiental de insecticidas al emplear a C. caementarius como especie bioindicadora (Smit et al., 2015; Al-Badran et al., 2018, 2019). Por lo tanto, el objetivo del presente trabajo fue evaluar el riesgo ambiental de los insecticidas fipronil e imidacloprid en C. caementarius.
2. Materiales y Métodos
2.1 Camarón de río Cryphiops caementarius (Molina, 1782)
Las postlarvas del camarón de río (C. caementarius) fueron obtenidas del río Cañete en el distrito de Calango, Cañete, Lima, Perú (12°31′35″S 76°32′38″O) por un pescador autorizado perteneciente al gremio de pescadores de la zona (Resolución N°83-2007-PRODUCE), Perú. Las postlarvas se obtuvieron en el periodo de ausencia de veda de esta especie (Baltazar y Colán, 2014; Wasiw y Yépez, 2015). Se aclimataron las postlarvas de C. caementarius en el Laboratorio de Larvicultura de la Universidad Científica del Sur (UCSUR), Lima, Perú, dos semanas antes del inicio de los bioensayos y siguiendo el siguiente esquema: cerca de 1000 postlarvas se mantuvieron en un contenedor de 750 L de capacidad con aireación constante a una temperatura promedio de 21±2 °C, suministrando hígado de pollo precocido como alimento cada 24 h para evitar la muerte de los organismos. Se realizó diariamente el cambio de agua, la cual fue previamente declorada empleando tiosulfado de sodio mediante sifoneo (Rice et al., 2017). Para los bioensayos se utilizaron postlarvas de C. caementarius con talla promedio de 15 mm (Baltazar y Colán, 2014). Se usó un calibrador (± 0,1 mm) para medir la longitud total de cada postlarva de C. caementarius al enderezar el cuerpo del camarón cuidadosamente sobre la mesa y midiendo la longitud total desde la punta de la cabeza hasta el final de la cola (Al-Badran et al., 2019).
2.2 Insecticidas
Se empleó el fipronil de la marca Regent SC® a una concentración de 250 g·L-1 y se establecieron siete concentraciones nominales (0,10 µg·L-1; 0,26 µg·L-1; 0,64 µg·L-1; 1,6 µg·L-1; 4 µg·L-1; 0,02 µg·L-1 y 0,04 µg·L-1). Para el imidacloprid se utilizó la marca Imidamin® a una concentración de 350 g·L-1 con cinco concentraciones nominales (28,8 µg·L-1; 71,9 µg·L-1; 179,8 µg·L-1; 449,6 µg·L-1 y 1124 µg·L-1).
2.3 Bioensayos
Se usaron cuatro repeticiones por cada insecticida, más un control. Se colocaron 2 L con agua de dilución a contenedores con una capacidad de 3 L, los cuales se conectaron a un sistema con aireación constante en serie, para cada concentración y repetición. Luego se colocaron 10 ejemplares de postlarva del C. caementarius en cada uno de los contenedores (Escobar-Chávez et al., 2019). El agua que se usó en los contenedores se acondicionó con Nutrafin Aqua Plus® (Hagen, USA). Las postlarvas de camarón de río se alimentaron cada 48 h con arroz cocido para evitar su muerte por canibalismo. Las mediciones de mortalidad e hipoactividad natatoria postlarval (hNPL) se realizaron a las 3h, 8h, 24h, 48h, 72h y 96 h de exposición. Los organismos fueron considerados muertos ante la ausencia total de movimiento durante 2 min luego de tocarse suavemente con la ayuda de un paliglobo. La hNPL se catalogó como la falta de desplazamiento, falta de lucha, ausencia de reacción a estímulos mecánicos, y aletargamiento. La actividad natatoria postlarval normal fue considerada como la búsqueda de alimento, desplazamiento en toda la columna de agua y reacción rápida a estímulos mecánicos.
2.4 Análisis de datos y evaluación del riesgo ambiental
Se determinaron los porcentajes de mortalidad e hNPL de C. caementarius. La concentración letal media (CL50) para la mortalidad y la concentración efectiva media (CE50) para la hNPL fueron calculadas con el programa Probit versión 1,5 con un nivel de confianza al 95% y el modelo de regresión se verificó con el estadístico Chi-cuadrado (x2) (Rice et al., 2017). Los parámetros LOEC (concentración más baja donde se observa efecto) y NOEC (concentración de efecto no observado) se calcularon con el programa estadístico Past 3.2, mediante la prueba de Krustal-Wallis en base a las diferencias significativas entre las mortalidades y las hNPLs para las concentraciones del fipronil e imidacloprid empleadas.
2.4.1 Concentración prevista sin efecto conocido (PNEC)
Se halló la PNEC a partir de la CL(E)50, LOEC y NOEC derivados de los resultados de los ensayos de toxicidad de corta duración. A estos parámetros se le aplicó el “factor de valoración” (FV) o seguridad establecidos para ensayos de toxicidad, el cual fue de 1000 (PNUMA/IPCS, 1999). PNEC = Parámetros de toxicidad /Factor de valoración
2.4.2 Concentración ambiental esperada (PEC)
Se emplearon los estándares de calidad ambiental (ECA) de la legislación de los Países Bajos para el fipronil (Tennekes, 2018) y para el imidacloprid (Smit et al., 2015), presentando los ECA del imidacloprid dos escenarios. Escenario 1: ECA a corto plazo, de concentración máxima aceptable (MAC-ECA) basado en datos de toxicidad aguda. Escenario 2: ECA a largo plazo, expresado como una concentración promedio anual (AA-ECA) basado en datos de toxicidad crónica con el objetivo de proteger el ecosistema contra los efectos adversos resultantes de la exposición a largo plazo (EC, 2011).
2.4.3 Caracterización del riesgo (PEC/PNEC)
Se calculó el cociente de riesgo (CR), que establece que si la PEC/PNEC es<1 se considera que el fipronil e imidacloprid evaluados son de bajo riesgo; mientras que cuando PEC/PNEC >1, se considera un alto riesgo (De la Torre et al., 2004). CR = PEC /PNEC
3 Resultados
La mortalidad y la hNPL aumentan desde las 3 h hasta las 96 h de exposición en las postlarvas de C. caementarius que presentaron a las 96 h de exposición un mayor efecto en el fipronil, llegando al 100% de mortalidad y de hNPL. Para el imidacloprid se alcanzó un 87,5% y 100% para la mortalidad y el hNPL, respectivamente. Se obtuvieron los valores de la CL50 y CE50 para los insecticidas fipronil con sus límites superiores e inferiores al 95% desde las 3 h hasta las 96 h de exposición, y sus respectivos coeficientes de determinación (R2) (Tablas 1 y 2). De igual forma se observan los parámetros de LOEC y NOEC para el fipronil e imidacloprid desde las 3 h hasta las 96 h de exposición en las postlarvas de C. caementarius (Tabla 3 y 4).
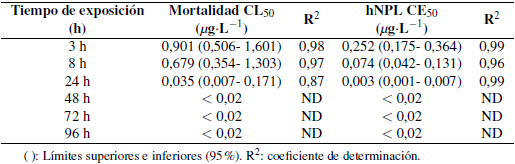
Tabla 1. Concentración letal media (CL50) y Concentración efectiva media (CE50) y límites superiores e inferiores para parámetros letales y subletales en base a la hNPL (hipoactividad natatoria) en Cryphiops caementarius para el fipronil a seis diferentes tiempos de exposición.
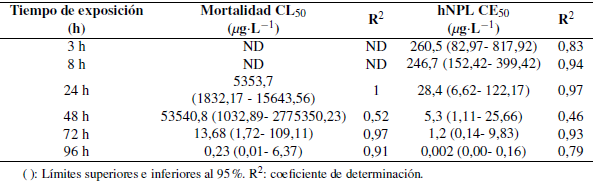
Tabla 2. Concentración letal media (CL50) y concentración efectiva media (CE50) y límites superiores e inferiores para parámetros letales (mortalidad) y subletales en base a la hNPL (hipoactividad natatoria) en Cryphiops caementarius para el imidacloprid a seis diferentes tiempos de exposición.
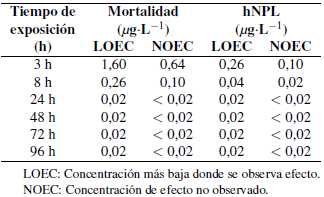
Tabla 3. Concentración más baja donde se observa efecto (LOEC) y concentración de efecto no observado (NOEC) para parámetros letales (mortalidad) y subletales en base a la hNPL (hipoactividad natatoria) en Cryphiops caementarius para el fipronil a seis diferentes tiempos de exposición.
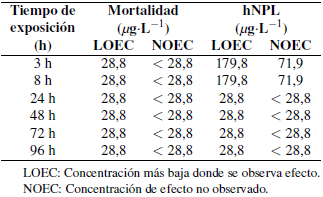
Tabla 4. Concentración más baja donde se observa efecto (LOEC) y concentración de efecto no observado (NOEC) para parámetros letales (mortalidad) y subletales en base a la hNPL (hipoactividad natatoria) en Cryphiops caementarius para el imidacloprid a diferentes tiempos de exposición.
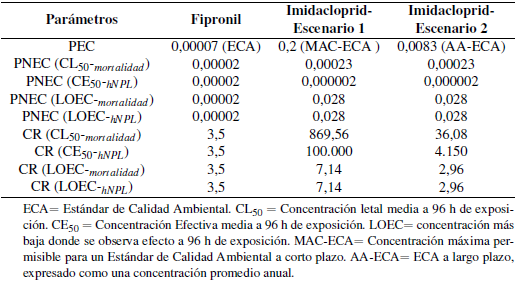
La Tabla 5 muestra los valores que establecen la relación entre la PEC y el PNEC para determinar el riesgo existente de los insecticidas, basados en los parámetros PNEC-CL50-mortalidad, PNEC-CE50-hNPL, PNEC-LOEC-mortalidad y PNEC-LOEC-hNPL. Para el fipronil y para el imidacloprid se obtuvieron valores de CRs mayores a uno en todos los casos (Tabla 5). El imidacloprid presentó un mayor riesgo para el ambiente acuático que el fipronil para la respuesta letal (mortalidad) y subletal (hipoactividad natatoria postlarval).
4 Discusión
No se han realizado bioensayos de toxicidad con el fipronil y el imidacloprid en C. caementarius, pero se observan investigaciones con otras especies de crustáceos acuáticos (Goff et al., 2017; Al-Badran et al., 2019). C. caementarius presentó efectos en la mortalidad y en la hipoactividad natatoria (hNPL) para ambos insecticidas, en la hNPL se manifestó falta de reacción ante estímulos brindados, reducción del movimiento y nado extraño, los resultados obtenidos variaron con las concentraciones y tiempos de exposición en ambos insecticidas (Mendoza-Rodríguez, 2009). Shan et al. (2003) encontraron para el fipronil en Macrobrachium rosenbergii (De Man, 1879) y Macrobrachium niponnensis De Haan, 1849, valores de CL50 (24 h) de 6,41 µg·L-1 y > 25,70 µg·L-1, respectivamente. C. caementarius fue más sensible al fipronil que las dos especies de Macrobrachium con un valor de CL50 de 0,035 µg·L-1 a las 24 h de exposición. Las diferencias en las CL50 obtenidas, pueden deberse a los diferentes protocolos empleados en los bioensayos, donde Shan et al. (2003) realizaron una simulación de los campos de arroz en condiciones de laboratorio. También estas diferencias pueden ser explicadas por los patrones específicos de biodistribución, a las tasas de metabolización, o incluso a la sensibilidad específica de cada taxón objetivo (Chaton et al., 2002). El fipronil e imidacloprid en Palaemonetes pugio Holthuis, 1949 a las 96 h de exposición obtuvo una CL50 de 0,68 µg·L-1 para las larvas y una CL50 de 0,32 µg·L-1 para los adultos ante el fipronil, y para el imidacloprid fue significativamente más tóxica en las larvas (CL50 de 308 µg·L-1) que en los adultos (CL50 de 563,5 µg·L-1) (Key et al., 2007). En el caso del C. caementarius, la exposición al fipronil y al imidacloprid a las 96 h de exposición para la mortalidad en postlarvas de camarón evidenció diferencia con la investigación de Key et al. (2007). Se hallaron también los parámetros de LOEC y NOEC para la mortalidad, los cuales fueron de 0,02 µg·L-1 y <0,02 µg·L-1 a las 96 h de exposición para el fipronil, y de 28,8 µg·L-1 y <28,8 µg·L-1 (96 h) para el imidacloprid, respectivamente. Key et al. (2007), encontraron valores de menor toxicidad para P. pugio que los de la presente investigación. El fipronil presentó mayor toxicidad letal que el imidacloprid en base a la CL50 C. caementarius a 96 h de exposición. Omar et al. (2016), en Marsupenaeus japonicus (Spence Bate, 1888), encontraron efectos variables de acuerdo al estadio de desarrollo ensayado. La mayor toxicidad letal del fipronil en comparación al imidacloprid se ha observado en otras especies de crustáceos decápodos como Farfantepenaeus aztecus (Ives, 1891; Al-BadranI et al., 2019). Penaeus monodon Fabricius, 1798 fue sometido al fipronil y al imidacloprid en el estadio de postlarvas a las 48 h de exposición, encontrando valores de CL50 de 0,2 µg·L-1 y 175 µg·L-1, respectivamente (Hook et al., 2018). Los artrópodos se encuentran entre los taxones más sensibles al fipronil, y las especies relacionadas pueden tener sensibilidades muy variadas a este insecticida (Stevens et al., 2011), y esto se debe a que el fipronil puede ser más tóxico una vez metabolizado, debido a que el sulfuro de fipronilo y la sulfona de fipronilo son generalmente dos a tres veces más tóxicos que el compuesto original (Weston y Lydy, 2014). Asimismo, existe una gama muy amplia en la sensibilidad de los crustáceos al imidacloprid, con valores de CL50 que varían de 1 a 52 500 µg·L-1 (Smit et al., 2015). Se han observado efectos subletales por acción del fipronil e imidacloprid en el comportamiento, fisiología, reproducción y desarrollo de invertebrados acuáticos no destinatarios (Al-Badran et al., 2018; Sohn et al., 2018). Para el parámetro subletal de hNPL, se encontró una CL50 en un rango de 260,5 µg·L-1 a 0,002 µg·L-1, entre las 3 h y 96 h para el imidacloprid y un rango de 0,252 µg·L-1 y <0,02 µg·L-1 obtenidos entre las 3 h y 96 h de exposición para el fipronil. El fipronil, a diferencia del imidacloprid, causó nado errático en todas las direcciones o convulsiones y reacción inmediata ante el estímulo del movimiento, mientras que ante el imidacloprid las postlarvas presentaron aletargamiento, disminución del nado en la columna de agua, y reacción tardía ante la estimulación del movimiento. Para ambos insecticidas se presentó lucha por el alimento, ausencia total del desplazamiento antes de la muerte, pese al intento de nado que se reflejó en la movilidad de los apéndices locomotores. Al-Badran et al. (2019) encontraron cambios en el comportamiento de F. aztecus por acción del fipronil e imidacloprid bajo diferentes tiempos de exposición en dependencia de las concentraciones. El imidacloprid redujo el comportamiento de defensa del crustáceo Orconecres rusticus (Sohn et al., 2018). En el presente trabajo el imidacloprid presentó mayores efectos subletales que el fipronil. Los diferentes efectos que presentaron las postlarvas ante ambos insecticidas se deben a los modos de acción de cada uno. El fipronil es un antagonista del GABA que provoca hiperexcitación y convulsiones; mientras que el imidacloprid es un antagonista del nAChR que causa una variedad de síntomas desde hiperexcitación hasta letargo y parálisis (Cox et al., 1998; Al-Badran et al., 2019). Para los ingredientes activos del fipronil e imidacloprid, los resultados obtenidos con el CR de corta duración muestran la existencia de un riesgo ambiental y concuerda con los estudios de Van der Sluijs et al., (2014), que muestran los riesgos para la biodiversidad y el funcionamiento del ecosistema por el uso generalizado de neonicotinoides como el imidacloprid y fipronil. Se han encontrado que muestras tomadas en aguas subterráneas y superficiales superan los límites basados en los umbrales ecológicos establecidos en diferentes países de América del Norte y Europa, lo cual indica que existen en los suelos, las vías fluviales y las plantas en entornos agrícolas, urbanos y en áreas de drenaje que están contaminadas con mezclas de fipronil, neonicotinoides o sus metabolitos (Bonmatin et al., 2015). Van der Sluijs et al. (2014) muestra una creciente evidencia que estos insecticidas representan un alto riesgo para una amplia gama de taxones de invertebrados no objetivos, lo cual tendría un impacto en las cadenas alimenticias acuáticas. Los plaguicidas pueden ser lixiviados en zanjas y ríos por las lluvias, y las aguas superficiales se pueden contaminar con un rociado directo, mediante la escorrentía y lixiviación de los campos agrícolas (Vijver et al., 2014). La emisión a las aguas superficiales del fipronil e imidacloprid están originadas por muchos factores, como la distancia del cultivo a la zanja, modo de aplicación, condiciones climáticas, etc. Esto supone una preocupación si no se siguen ciertos protocolos de aplicación o se desconocen los efectos potenciales en los ecosistemas acuáticos (Stoorvogel et al., 2003; Pisa et al., 2015), tal es el caso del camarón de río, el cual con frecuencia se encuentra en ríos cercanos a los campos de arroz, donde el fipronil e imidacloprid son de amplio uso (Wasiw y Yepez, 2017). Se han publicado varios estudios de laboratorio sobre la toxicidad del imidacloprid en una variedad de invertebrados acuáticos y el organismo de prueba estándar, Daphnia magna Straus, 1820, quien es menos tóxico a los neonicotinoides (imidacloprid) en comparación a otros invertebrados (Beketov y Liess, 2008; Escobar-Chávez et al., 2019). Una CL50 aguda de alrededor de 7 000 µg·L-1 representa varios órdenes de magnitud por encima de las concentraciones efectivas encontradas para otros invertebrados. Esto implica que no siempre D. magna se puede utilizar como un organismo de prueba sensible y protector para toda la trama trófica acuática, a diferencia de C. caementarius que evidenció una mayor sensibilidad (Ngim y Crosby, 2001). Aunque no se cuenta con información disponible de la toxicidad de estos insecticidas en el C. caementarius, existen estudios como el de Van Dijk et al. (2013), donde se evaluó la abundancia de macroinvertebrados acuáticos y las concentraciones de imidacloprid en aguas superficiales. Se observó que la abundancia de macroinvertebrados disminuye al aumentar la concentración del imidacloprid en el medio acuático (Beketov et al., 2013). De acuerdo a las magnitudes del nivel de riesgo obtenidos de la literatura (i.e. RQ ≥ 1 de alto riesgo, 0,1 ≤ RQ <1 de riesgo medio, 0,01 ≤ RQ <0,1 de bajo riesgo) (Sanchez-Bayo et al., 2002), los dos insecticidas presentaron un alto riesgo al ecosistema acuático en base a los efectos letales y subletales de C. caementarius. En general, los resultados de la presente investigación y de la literatura publicada indican que ambos insecticidas tienen el potencial de causar daños significativos a los ecosistemas acuáticos al causar efectos negativos en individuos y poblaciones de invertebrados acuáticos en concentraciones muy bajas (Chaton et al., 2002). Para C. caementarius existiría un mayor riesgo en los periodos de diciembre a marzo y según la normatividad peruana, esta especie se encuentra en periodo de veda, debido a que durante esta etapa se observa una mayor presencia de huevos y hembras ovígeras (Baltazar y Colán, 2014).
5 Conclusiones
El bioindicador C. caementarius permite evaluar el riesgo ambiental del fipronil y el imidacloprid en el ecosistema acuático al emplear el cociente de riesgo a 96 h de exposición en base a la mortalidad en la respuesta letal, así como a la mortalidad y la subletalidad en base a la hipoactividad natatoria. El imidacloprid presentó un mayor riesgo para el ambiente acuático que el fipronil para la respuesta letal (mortalidad) y subletal (hipoactividad natatoria postlarval). La diferencia tóxica observada entre ambos insecticidas pudiera deberse a sus diferentes modos de acción. Este invertebrado nativo del Perú, C. caementarius, debería ser considerado como una especie sensible al momento de definir un ECA para la conservación del ambiente acuático, sobre todo en los periodos de enero a marzo, en las que según la normatividad peruana esta especie se encuentra en veda. Por ende, es recomendable continuar monitoreando la presencia de estos insecticidas en los cuerpos de agua dulceacuícolas costeras, y reducir el uso del fipronil y del imidacloprid en los cultivos agrícolas que los emplean.