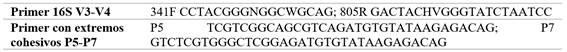INTRODUCCIÓN
La acuicultura ha experimentado un rápido aumento en la producción debido a la alta demanda del mercado, lo que ha generado diversas problemáticas ambientales como destrucción de hábitats naturales, contaminación del agua o uso excesivo de recursos [1]. Ecuador se destaca como uno de los principales países productores y exportadores de camarón [2], en donde la actividad de cultivo comenzó a desarrollarse a fines de la década de los sesenta en la provincia de El Oro [3]. Para el 2015, las exportaciones de camarón ya habían superado las 35 000 toneladas al mes [4] y el valor total de las exportaciones de camarón alcanzó la cifra de 1 871.90 millones de dólares, registrando aumentos trimestrales del 16%, principalmente debido a la creciente demanda de China [5].
Cabe destacar, que el aumento por la intensificación de la producción acuícola implica el uso de mayores cantidades de insumos, incrementando así, la generación de residuos provenientes de los sistemas de producción [6]. En los alimentos destinados al camarón, existe un contenido de proteína cruda entre un 30% y 40%, del cual, tan solo se aprovecha hasta un 25%, dependiendo de la digestibilidad que puede verse afectada por factores como la cantidad de fibra bruta en la dieta y la salinidad del agua [7], lo que influye significativamente en la relación de materia seca en los alimentos para camarones y conlleva a la acumulación de residuos orgánicos en el sistema de cultivo [8].
Además, en la producción del camarón, no se aprovecha totalmente los alimentos, lo que resulta en la generación de hasta 50 g de nitrógeno amoniacal por cada kilogramo de alimento utilizado, contribuyendo a las concentraciones de amoníaco, nitrito y sulfuro de hidrógeno en el agua de cultivo [8, 9].
Por tanto, los residuos de esta alimentación del camarón conjuntamente con los de fertilizantes, heces fecales y fitoplancton muerto da a la acumulación de materia orgánica (MO) que se depositan en el fondo de las piscinas camaroneras como sedimentos o lodos [10]. Si bien, la fauna bentónica que habita en el fondo de los cuerpos de agua participa en la descomposición de estos residuos como fuente para su alimentación y reciclaje de la materia orgánica, pero en ciertas ocasiones cuando los residuos saturan el ecosistema se reduce los niveles de oxígeno, por lo que este proceso se dificulta, disminuyendo la calidad del agua y sedimento [11]. Asimismo, el incremento de la producción de sedimentos en las piscinas del cultivo se debe a la acumulación de residuos orgánicos, estos sedimentos contienen altos niveles de nutrientes como fósforo y nitrógeno [9], que provienen de los alimentos ricos en estos elementos, así como del uso de suplementos vitamínicos y estimulantes nutricionales destinados a satisfacer las necesidades alimenticias del camarón [12].
La presencia de MO en el cultivo de camarón podría tener un impacto negativo en la salud y en el rendimiento de la producción, ya que, al disminuir los niveles de oxígeno hace que el camarón sea más vulnerable para adquirir enfermedades ante la gran variedad de microorganismos benéficos como agentes patógenos presentes en el sedimento. Entre estos microorganismos infecciosos se destacan el virus de la Mancha Blanca (WSSV) y una importante enfermedad bacteriana conocida como hepatopancreatitis necrotizante [13]. Esta bacteria necrotizante puede provocar enfermedades durante la fase larvaria, afectando la hepatopáncreas del camarón infectado, generando así, pérdidas económicas significativas debido a la mortalidad del producto [14].
Desde la Perspectiva Mundial sobre los Humedales, se calcula que la extensión total de 12,1 millones de kilómetros cuadrados ha disminuido significativamente, registrando una pérdida del 35 % desde el año 1970; a causa de las diversas actividades antropogénicas entre ellas, la producción del camarón [15, 16]. A partir del contexto dado, las piscinas camaroneras que se encuentran en el Humedal “La Segua” son un ejemplo de esta problemática a pesar de, que se considera un área protegida para la conservación de especies y soporte de vida, están afectando a la dinámica del lugar [17]. No obstante, hace unos 85 años, la Segua era parte del estuario del río Chone, pero con la deforestación en cuencas altas y al acarreo de grandes volúmenes de sedimentos por actividades productivas del camarón o por la construcción de las piscinas se ha separado del estuario [18]. Además, las descargas de los efluentes contienen gran cantidad de MO con contenidos de nitratos (3,6 mg/l) y fosfatos (0,25 mg/l) que causa una disminución gradual en la calidad de los cuerpos de agua [19], y representa una amenaza para la integridad del ecosistema, resultando en pérdidas de flora y fauna en diversas áreas de conservación [20].
Por otro lado, el uso indiscriminado del agua como consecuencia de la actividad camaronera está afectando a la sostenibilidad del Humedal La Segua [ 21] y consecuentemente, se desencadenan otros problemas ambientales en relación a reducción de los volúmenes de agua, como son migración de las especies que se hospedan en temporadas de anidación y contaminación por sólidos sedimentables, además de la pérdida del suelo por las construcción de las piscinas camaroneras [22]. Una herramienta efectiva para mitigar problemas ambientales como la generación de sedimentos tóxicos, es el uso de microorganismos naturales, que descomponen contaminantes, transformándolos en sustancias menos tóxicas o inofensivas para el entorno [23]. Este método biotecnológico se conoce como biorremediación, el cual consiste en el empleo de organismos vivos para remediar sitios contaminados, este se destaca como una técnica rentable y ecológicamente amigable [24].
En el contexto de la acuicultura, la integración de bacterias biorremediadoras se presenta como una solución innovadora y eficaz para conservar la calidad del agua, gestionar la acumulación de nutrientes y compuestos tóxicos, y prevenir enfermedades [23, 25]. Estas bacterias ofrecen una alternativa sostenible para abordar los desafíos ambientales derivados del crecimiento de la acuicultura, promoviendo prácticas más responsables y sostenibles en esta industria en expansión [26].
Actualmente, los procesos de biorremediación aplican bacterias de distintas cepas y géneros como Bacillus o Cianobacterias, que destacan por su amplia distribución global, fácil cultivo en laboratorio y su importancia en la biosíntesis de metabolitos relevantes en la actualidad, como bioplásticos, péptidos antimicrobianos, enzimas y bioinsecticidas [27]. Los Bacillus, por ejemplo, logran una eficiencia hasta el 98% en la transformación de contaminantes nitrogenados como nitratos y nitritos en compuestos menos tóxicos o inocuos [23], reducen los niveles de dióxido de carbono (CO2) y MO residual [28], reciclan nutrientes disponibles y consumen sedimentos, ayudando a mantener la calidad del agua del cultivo en términos de carbono orgánico, sólidos en suspensión, fosfatos y especies nitrogenadas [29]. La importancia de la identificación de la diversidad bacteriana presente en el sedimento debido a la actividad camaronera en el humedal La Segua, permitirá reconocer qué tipo de interés experimental puede generar la aplicación de las bacterias en procesos de biorremediación que se realicen en este campo de investigación para futuros ensayos, mediante técnicas microbiológicas convencionales o identificación molecular basado en el análisis de ARNr 16S que posee mayor precisión [30, 31].
El estudio tiene como objetivo: analizar los parámetros fisicoquímicos e identificar los tipos de bacterias presentes en los sedimentos de la piscina camaronera, con el fin de diagnosticar el estado actual del sedimento debido al impacto de la producción camaronera sobre el Humedal La Segua.
MATERIALES Y MÉTODOS
Ubicación
La investigación se llevó a cabo en una piscina camaronera del Humedal La Segua situada en Chone, Manabí (Fig. 1) debido a que el recurso hídrico que contiene el ecosistema es utilizado para la producción camaronera y luego es devuelta al humedal natural, sin pasar por los tratamientos correspondientes para aguas residuales con sedimentos. Las coordenadas geográficas del lugar de estudio son 00°42'S 080°12'W [32] y su altitud es de 10-12 msnm y una temperatura de 26 a 27Cº [33].
Técnica e instrumentos de recolección de datos
Para un diagnóstico actual de la producción camaronera de la zona en estudio se elaboró un diagrama de procesos teniendo en cuenta la infraestructura utilizada, los residuos generados, tratamientos, fertilizantes de uso y otros aspectos relevantes del tema de estudio [34]. Para la obtención de información respecto a la actividad camaronera y su impacto en la generación de sedimentos se aplicó entrevistas, semiestructuradas [35], basadas en 3 ejes temáticos: información general (eje 1), de producción (eje 2) y aspectos ambientales (eje 3), que configuraron alrededor de 15 preguntas.
Toma de muestra de sedimento
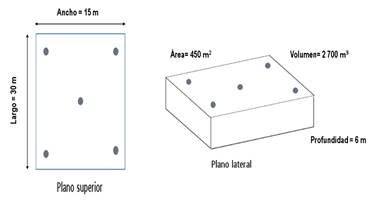
Para la recolección de muestras de sedimento se tuvo en cuenta los puntos representativos de la piscina camaronera expuesta en la Fig. 2, mediante el método de bandera inglesa [36]. Se establecieron cinco cuadrantes de 100 m2 en cada esquina y en el centro respectivamente, de cual, en cada cuadrante se tomaron 3 muestras, obteniendo un total de 15 muestras del sedimento localizado en el fondo de las piscinas camaroneras.
Cabe destacar, que los puntos de muestreo deben estar siempre cubiertos por el agua o mayormente permanecer así [37]. Las 15 muestras fueron recolectadas en vasos esterilizados de 50 ml de manera manual, en donde cada muestra fue de 100 g de sedimentos. Las muestras de sedimentos se homogenizaron en cada uno de los cuadrantes, luego se colocaron en bolsas herméticas de plástico estéril con su respectivo código. Estas se almacenaron dentro de una hielera a una temperatura de -20 °C con la finalidad de disminuir la actividad biológica [38, 39] durante su transporte hacia al laboratorio de Química Ambiental ubicado en las instalaciones de la ESPAM, lugar donde se realizó el respectivo análisis fisicoquímico de las muestras.
Análisis fisicoquímico del sedimento
A partir de la muestra obtenida se evaluó el contenido de los sedimentos en función a la Norma Oficial Mexicana NOM-021-RECNAT-2000 sobre especificaciones de fertilidad, salinidad y clasificación de suelos, en la cual, se tiene en cuenta los parámetros de: MO (materia orgánica) en %, nitrógeno total en mg/l, fósforo disponible en mg/l, carbono orgánico en mg/l; pH, temperatura en °C, conductividad eléctrica en µS/cm y color en Pt-Co (Platino-Cobalto) [40]. Cabe destacar, que se consideró esta Norma Mexicana debido a que Ecuador no cuenta con alguna legislación específica que permita regular y monitorear los valores de criterios permisibles para los lodos o sedimentos generados por la producción acuícola y agrícola, en este caso, enfocado específicamente la actividad productiva del camarón.
Análisis de perfil taxonómico de las bacterias
Para el análisis del perfil taxonómico para las bacterias de la región 16S se lo realizó mediante secuenciación de alto rendimiento. Se tomó 500 mg de muestra compuesta del sedimento con ayuda de un core sampler para luego ser transportado a laboratorio y realizar la extracción de ADN por métodos convencionales como lisis celular y purificación del ADN. Con ello, se verificó la calidad del ADN mediante lectura espectrofotométrica en nanodrop con una integridad en gel de agarosa al 1% por electroforesis [41].
Además, el análisis de calidad y creación de librerías en Miseq NGS se aplicó lecturas pair end de 300 bp del lado forward y reverse. Se requirieron los primers 16S V3-V4 con extremos cohesivos P5-P7 para la adición de primers y códigos de barras de Nextera (Tabla 1) [42].
Todas las lecturas obtenidas fueron limpiadas, ensambladas, contabilizadas utilizando software bioinformático. Las secuencias finales fueron identificadas mediante BLAST en Base de datos Silva 138 [31]. Los resultados de la taxonomía de las bacterias están dados bajo discos de Krona.
RESULTADOS Y DISCUSIÓN
Diagnóstico actual de la actividad camaronera en el Humedal La Segua
Aunque las piscinas camaroneras se encuentran ubicadas en una zona de protección en categoría de Humedal, perteneciente a la lista de la Convención Ramsar [43] y esté normado legalmente en el Código Orgánico del Ambiente, no existe el control ambiental pertinente para la actividad económica como, por ejemplo, la regulación del uso del agua y la expansión de las construcciones de piscinas para la cría de los camarones en donde debería estar bajo un manejo sostenible según lo estipula la legislación ecuatoriana [21].
En las piscinas camaroneras, generalmente, los sedimentos reciben tratamiento sin el previo análisis fisicoquímico correspondiente, por lo que, este proceso de descontaminar el lodo solo se da de manera empírica por parte de los acuicultores. Por eso, cada tipo de lodo requiere un tratamiento específico de acuerdo a sus niveles de concentración y posible agente contaminante como, por ejemplo, microorganismos patógenos, excedentes de nutrientes o incluso metales pesados, de allí, la importancia de caracterizar el sedimento antes de la aplicación de un tratamiento físico, químico o biológico [44].
Cabe destacar que, la actividad camaronera genera ingresos económicos a una población de más de 1500 habitantes incidiendo en desafíos significativos en cuanto a la sostenibilidad del Humedal [2]. Entre las problemáticas que se relacionan con la conservación del espejo de agua están el uso de suelo, control y gestión del agua y el manejo de los demás recursos naturales del ecosistema [45].
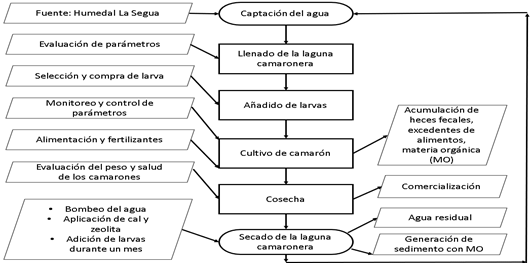
En la Fig. 3, se demuestra el proceso que conlleva la producción de camarones ubicadas en el Humedal La Segua en donde, la creciente preocupación de la actividad económica se sitúa en la generación de sedimentos con contenidos de nutrientes, fertilizantes y otros productos derivados del cultivo del camarón [46]. El enfoque de los tratamientos hacia los volúmenes de sedimentos y aguas residuales, es otra problemática ambiental, puesto que, en la mayoría de las ocasiones es devuelto al humedal mediante recirculación, sin haber obtenido tratamiento físico, químico o biológico para disminuir la carga contaminante y evitar así los daños ambientales hacia los ecosistemas.
Para el manejo del sedimento, los productores aplican durante 8 días cal y zeolita sobre el lodo, dependiendo del pH y humedecen en las orillas con agua durante un mes para desvivir cualquier patógeno y así, evitar olores desagradables [47]. El proceso del encalado (cal) permite neutralizar aquellos ácidos, sin embargo, este proceso debe ser aplicado de acuerdo a los resultados que se emiten en un análisis de suelo o sedimento [48]. No obstante, ese sedimento no se reduce, sólo se lo neutraliza y se va acumulando en el fondo de las piscinas camaroneras o en el humedal, debido a la devolución del agua residual hacia la fuente.
La piscina camaronera debe cumplir con criterios específicos para asegurar una producción óptima, estos incluyen la adecuada preparación del terreno, la estabilización de los muros para evitar filtraciones, extensas superficies que varían desde 1 hasta 10 ha con una profundidad de 1,5 a 2 m dependiendo del sistema de producción [49]. En este ecosistema, el recurso hídrico proviene del humedal La Segua, mediante bombeo y se dispone de sistemas aireadores para asegurar las condiciones óptimas de oxígeno en las piscinas camaroneras.
Para la cosecha, el camarón debe alcanzar un peso ideal de 20 a 30 gramos en un periodo de 3 a 4 meses de producción y estar libre de enfermedades [50] Sin embargo, en el lugar de investigación, el peso promedio es de 10 a 12 gramos. Posiblemente la causa de no alcanzar el peso deseado del camarón implique la mayor intensidad de cría, que presenta desafíos como el aumento de costos de alimentos, la calidad inconsistente de los piensos y problemas sanitarios y medioambientales. Es crucial optimizar el crecimiento y los rendimientos, minimizando las enfermedades y evitando los efectos negativos de los quimioterapéuticos sobre el cultivo del camarón [51].
Por otra parte, la producción de camarón en la zona de estudio ha disminuido por varios factores, entre ellos: la reciente inundación en febrero del 2024, que afectó al cantón Chone por las intensas lluvias [52]. Como consecuencia, los sedimentos generados por esta actividad económica son arrastrados por escorrentía hacia el fondo del humedal, lo que disminuye la capacidad de almacenamiento para aguas lluvias y provoca así inundaciones en las piscinas camaroneras y, por ende, pérdidas de la producción por desbordamiento y erosión en los bordes la infraestructura camaronera. [53]. Asimismo, estos sedimentos contienen heces fecales, alimentos no consumidos, exceso de nutrientes y otros aditivos que perjudican al crecimiento del camarón debido al cambio de la calidad de agua al incrementar la turbiedad y reducir la demanda de oxígeno disuelto [54].
Análisis de los parámetros fisicoquímicos del sedimento
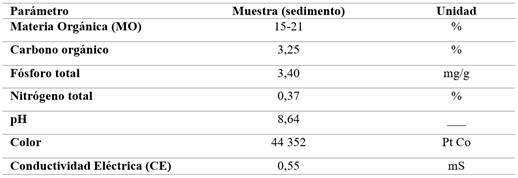
A través de la muestra compuesta obtenida del fondo de la piscina camaronera, se llevó el sedimento a laboratorio en condiciones controladas para realizar su respectiva caracterización fisicoquímica expuesta en la Tabla 2, obteniendo los siguientes resultados:
Respecto al contenido inicial de materia orgánica (MO) en la muestra de sedimento se obtuvo un rango de 15-21% (Tabla 2) lo que es típicamente alto en comparación con lo establecido con la Normativa Oficial Mexicana NOM-021-RECNAT-2000, donde se establece que para suelos no volcánicos (es decir, suelos minerales como arenosos, arcillosos, franco-arenosos) es un valor >6.0 considerándose muy alto. En comparación con la investigación de acumulación de MO en manglares de estuario río Esmeraldas también se presentó un porcentaje alto de 11,01% de MO, lo que se relaciona por la acumulación de detritos orgánicos que se descomponen de manera lenta por condiciones anaeróbicas, además de saturase con sedimentos proveniente de ríos u otras corrientes de agua [55].
El contenido de la MO representa la abundancia en residuos orgánicos como hojas, ramas o flores que se depositan en la piscina camaronera, alta productividad biológica como fuente de microorganismos benéficos y no benéficos alimento no consumido y excrementos dado por la producción de los camarones [56]. La MO en el material sedimentable de las piscinas camaroneras conlleva implicaciones ecológicas importantes que influyen en la estructura trófica del ecosistema, afectando a la producción del camarón [57]. Por ello, es importante recalcar la participación de bacterias y otros microorganismos permiten descomponer de manera biológica a los detritos orgánicos y a su vez, sirven como una fuente de energía para este proceso biológico [58].
En contraste con otras investigaciones sobre contenido de MO en suelo de camaroneras se obtuvieron porcentajes de 2.20 y 2% siendo valores bajos en comparación con lo obtenido en este estudio, lo que indica mayor generación de sedimentos en las piscinas camaroneras ubicadas en el humedal La Segua [59] debido a la intensificación de la actividad productiva.
En un estudio llevado a cabo en el año 2006, en el humedal La Segua, basado en imágenes satelitales, se identificó la presencia de plumas de sedimentos en suspensión en la superficie del cuerpo de agua del humedal, así como áreas con manchas verdes que señalan zonas cubiertas por plantas acuáticas [18]. Esta problemática se ha dado progresivamente, probablemente a la ausencia de un manejo integral de las actividades productivas debido a que se denotó en la visita de campo la falta de implementación de prácticas sostenibles, control y monitoreo en el humedal, a pesar de, que es un lugar estratégico para la conservación de especies [60].
Por otro lado, la Norma Mexicana estipula que normalmente el rango de carbono para suelos fértiles es entre 1 y 5%, lo cual se incluye con un 3,25% (Tabla 2) dentro de lo establecido y se relaciona con el alto contenido de MO, ya que es una fuente importante de carbono en el suelo [61]. Es importante considerar que, en las piscinas camaroneras, el origen del carbono proviene del alimento, en el cual, tan solo se registra, el 13% de carbono contenido es asimilado, mientras que ese 87% se deposita en el medio o en el fondo de los cuerpos de agua como desechos orgánicos [62].
Mejorar el rendimiento de la producción y a su vez, minimizar los impactos ambientales como la generación de MO en estos sistemas acuáticos cerrados (piscinas camaroneras) es fundamental para que la calidad del agua se mantenga en condiciones de generar vida [63], ya que, si aumenta de manera acelerada la presencia de carbono orgánico por MO puede incidir a condiciones anóxicas, perjudicando la producción e induciendo en casos extremos de mortalidad del camarón [64].
Con relación, al parámetro del fósforo total 3.400 mg/kg (3,40 mg/g) obtenido en el sedimento (Tabla 2) indica que la normativa establece un valor alto cuando es mayor a 11 mg/kg. González y Rosado (2022) afirman que alrededor del 66% del fósforo que ingresa mediante alimentación a los sistemas, se acumulan en el fondo de las piscinas camaroneras como sedimento y que solo una pequeña parte puede ser soluble en el agua [9]. Esto conlleva a la acumulación del sedimento, que, por procesos de escorrentía y drenaje desde las piscinas camaroneras pueden ser transportados al recurso hídrico del humedal, desencadenando excesos de nutrientes y por ende el crecimiento de algas y la disminución del oxígeno disuelto en el ecosistema acuático.
Por otro lado, los datos obtenidos de nitrógeno total alcanzaron un 0,37 % (Tabla 1) siendo muy alto (>0,25) con lo dispuesto en la Normativa Oficial Mexicana NOM-021-RECNAT-2000. De igual forma, en un estudio realizado sobre la influencia del cultivo del camarón sobre los ecosistemas costeros se identificaron valores de nitrógeno total por encima de los 0,30% como indicativo de mala calidad del sedimento debido a la alta concentraciones de nutrientes y materia orgánica provenientes de aguas residuales [65].
Es importante resaltar, que el proceso de eutrofización se da como consecuencia de la acumulación progresiva de nutrientes como la presencia del fósforo, nitrógeno y materia orgánica, conllevando a la disminución del oxígeno en el agua y generando una fuente para el crecimiento de microorganismos patógenos [66]. El fósforo actúa como un elemento limitante, que a pesar de que exista mayor concentración de nitrógeno, el crecimiento de los organismos fotosintéticos dependerá del fósforo, por lo que, el sedimento generado por la actividad camaronera en el humedal La Segua contiene valores altos de N y F, acelerando la eutrofización y con ello, afectando a la calidad de vida de la biodiversidad presente en este medio [67, 68].
En el análisis del pH de la muestra de sedimento de la piscina camaronera obtuvo un valor de 8,64 (Tabla 2) lo cual, indica ser alcalino con respecto a la Norma Oficial Mexicana NOM-021-RECNAT-2000, siendo el rango óptimo de pH para los suelos fértiles entre 5,5 a 7,5. Por tanto, un pH de 8,64 sugiere que el sedimento de la piscina camaronera está experimentando procesos de salinización o acumulación de compuestos alcalinos como carbonatos y bicarbonatos [69]. Es importante considerar que el humedal de La Segua tiene influencia marina, lo que puede contribuir a este pH alcalino. Este parámetro influye en el metabolismo y otros procesos fisiológicos de los camarones, por lo que, un pH inadecuado llegaría a causar estrés, aumentar la vulnerabilidad a enfermedades, afectaciones en la disponibilidad de los nutrientes, reduciendo así, la productividad en el sistema acuático [70].
Por otro lado, el color del sedimento mostró un valor de 44.352 en unidades de Pt-Co (Tabla 2). Aunque la NOM-021-RECNAT-2000 no establece criterios específicos para el color, este alto valor en unidades de Pt-Co podría ser un indicador de contaminación orgánica, indicando la presencia de compuestos húmicos. Estos compuestos pueden afectar la calidad del agua en los sistemas de producción del camarón al interferir con la penetración de la luz, afectando negativamente la producción de plantas bentónicas, reduciendo la fotosíntesis y la producción primaria [71].
Además, el color de los sedimentos puede reflejar la composición y propiedades del suelo, variando según el contenido de agua, la cantidad de materia orgánica y el grado de oxidación de los minerales presentes. En los suelos sumergidos, un valor alto del color como fue del sedimento analizado indica una tonalidad oscura, con mayor contenido de materia orgánica y presencia de compuestos reductores como sulfatos y carbonatos [71]. Estos factores influyen no sólo en la productividad, sino también en la calidad del hábitat para los organismos acuáticos. Por lo tanto, el color de los sedimentos puede ayudar a distinguir secuencias en el perfil del suelo, determinar el origen del material parental, evaluar el estado del drenaje, presencia de sales y carbonatos, que están directamente relacionados con los procesos de acumulación y la calidad del agua para evitar pérdidas en la producción del camarón, así como, el impacto ambiental hacia el humedal La Segua [72].
En el análisis realizado sobre la conductividad eléctrica en la muestra compuesta del sedimento mostró un valor de 0,55 mS (Tabla 2). De acuerdo con la Norma Oficial Mexicana NOM-021-RECNAT-2000, este nivel es considerado adecuado para suelos no salinos. La conductividad eléctrica refleja la concentración de iones, sales y metales conductores en el sedimento, así como la influencia de los residuos de fertilizantes, pesticidas y otros productos utilizados en el manejo de las camaroneras [46]. No obstante, una alta conductividad en el humedal se asocia con la disponibilidad de nutrientes, la actividad microbiana y la descomposición de la materia orgánica [73], anticipando que una conductividad eléctrica relativamente alta podría estar relacionada con el uso de fertilizantes, aditivos, nutrientes y la influencia cercana que ejerce las corrientes de marea en unión con las aguas marítimas y las aguas dulces del humedal.
Análisis de perfil taxonómico para bacterias en una muestra de sedimento
En la identificación del microbiota bacteriano presente en el sedimento, mediante el análisis de perfil taxonómico de la región 16S por secuenciación de alto rendimiento se registra en la Fig. 4:
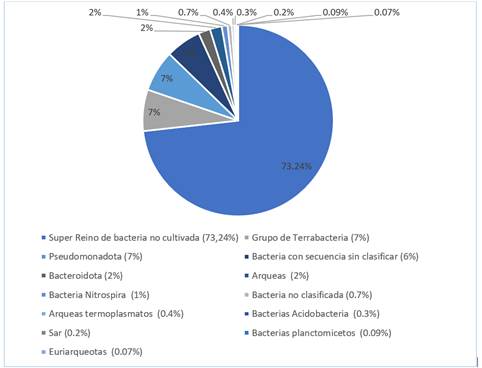
Para el estudio se reveló una gran diversidad bacteriana en la muestra, obteniendo en las secuencias finales, el hallazgo de un índice de identidad del 99% para bacterias. En la diversidad de ecosistemas, las comunidades bacterianas contribuyen en los ciclos biogeoquímicos, en la dinámica de los suelos, calidad del agua como en la reducción de contaminantes, entre otros [74].
Dentro de las bacterias identificadas, se observa en la Fig. 4 que domina el supergrupo de bacterias no cultivadas (73,24%), además de Terrabacteria (7%), Pseudomonadota (7%), grupo de bacteria con secuencia sin clasificar (6%), Bacteroidota (2%), Arqueas (2%), Nitrospira (2%), bacterias no clasificadas (0,7%), Arqueas termoplasmatos (0,4%), Acidobacteria (0,3%), Sar (0,2%), Planctomicetos (0,09%) y Euriarqueotas (0,07%). La importancia de identificar estas bacterias en el sedimento, demuestra la predominancia de ciertos grupos bacterianos existentes en el microbioma, destacando la complejidad y diversidad de estos microorganismos como las interacciones ecológicas que regulan a este medio.
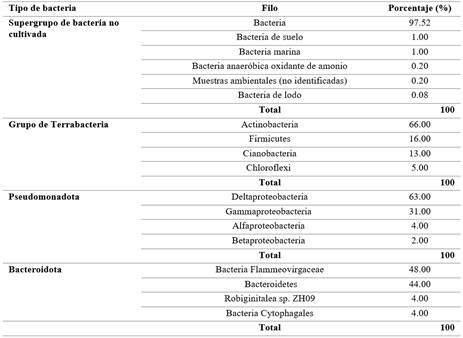
En la categoría del supergrupo de bacterias no cultivadas se denotaron bacterias del suelo, bacterias marinas, bacterias anaerobias oxidantes de amonio y de lodos como se indica en la Tabla 3. Sin embargo, esto representa una vasta cantidad de microorganismos que no lograron la caracterización total, debido a que muchas especies bacterianas tienen dificultades para ser cultivadas in vitro al ser microrganismos parásitos de otros y requieren de fuentes nutricionales selectivas [75].
Respecto a los grupos bacterianos de la Terrabacterias, se abarcan tipos de bacterias como: Actinobacteria (66%); Firmicutes (16%); Cianobacteria (13%) y Chloroflexi(5%) (Tabla 3). Si bien, se ha reportado que los microorganismos como las Actinobacterias alcanzan un porcentaje de degradación en procesos de biorremediación sobre el 80% en suelos contaminados por hidrocarburos poliaromáticos [76], destacando los servicios ecosistemáticos de estas bacterias para la descomposición de compuestos orgánicos y participación en el ciclo de nutrientes.
Los Bacillus, por ejemplo, son un género potencial del filo Firmicutes, y lograron ser identificados en la muestra de la piscina camaronera uniéndose al grupo, los Bacillus sp. m2-38 (86%) y Bacillus sp. GB02-46B (7%). Los Bacillus sp. han logrado reducir en un 16,7% y 22,8% el peso y diámetro en muestras de polietileno (PE) bajo el modelo de consorcio microbiano en un tiempo de 30 días [77], siendo indispensables sus funciones metabólicas para degradar los polímeros que llegan como microplásticos a los ecosistemas acuáticos.
Mientras que, para las Pseudomonadota o Proteobacteriase encontraron clases como: Deltaproteobacteria (63%); Gammaproteobacteria(31%); Betaproteobacteria(4%) y Alfaproteobacteria(2%) (Tabla 2). Específicamente, en comunidades microbianas como las Gammaproteobacterias son vulnerables a la materia orgánica disuelta (MOD) aunque, las Proteobacterias y Betaproteobacterias permiten la descomposición de MO mediante relaciones complejas que mantiene la estabilidad de los ecosistemas acuáticos [78]. Además, en investigaciones anteriores, se identificó una gran diversidad genética por amplificación y secuenciación del gen 16S del ARNr en muestras de ripios de perforación mezclado con fluidos de agua obteniendo 14 cepas bacterianas, una de ellas, la clase Gammaproteobacteria (92,86%) [79].
Para el grupo de las Bacteroidetes o Bacteroidota (2%) se identificaron: bacterias Flammeovirga, Bacteroides, Citofagales y Robiginitalea sp. ZH09 (Tabla 3). En relación a la función de la bacteria Nitrospira (identificada en la muestra), esta influye en la oxidación del nitrito a nitrato, que permite la asimilación y disponibilidad del nitrógeno para las plantas [80].
Los microorganismos en sedimentos son muy variables y se relacionan con la función de las enzimas que favorecen la descomposición de MO, adicionalmente factores como la temperatura, pH, oxígeno disuelto y concentraciones de nutrientes han demostrado poseer una correlación significativa con las comunidades microbianas en agua de los estanques [81]. No obstante, existen ciertos tipos de bacterias que conllevan a una descomposición lenta del sedimento, contribuyendo a la biomasa residual con gran cantidad de nutrientes, debido a que reflejan un aumento en la concentración de P y N [82], situación similar ocurriría en los sedimentos de la producción camaronera evaluada debido a que existe gran cantidad de nutrientes, así como el contenido de materia orgánica (Tabla 3).
Por otra parte, las Acidobacterias y Proteobacterias contribuyen a la producción de biogás [83], útiles para la producción de energía limpia dentro de los beneficios que pueden brindar el aprovechamiento y cultivo de bacterias. Incluso, en un estudio sobre la aplicación de microorganismos en sedimentos de ríos costeros contaminados con metales pesados, se comprobó que sus paredes celulares puedan adsorber estos compuestos inestables como el cobre o cadmio con una eficiencia de remoción hasta el 63% [84, 85] resaltando, la importancia de las bacterias en procesos de descontaminación.
Los microorganismos degradan la materia orgánica y son partícipes en la transformación de los ciclos de los elementos como el N, S, P y Fe, además de fertilizar los suelos y conformar sinergias microbianas a favor de los sistemas radiculares de las plantas [86]. Por tanto, se resalta la importancia de evaluar experimentalmente cada cepa con la finalidad de conocer en gran medida los beneficios que conlleva el cultivo de estos tipos de bacterias ya sea, para procesos de biodegradación o generación de fuentes de energía sostenible.
CONCLUSIONES
La producción camaronera en Ecuador contribuye positivamente a la economía nacional, sin embargo, tiene importantes repercusiones ambientales al ecosistema, por lo que, deberían regularizarse mediante un Estudio de Impacto Ambiental (EIA). El Humedal La Segua representa un ejemplo claro de cómo afectan las intervenciones antropogénicas sobre un ecosistema dinámico, es decir, la actividad camaronera y el impacto que trae consigo la generación de sedimentos hacia el ambiente. Entre la caracterización fisicoquímica del sedimento proveniente de la piscina camaronera, se obtiene un alto contenido de MO que representa un impacto ambiental hacia la dinámica del humedal La Segua debido a la gran carga de productividad biológica del microbioma presente en el sedimento y la acumulación de residuos orgánicos no aprovechados en el sistema de producción, como también los niveles excedentes de carbono orgánico, fósforo y nitrógeno total que aceleran los procesos de eutrofización para el cuerpo receptor de las aguas residuales en el humedal.
Se generó una línea base al identificar la diversidad de microorganismos en el sedimento analizado, pertenecientes al Reino Monera (bacterias) como el supergrupo de las Terrabacterias (7%) y Pseudomonadotas (7%). En las Terrabacterias, se reflejan cuatro filos potenciales y uno de ellos son las Firmicutes donde se destacan las Bacillus sp. que son agentes reconocidos por su eficiencia mayor al 90% en procesos de biorremediación por hidrocarburos. Los estudios de reconocimiento e identificación del microbiota del sedimento, se caracterizan por la gran biodiversidad bacteriana existente en el sedimento, útil para futuros estudios experimentales en procesos de reducción de contaminantes o degradación de MO dados por la actividad camaronera.
FinanciamientoConflicto de interesesContribución de roles











 uBio
uBio