Introducción
Las leguminosas como Leucaena leucocephala (Lam.), pueden favorecer la producción de biomasa de calidad, en temporadas de disminución de las precipitaciones, debido a que poseen un sistema radical pivotante y a la facultad de asociarse con bacterias fijadoras de nitrógeno como Rhizobium, Bradyrhizobium y Mesorhizobium (Xu, et al. 2012; Aguirre-Medina, et al. 2015 y Elzanaty, et al. 2015).
L. leucocephala es una especie ampliamente investigada desde sus propiedades antihelmínticas (Soares, et al. 2015), hasta su empleo multipropósito en los sistemas agroforestales a nivel mundial, más conocida en el Sureste de Asia y en África que en Mesoamérica, donde se originó, es capaz de nodular espontáneamente con los rizobios del lugar, lo que le permite buena adaptación aún en sitios con factores limitantes (nutrición y disponibilidad de agua), lo que le genera una ventaja a nivel ecológico (Schneider, et al. 2013; Peix, et al. 2015 y Rangel, et al. 2017).
En la formación de nódulos, los rizobios quedan separados del citoplasma por una membrana derivada de la planta hospedadora, llamada membrana peribacteroidal (MPB). Seguido de una división continua y sincronizada de los rizobios rodeados de MPBs. Al cesar la división las bacterias se transforman en unas formaciones ramificadas, hinchadas y deformes, llamadas bacteroides (Wang, et al 2001).
Chen y Rolfe (1988), empleando microscopí electrónica de barrido (Scanning Electron Microscopy, SEM) al interior de las raíces, revelaron la deformación de los pelos radiculares por la infección con un Rhizobium de crecimiento rápido (cepa NGR234), y a partir de esta infección evidencian formas bacteroidales al interior de los nódulos de la leguminosa L. leucocephala. Tu (1974) también encontró células de tamaño uniforme bacteroidales, al interior de los nódulos de soya (Glycine max) empleando TEM (Transmission Electron Microscopy) y complementado por SEM.
Trinick (1979), mediante SEM y TEM, menciona que el hilo de la infección propagada por Rhizobium a nuevas células, se transformó en una célula de nódulos Las paredes de los hilos variaron mucho en grosor y a menudo las estructuras de hilo no tenían paredes rígidas y sólo están encerradas por una membrana plasmática.
En la provincia de Santa Elena, Ecuador, L.leucocephala se presenta como una especie alternativa resistente a las sequías para reforestar suelos afectados por la salinidad y cambio climático de la zona, potencializada con una selección de cepas capaces de fijar nitrógeno, promover el crecimiento y resistir ciertas enfermedades (CEDEGÉ, 1983; Soto, et al. 2012 y Soto, et al. 2016).
El objetivo de este trabajo fue caracterizar y evidenciar la presencia de bacterias endófitas al interior de los nódulos de L. leucocephala, de gran importancia para establecer su asociación simbiótica con sus bacterias, en beneficio de su establecimiento adaptativo óptimo en las condiciones de la zona.
Materiales y Métodos
Aislamiento de los nódulos
Se colectaron muestras de hojas, inflorescencia y raíces con presencia de nódulos de Leucaena leucocephala (Lam.) localizadas en los campus de prácticas agrícolas de la Universidad Estatal Península de Santa Elena (Ecuador), ubicadas en las localidades de Río Verde (-2.31096, -80.7056) y La Libertad (-2.24887, -80.858) (Figura 1); luego fueron guardadas y rotuladas en bolsas estériles. En el laboratorio se lavaron cuidadosamente con agua corriente y destilada estéril (Hernández, 2012).
Las muestras vegetales se identificaron en el Herbario de la Universidad de Guayaquil (Ecuador). Los aislamientos y pruebas de caracterización bioquímica de las bacterias se realizaron en el laboratorio del Centro de Investigaciones Agropecuarias (CIAP-UPSE), Facultad de Ciencias Agropecuarias de la Universidad Estatal Península de Santa Elena, mediante métodos descritos por el CIAT, 1987; Ferrera et al. 1993 y Zúñiga, 2012.
Los nódulos se desinfectaron en alcohol al 95 % y solución de cloro al 5% por 5 min respectivamente; enjuagados con agua destilada, macerados y sembrados por triplicado en cajas Petri con medio de cultivo Extracto de Levadura-Manitol-Agar Rojo-Congo LMARC). Luego fueron rotulados e incubados por 72 horas a 27 ˚C.
Caracterización fenotípica:
a) Descripción microscópica de luz y macroscópica de los aislados
Se emplearon microscopios de luz, objetivo 100x inmersión en aceite, para la tinción Gram de las cepas. La descripción macroscópica también incluyó la producción de goma y velocidad de crecimiento de los aislados en las cajas de Petri con medio LMARC (Ferrera y Alarcón, 2001).
b) Descripción microscópica electrónica de Barrido (SEM)
La ultramicroscopía se realizó en el Instituto de Investigaciones en Salud Pública (INSPI Guayaquil, Ecuador) con un microscopio electrónico de barrido (MEB) marca JEOL JSM 5310, en cortes del interior de los nódulos y de cultivos aislados en cajas Petri, como servicio profesional
Caracterización bioquímica
Las pruebas bioquímicas realizadas fueron catalasa, ketolactosa, producción de ácido o álcali, crecimiento en peptona glucosa agar (PGA) y en tres concentraciones de cloruro de sodio. Todos los ensayos fueron sembrados en cajas Petri por triplicado incluyendo controles negativos en cada prueba (Ferrera et al., 1993; Zúñiga, 2012).
Resultados y Discusión
Caracterización fenotípica
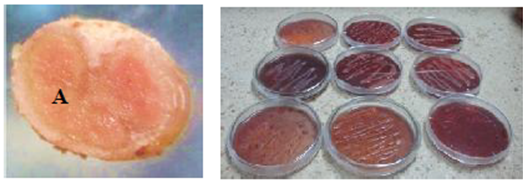
La coloración roja a rosada de los nódulos, coloración y velocidad de crecimiento de las colonias aisladas mostraron la presencia de bacterias bacilares Gram negativas y productoras de goma entre 1 a 4 días de crecimiento aisladas en el medio LMARC, son típicos de las rizobacterias (Figura 2) (Ferrera et al., 1993; Mantilla et al., 2009; Villanueva y Quintana, 2012).
Caracterización bioquímica
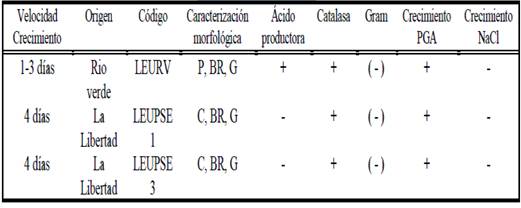
Las pruebas bioquímicas de catalasa y crecimiento en PGA confirman características bacterianas metabólicas de los rizobios; la prueba de ketolactosa descarta la presencia del género Agrobacterium, contaminante común de los aislados (Toniutti, et al., 2015). Las colonias de la cepa LEURV poseen morfología pulminada y es ácido productora, al cambiar el color del medio de púrpura al amarillo; mientras que LEUPSE 1 y LEUPSE 3 presentan formas convexas y no cambiaron el medio PGA, considerándose neutras o alcalino productoras. Los tres aislados presentaron color blanquecino rosáceo, producción de goma y sin crecimiento en el cloruro de sodio (Tabla 1).
SEM del interior de los nódulos y del aislado en cultivo en medio LMARC
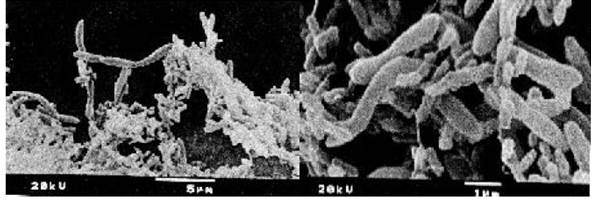
La microscopía de barrrido (SEM) de los nódulos de L. leucocephala (Lam.), confirma la presencia de bacterias bacilares, agrupadas y rodeadas por restos membranales y además con formas bacteroides “curvas” y en “Y” mecionados por Tu, 1974; Trinick, 1979; Chen y Rolfe, 1988 y Wang, et al. 2001.
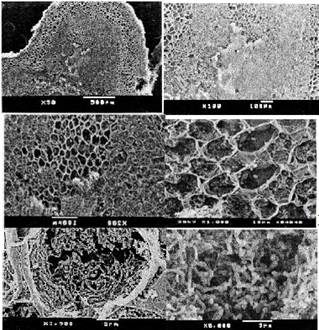
Fig. 3 Secuencia de la magnificación a X50, X100, X200, X1 000, X3 500 y X5 000 de bacterias bacilares mezcladas con restos de membranas peribacteroidales al interior de un nódulo de L. leucocephala (Lam.).
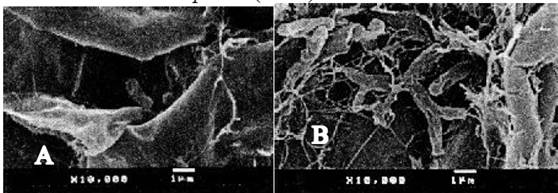
Fig. 4 Microfotografía de dos secciones del interior nódular de L. leucocephala, a X10 000 de bacterias bacilares (A) y Bacteroides (B).
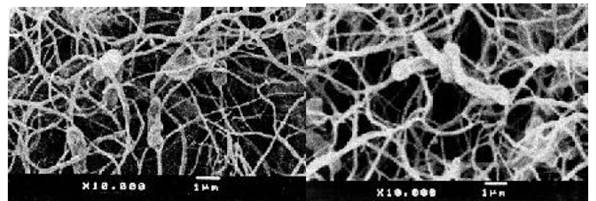
Fig. 5 Comparación de dos secciones al interior del nódulo de L. leucocephala, a X10 000 de bacterias bacilares, en estado de infección avanzada.
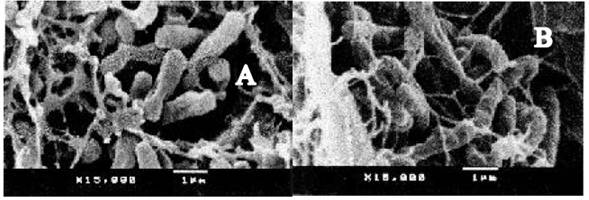
Fig. 6 Dos secciones del interior nodular de L. leucocephala, a X15 000, mostrando formas bacteriodes (A) y Bacilos (B) con restos de membranas.
Conclusiones
Se concluye que los microorganismos endófitos evidenciados al interior de los nódulos de Leucaena leucocephala (Lam) presentan características típicas relacionadas con los simbiontes de las leguminosas, similares a los reportados anteriormente por varios investigadores aquí reportados.
Finalmente, para complementar este estudio se recomienda emplear pruebas moleculares como la amplificación del gen16S RNAr y/o genes constitutivos que permitirían esclarecer la identificación y taxonomía adecuada de las rizobios encontrados. Así como el estudio de esta y otras leguminosas nativas que se podrían considerar para fines agroforestales por su importancia para la fijación de nitrógeno, aprovechamiento forrajero y uso maderable, adaptados a los ecosistemas locales.












 uBio
uBio