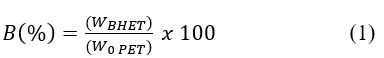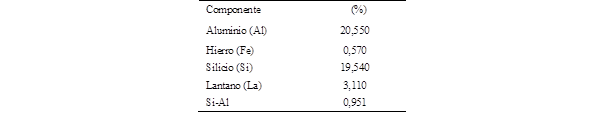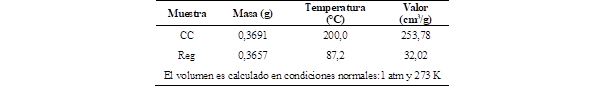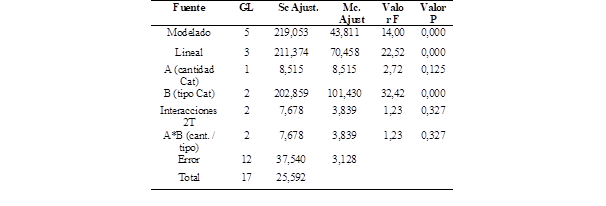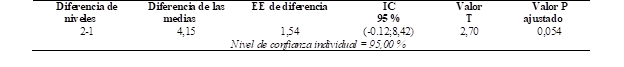INTRODUCCIÓN
En las últimas décadas los plásticos de un solo uso han tenido una creciente demanda debido a su versatilidad y bajo costo, sin embargo una mayor producción conlleva una mayor generación de residuos, los cuales se han convertido en un punto trascendental desde el punto de vista ambiental en la agenda mundial, es así que, se estima que cada año al menos 8 millones de toneladas de residuos plásticos son vertidas a los océanos (Sheel & Pant, 2019), representando una amenaza para la vida marina y el medio ambiente en general. Además, el plástico presenta una naturaleza no biodegradable y es un material que tarda cientos de años en descomponerse, por lo que su acumulación puede tener consecuencias a largo plazo (Al-Sabagh et al., 2016). De este modo, es necesario tomar medidas y concientizar a los estados con el fin de reducir el uso de plásticos de un solo uso, fomentando de este modo la reutilización y el reciclaje, y así buscar alternativas más sostenibles (Sheel & Pant, 2019). En este sentido, la innovación y la investigación son fundamentales para desarrollar e invertir en nuevos materiales y tecnologías que permitan reducir la dependencia del plástico y mejorar la gestión de residuos plásticos (Bahramian, 2021).
A nivel global se han presentado varias iniciativas que se están llevando a cabo, que incluye la implementación de políticas públicas para reducir el consumo de plásticos, la promoción de la economía circular para fomentar la reutilización, y el desarrollo de materiales biodegradables y compostables que sean una alternativa al uso de materiales plásticos los cuales sean menos perjudiciales para el medio ambiente (Sheel & Pant, 2019). Organismos internacionales estimaron que en el año 2015 se generaron más de 6 300 millones de toneladas métricas de residuos plásticos en todo el mundo. Sin embargo, solo el 9 % de esos desechos fue reciclado, el 12 % fue sometido a incineración y el restante 79 % se encuentra acumulado en el medio ambiente (Wang et al., 2018).
De este modo, ante la problemática global generada por el uso excesivo y la gestión inadecuada de estos residuos, han surgido diversas estrategias de reciclaje para abordar este desafío (Sangalang et al., 2015). Una de las alternativas más alentadoras es el reciclaje químico, puesto que ofrece múltiples beneficios, entre ellos la posibilidad de reciclar plásticos de baja calidad que no pueden ser reciclados por métodos convencionales. Además, esta técnica permite la recuperación de compuestos de interés industrial similares a los producidos por petroquímica, reduciendo la dependencia de recursos naturales y la necesidad de producir nuevos plásticos (Al-Sabagh et al., 2016; Fuentes et al., 2020; Ramirez et al., 2010).
Esta técnica se basa en la despolimerización de las cadenas de politereftalato de etileno (PET) (Bahramian, 2021), mediante procesos químicos específicos que permiten su conversión en monómeros, dímeros y oligómeros, así como la producción de subproductos gaseosos (Bertolotti et al., 2005; Stoski et al., 2016), los mismos que pueden ser reutilizados mediante la re-polimerización para obtener plásticos vírgenes (Bertolotti et al., 2005; Fuentes et al., 2020).
En la actualidad, esta problemática ha desatado nuevas formas de tratamiento de los desechos plásticos lo cual ha despertado el interés de la comunidad científica, siendo el reciclaje químico una alternativa para lidiar con este inconveniente (Bertolotti et al., 2005; Raheem et al., 2019).
El uso de calor y la limitada presencia de oxígeno es el principio básico para los métodos convencionales de reciclaje químico como la pirólisis y la gasificación que descomponen el polímero sin que exista combustión en el proceso (Bhoi & Rahman, 2022). Además de estas, existen otros métodos que hacen uso de disolventes como es el caso de la glicólisis, la cual consiste en la despolimerización y rompimiento de las cadenas largas de PET por acción de un glicol, entre ellos se encuentra el etilenglicol, propilenglicol, trietilenglicol (Fuentes et al., 2020; Mendiburu-Valor et al., 2021). El etilenglicol es el disolvente más usado en la obtención de bis-tereftalato de hidroxietilo (BHET). Es importante mencionar que la conversión del dímero de BHET en monómeros de BHET es una reacción donde es necesaria la acción de catalizadores que actúen en la conversión de oligómeros a dímeros o monómeros (Esquer & García, 2019). La glicólisis catalítica es aquella que presenta mayor selectividad hacia el BHET, cuya principal característica es el uso de catalizadores, con la finalidad de aumentar la tasa de conversión de PET a BHET (Esquer & García, 2019; Sheel & Pant, 2019), estos son esenciales para acelerar el proceso de transesterificación entre el etilenglicol y los grupos éster del PET, lo que permite obtener los monómeros de BHET de manera más eficiente. Es así como estudios cinéticos realizados con anterioridad han demostrado la efectividad de los catalizadores ya que por medio de estudios cinéticos, se determinó que la reacción sin el uso de catalizadores es extremadamente lenta, tomando hasta 8 horas para completarse. Así también, la energía de activación para esta reacción sin catalizador es alta con un valor de 32 kcal/mol, en contraste, cuando se utiliza un catalizador, la reacción ocurre mucho más rápido, y la energía de activación necesaria es menor, de 19 kcal/mol (Sangalang et al., 2015).
Los catalizadores presentan una alta actividad debido a su área superficial, porosidad y resistencia térmica, lo que es fundamental para favorecer la interacción entre reactantes y sitios activos, mejorando así la eficiencia del proceso de reacción, asimismo, estos poseen una distribución uniforme y controlable del tamaño de poro (Che et al., 2019; Han et al., 2021; Wang et al., 2018; Zhao et al., 2015; Zheng et al., 2017).
Con este principio, la industria petroquímica hace el uso de catalizadores en el proceso de fluidización para mejorar la calidad de sus productos. Sin embargo, estos pierden su actividad debido al envenenamiento por metales pesados que se adhieren a su superficie. Por lo tanto, es necesario regenerarlos (Fuentes et al., 2020; Gonzalez et al., 2015; Sánchez, 2018). La neutralización de los sitios ácidos producto del envenenamiento disminuye el rendimiento de nafta aumentando así la producción de coque (Berenguer et al., 2006; Sánchez, 2018). En la actualidad, las limitaciones inherentes al método de regeneración opacan la capacidad de ser reutilizados en repetidas ocasiones, lo que implica que haya un término definido en su vida útil (Amiri et al., 2011; Sánchez, 2018).
La inadecuada disposición final de los catalizadores usados en procesos petroquímicos como el cracking catalítico fluidizado (FCC) al finalizar su vida útil, es una importante fuente de contaminación ambiental debido a la presencia de elementos en su composición como metales pesados y otros compuestos nocivos (Amiri et al., 2011). Por lo tanto, se hace necesario establecer un tratamiento final definitivo para minimizar los impactos negativos asociados con estos catalizadores y prevenir efectos perjudiciales sobre el medio ambiente y la salud pública. Partiendo de esta premisa, se ha llevado a cabo una investigación para regenerar y caracterizar al catalizador agotado de la unidad FCC de la refinería de Esmeraldas ubicada en la provincia de Esmeraldas Ecuador, mediante tratamientos térmicos y químicos.
El objetivo del presente trabajo fue la utilización de catalizador FCC agotado en despolimerización de PET mediante glicólisis catalítica con el fin de determinar su acción catalítica al ser regenerado y determinar el rendimiento de la reacción variando la relación de catalizador/plástico, para lo propuesto se comparó con catalizadores previamente estudiados: el catalizador comercial ZSM-5 realizada por Zheng et al. (2017) y el acetato de zinc por Alvarado (2021).
MATERIALES Y MÉTODOS
Diseño experimental
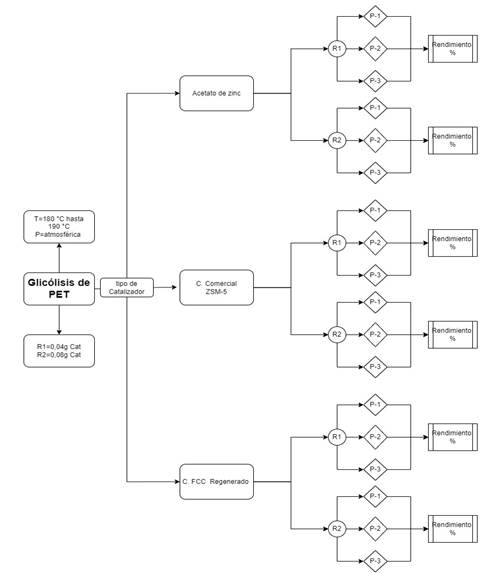
En este estudio, se llevó a cabo el diseño experimental presentado en la Figura 1, el cual tenía como objetivo determinar el efecto de la variación de la cantidad de tres catalizadores en la glicólisis de PET.
Se ejecutaron 18 experimentos, 6 para cada uno de los catalizadores. En cada conjunto de experimentos, se modificó la cantidad de catalizador en 1 % y 2 % en masa del PET utilizado.
La experimentación para cada cantidad y tipo de catalizador se realizó por triplicado para garantizar la confiabilidad de los datos.
A partir de los resultados obtenidos, se calculó el promedio porcentual para evaluar la eficacia de la cantidad y tipo de catalizador empleado en términos del porcentaje de BHET obtenido. Los datos recopilados se analizaron a través de pruebas estadísticas con el propósito de determinar si se presentaron diferencias significativas entre los resultados obtenidos utilizando los diversos catalizadores y cantidades de catalizador
Metodología de regeneración
El catalizador agotado FCC se muestreó de forma completamente aleatoria, y se almacenó mediante la metodología presentada por Andrade (2020) y Palmay (2022b), la cual constituye dos procesos que a continuación se detallan.
2.2.1 Tratamiento químico
Consistió en adicionar 200 mL de etanol al 99,9 % v/v con 20 g de catalizador agotado y verterlos en un matraz erlenmeyer de 500 mL. Esta mezcla se agitó con ayuda de un agitador magnético durante un período de 12 horas a 300 revoluciones por minuto. Luego de este tiempo, se filtró la mezcla con ayuda de una bomba de vacío y se dejó secar por al menos 24 horas a una temperatura de 120 °C.
2.2.2 Tratamiento térmico
En este tratamiento se procedió a trasvasar el catalizador previamente tratado químicamente en un crisol de 50 mL, el mismo que fue introducido en la mufla y por medio de rampas horarias, se llevó al catalizador de 100 a 350 °C con rampas de 50 °C/h , teniendo en cuenta que se mantuvo una hora a la temperatura final para proceder con la siguiente rampa que fue de 25 °C/h hasta lograr los 450 °C y del mismo modo que la primera se realizó la tercera rampa hasta llegar a 700 °C, la misma técnica fue realizada en la mufla Thermolyne modelo f48010-33, finalmente se dejó enfriar la muestra a temperatura ambiente.
Caracterización del catalizador
Uno de los indicadores de actividad catalítica es la acidez (Wang et al., 2018), misma que fue medida por medio de técnicas de desorción de amoníaco, ya que es un indicador clave de la cantidad de centros activos que contiene un catalizador, proceso en el cual la muestra fue desgasificada a 90 °C durante una hora. Posterior a esto, se introdujo en el vial de análisis 0,3 g de muestra y en corriente de He, 25 mL/min, se esperó hasta que se estabilice la señal del detector y se inyectó a 25 °C, 10 mL de amoniaco, al estabilizarse la señal, se elevó la temperatura a 400 °C con rampas de 10 °C/min, obteniendo así el volumen de amoníaco en desorción y se comparó con la curva de calibración existente, en el equipo Micromeritics AutoChem 2920
Glicólisis
Para cada prueba se alimentó 4 g de PET previamente extruido, se añadió 3 mL de etilenglicol y se adicionó el catalizador (1 y 2 % m/m). A continuación, se realizó un calentamiento progresivo hasta alcanzar una temperatura de 190 °C manteniendo agitación continua a revoluciones bajas por dos horas. La cera obtenida se disuelve con agua caliente y agitación durante 30 minutos, luego se filtró la dilución, la torta de filtrado obtenida se enfrió a 4 °C, esto con la finalidad de obtener cristales de BHET y eliminar totalmente el agua, a continuación, se procedió a secar en una estufa por un lapso de 24 horas a 50 °C, el producto obtenido se recoge y se pesa, según la metodología propuesta por Palmay (2022a) y Zhang et al. (2022).
Rendimiento
El rendimiento de la reacción se determinó pesando la cantidad de PET inicial alimentado al reactor, y la cantidad de BHET producido al final de la reacción para lo cual se usó la Ecuación 1:
Donde:
W BHET = cantidad de BHET producido (g)
W 0 PET = cantidad de PET inicial (g)
Caracterización FTIR del BHET
Para determinar los principales grupos funcionales característicos presentes en el BHET, las 18 muestras glicolizadas fueron pulverizadas con ayuda de un mortero con el fin de obtener partículas con un tamaño de 60 um, para su análisis mediante espectrofotometría infrarroja, por medio del espectrofotómetro de infrarrojo FTIR 4 100 de la marca Jasco, cuyo rango de medición del número de onda es de 7 800 a 350 cm -1, resolución máxima de 0,7 cm-1.
RESULTADOS Y DISCUSIÓN
Área superficial
La Figura 2 evidencia que la superficie del catalizador regenerado presenta gran porosidad, lo que establece que existe una mayor área superficial y por ende aumenta la superficie de contacto entre la superficie del catalizador con las moléculas de PET. Además, se observó que la morfología de la muestra analizada presenta una estructura variable en cuanto a su tamaño.
Fuente: (Palmay, 2022b)
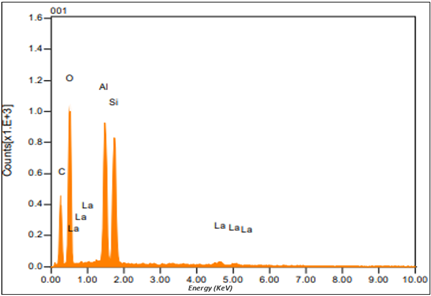
El análisis de composición EDS permitió determinar que el catalizador regenerado tiene un alto contenido de aluminio y silicio, y su relación es cercana a 1 esto es muy característico en catalizadores agotados. Según Palmay (2022b), la cantidad de los componentes principales del catalizador no ha sufrido cambios importantes, además evaluó el nivel de regeneración del
catalizador al comparar la relación Si/Al del catalizador recuperado con los resultados obtenidos de la relación Si/Al para catalizadores nuevos (Kassargy et al., 2017). Este fenómeno se debe a que el etanol presenta una alta capacidad solvente de los contaminantes del catalizador, sin alterar el soporte del catalizador, como se observa en la Tabla 1 y Figura 3.
Caracterización del catalizador
Los datos obtenidos de acidez, mediante desorción de amoníaco en el equipo Micromeritics AutoChem 2 920, se muestran en la Tabla 2, en la cual se pudo observar que la tasa de desorción de amoníaco del catalizador comercial es mayor que la del catalizador regenerado. Esto sugiere que el catalizador comercial cuenta con una mayor cantidad de sitios activos, lo que implica que es más ácido que el catalizador regenerado
Se ha demostrado que la acidez juega un papel importante en la actividad de los catalizadores, ya que los centros activos en la estructura del catalizador son esenciales para romper los enlaces del polímero, puesto que, disminuyen el tiempo y temperatura de reacción (Esquer & García, 2019; Wang et al., 2021).
Para lo cual es importante trabajar con zeolitas protonadas o con puntos ácidos y evitar el uso de zeolitas sódicas que presentan una disminución significativa de la acidez y, por lo tanto, una temperatura de degradación progresivamente más alta (Coelho et al, 2012).
Rendimientos
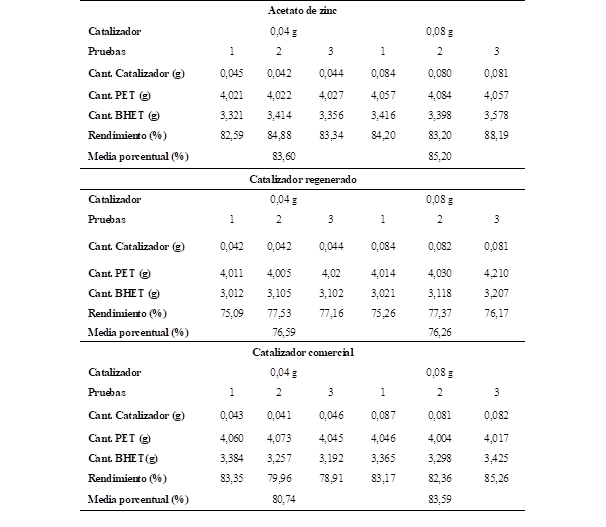
En la Tabla 3, se pueden visualizar los rendimientos de cada uno de los experimentos realizados con los diferentes tipos y cantidades de catalizador y en la Figura 4 se evidencia el histograma de medias porcentuales del rendimiento del catalizador.
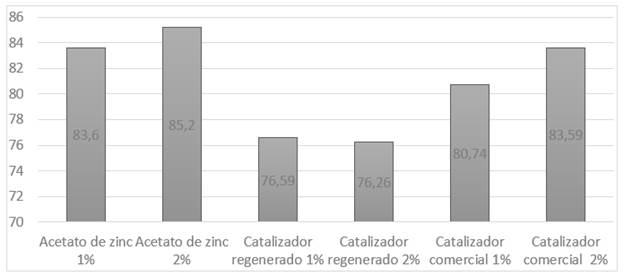
Figura 4 Histograma de medias porcentuales de rendimiento del catalizador en despolimerización de PET
De acuerdo a lo que se presenta en la Figura 4 y al análisis de varianzas de los rendimientos obtenidos en la experimentación se tiene que el catalizador regenerado presenta un rendimiento del 76% aproximadamente y que la cantidad de catalizador estadísticamente no afecta en el porcentaje de producto obtenido. Este rendimiento del catalizador regenerado se atribuye que al ser un catalizador ya agotado y con un re procesamiento pierde los puntos ácidos de su estructura en el procesamiento para su regeneración dificultando el crackeo de las moléculas. Sin embargo, estos rendimientos son alentadores ya que se está orientando a la economía circular alrededor de estos catalizadores.
Se comparó el rendimiento de cada catalizador, obteniendo como resultado que el acetato de zinc tiene el rendimiento más alto en cuanto a la reacción de despolimerización del PET.
Al-Sabagh et al. (2014) y Sheel & Pant (2019), mencionan en sus investigaciones que, los acetatos metálicos constituyen el grupo más activo para la reacción debido a su baja energía de ionización para la activación de los grupos carbonilo, permitiendo la inserción del etilenglicol y por ende la ruptura del polímero, siguiendo el orden Zn+2>Mn+2> Co+2> Pb+2 en cuanto a la eficiencia como catalizador.
Además,Wang et al. (2021) indican que el uso de zeolitas como catalizador es adecuado y sustentable con el medio ambiente, ya que los catalizadores de metales pesados son muy contaminantes.
Con base en los resultados obtenidos, se determinó que la acción catalítica y el rendimiento son mejores en los acetatos metálicos, debido a la capacidad del metal para atacar el grupo carbonilo del polímero. Sin embargo, es importante mencionar que los catalizadores no logran una regeneración completa, lo que disminuye su actividad. Esto se debe a que, durante el proceso de regeneración, las partículas de catalizador pueden quedar entre los sitios intersticiales, lo que reduce el área superficial y, por lo tanto, la actividad catalítica, como se menciona en la investigación de Idriss & Barteau (2000).
Análisis estadístico
En el Software Minitab se obtuvo los datos estadísticos del test ANOVA que se muestra en la Tabla 4, así como simultáneamente se realizó el test de Tukey, con la finalidad de obtener los datos de la influencia que tiene la cantidad (A) y tipo del catalizador (B) en el rendimiento obtenido teniendo en cuenta el diseño experimental que se muestra en la Figura 3.
Se realizaron tres comparativas: la interacción de cantidad de catalizador, tipo de catalizador y la interacción de tipo y cantidad del catalizador y se pudo evidenciar que el tipo de catalizador influye en el rendimiento de la reacción, ya que el nivel de significancia P es mucho menor a 0,05 descartando la hipótesis nula.
Al descartar la hipótesis se procedió a realizar el test de TUKEY, que se observa en la Tabla 5, con el fin de comparar los rendimientos del catalizador comercial y el catalizador regenerado, se puede observar que no existe variación significativa entre el uso de los 2 catalizadores
Espectroscopía FT-IR del producto glicolizado
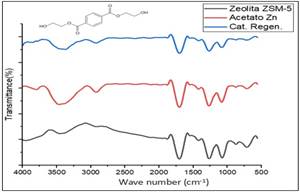
La despolimerización con la acción de glicoles genera monómeros de BHET, el cual posee grupos funcionales inherentes que son más específicos en su huella dactilar, estos fueron identificados con ayuda de métodos de instrumentación, los espectros de cada una de las muestras se presentan en la Figura 5, donde se observa la presencia de grupos funcionales inherentes del BHET mismos que fueron interpretados por Shurvell (2006).
Se identificaron grupos hidroxilo OH¯ en la banda de absorción en 3 417,24 cm-1; mientras que la presencia de grupos alquilo como CH2 y CH3 se evidencia en dos bandas de absorción en 2 965,98 cm-1 y 2 884,99 cm-1.
Asimismo, se detectó el grupo carbonilo por la presencia de la banda de absorción en 1708,62 cm- 1.
Por otro lado, los enlaces carbono hidrógeno C-H son posibles de identificar por la presencia de las bandas de absorción 1 407,78 cm-1; 1 342,21 cm-1; 1 454,06 cm-1 y 1 508,06 cm-1.
Además, se identificaron ésteres en la muestra por la banda de absorción en 1 257,36 cm-1. Por último, las bandas de absorción en 1 018,23 cm-1 y 1 122,37 cm-1 indican la presencia de grupos éteres y alcoholes, mientras que la presencia de un anillo aromático fue detectada en la banda de absorción en 721,25 cm-1.
CONCLUSIONES
Tras el análisis de los resultados obtenidos en el presente estudio de investigación, se ha demostrado que la glicólisis catalítica del PET tiene afinidad por catalizadores de baja selectividad, como es el caso del catalizador de fraccionamiento catalìtico fluidizado (FCC).
En la reaccion de despolimerizacion los resultados obtenidos son prometedores ya que presentan un rendimiento del 76 %, lo que sugiere que el catalizador en cuestión podría ser una alternativa viable para su uso en reciclaje químico.
Por otra parte, la regeneración del catalizador de la unidad de fraccionamiento catalítico fluidizado (FCC) es viable y podría proporcionar una solución sumamente rentable para la disposición final de los residuos de la petroquímica, solucionando problemas de carácter ambiental y económico, mientras que la glicólisis ofrece un valor agregado a los residuos plásticos que carecen de valor y que, al ser tratados con despolimerización, se convierten en materiales nuevamente utilizables en distintos tipos de industrias, siendo el BHET fundamental en la síntesis de diversos materiales poliméricos, que incluyen desde resinas de poliéster insaturadas y tereftalato de polietileno (PET) hasta la elaboración de sistemas biocompatibles novedosos (Xi et al., 2005).
También se ha demostrado que la cantidad del catalizador empleado no influye significativamente en los resultados, posiblemente debido a la irregularidad de su superficie y la limitación de sus sitios activos en comparación con los catalizadores de carácter comercial. Además, el uso de catalizadores no selectivos como el catalizador FCC en glicólisis, contribuye a reducir la dependencia de acetatos metálicos como catalizadores. Cabe destacar que el uso de metales como el plomo y el zinc son altamente selectivos pero sus iones son sumamente contaminantes, lo que hace que su uso no sea una opción viable para procesos químicos sostenibles y respetuosos con el medio ambiente.
En consecuencia, los resultados de este estudio sugieren que el catalizador de la unidad de fraccionamiento catalítico fluidizado (FCC) podría ser una opción prometedora para la glicólisis catalítica del PET y su aplicación en el reciclaje de plásticos, lo que podría contribuir significativamente a la reducción de la contaminación ambiental y el avance hacia una economía circular más sostenible.